- Электролиз раствора серной кислоты
- Электролиз растворов солей нитрата серебра (I), сульфата меди (II) и хлорида золота (III)
- Электролиз
- Электролиз
- Электролиз растворов
- Катодные процессы
- Анодные процессы
- Суммарные процессы электролиза
- Электролиз расплавов
- Электролиз с растворимыми электродами
- Электролиз. 11-й класс
- 🎥 Видео
Видео:Электролиз. Часть 1. Процесс электролиза, основные закономерности.Скачать

Электролиз раствора серной кислоты
Задача 39.
Вычислить массу газа, выделившегося на аноде при электролизе раствора серной кислоты, производившегося в течение 10 мин при силе тока 3 А.
Решение:
р-р H2SO4;
t = 10 мин = 600 с;
I = 3 A;
F = 96 500 Кл/моль
m (O2) — ?
Электролиз раствора серый кислоты сводится к электролизу воды:
На электродах протекают следующие реакции:
Катод: 2|2Н + + 2 
Анод: 1|2H2O — 4 
После сокращения ионов водорода в левой и правой частях уравнения, получим:
Так как на аноде выделяется кислород:
2H2O — 4 
m(O2) = [M(O2) . I . t]/(n . F) = (32 г/моль . 3 А . 600 с)/ (4 . 96500 A . c/моль) = 0,15 г.
Электролиз растворов солей нитрата серебра (I), сульфата меди (II) и хлорида золота (III)
Задача 40.
Через последовательно включенные в цепь постоянного тока растворы нитрата серебра (I), сульфата меди (II) и хлорида золота (III) пропускали ток силой в течение 20 мин. Рассчитайте массы металлов, осевших на катоде.
Решение:
р-ры AgNO3; CuSO4; AuCl3
I = 2,5 A
t = 20 мин = 1200 с
F = 96500 Кл/моль
m (Ag) — ?
m (Cu) — ?
m (Au) — ?
1) Все металлы, катионами которых образованы данные соли, находятся в ряду активности металлов «после водорода», значит на катодах будет протекать реакция восстановления только металлов:
►Ag + + 1 
►Cu 2+ + 2 
►Au 3+ + 3 
2) По формуле объединенного закона электролиза:
m (в-ва) = [M(в-ва) . I . t]/(n . F)
Вычисляем массы металлов, получим:
m(Ag) = (108 г/моль . 2,5 А . 1200 с)/ (1 . 96500 A . c/моль) = 3,358 = 3,36 г;
m(Cu) = (64 г/моль . 2,5 А . 1200 с)/ (2 . 96500 A . c/моль) = 0,995 = 1,00 г;
m(Au) = (197 г/моль . 2,5 А . 1200 с)/ (3 . 96500 A . c/моль) = 2,042 = 2,00 г;
Ответ: m(Cu) = 1 г, m(Ag) = 3,36 г, m(Au) = 2 г.
Видео:Электролиз. 10 класс.Скачать

Электролиз
Видео:607 г 10 раствора хлорида золота(III) подвергали электролизу на инертных электродах до тех пор,Скачать

Электролиз
Химические реакции, сопровождающиеся переносом электронов (окислительно-восстановительные реакции) делятся на два типа: реакции, протекающие самопроизвольно и реакции, протекающие при прохождении тока через раствор или расплав электролита.
Раствор или расплав электролита помещают в специальную емкость — электролитическую ванну .
Электрический ток — это упорядоченное движение заряженных частиц — ионов, электронов и др. под действием внешнего электрического поля. Электрическое поле в растворе или расплаве электролита создают электроды .
Электроды — это, как правило, стержни из материала, проводящего электрический ток. Их помещают в раствор или расплав электролита, и подключают к электрической цепи с источником питания.
При этом отрицательно заряженный электрод катод — притягивает положительно заряженные ионы — катионы . Положительно заряженный электрод ( анод ) притягивает отрицательно заряженные частицы ( анионы ). Катод выступает в качестве восстановителя, а анод — в качестве окислителя.
Различают электролиз с активными и инертными электродами. Активные (растворимые) электроды подвергаются химическим превращениям в процессе электролиза. Обычно их изготавливают из меди, никеля и других металлов. Инертные (нерастворимые) электроды химическим превращениям не подвергаются. Их изготавливают из неактивных металлов, например, платины , или графита .
Видео:электролиз хлорида натрияСкачать
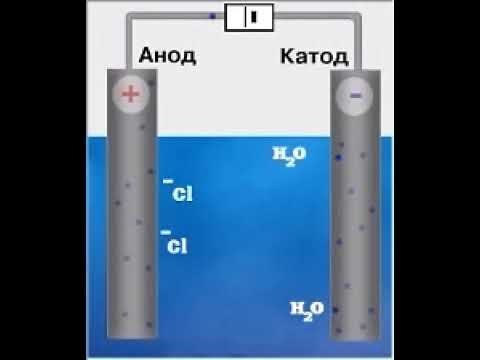
Электролиз растворов
Различают электролиз раствора или расплава химического вещества. В растворе присутствует дополнительное химическое вещество — вода, которая может принимать участие в окислительно-восстановительных реакциях.
Катодные процессы
В растворе солей катод притягивает катионы металлов. Катионы металлов могут выступать в качестве окислителей. Окислительные способности ионов металлов различаются. Для оценки окислительно-восстановительных способностей металлов применяют электро-химический ряд напряжений :
Каждый металл характеризуется значением электрохимического потен-циала. Чем меньше потенциал , тем больше восстановительные свойства металла и тем меньше окислительные свойства соответствующего иона этого металла. Разным ионам соответствуют разные значения этого потенциала. Электрохимический потенциал — относительная величина. Электрохимический потенциал водорода принят равным нулю.
Также около катода находятся молекулы воды Н2О. В составе воды есть окислитель — ион H + .
При электролизе растворов солей на катоде наблюдаются следующие закономерности:
1. Если металл в соли — активный ( до Al 3+ включительно в ряду напряжений ), то вместо металла на катоде восстанавливается (разряжается) водород , т.к. потенциал водорода намного больше. Протекает процесс восстановления молекулярного водорода из воды, при этом образуются ионы OH — , среда возле катода — щелочная:
2H2O +2ē → H2 + 2OH —
Например , при электролизе раствора хлорида натрия на катоде будет вос-станавливаться только водород из воды.
2. Если металл в соли – средней активности (между Al 3+ и Н + ) , то на катоде восстанавливается (разряжается) и металл , и водород , так как потенциал таких металлов сравним с потенциалом водорода:
Me n+ + nē → Me 0
2 H + 2O +2ē → H2 0 + 2OH —
Например , при электролизе раствора сульфата железа (II) на катоде будет восстанавливаться (разряжаться) и железо, и водород:
Fe 2+ + 2ē → Fe 0
2 H + 2O +2ē → H2 0 + 2OH —
3. Если металл в соли — неактивный (после водорода в ряду стандартных электрохимических металлов) , то ион такого металла является более сильным окислителем, чем ион водорода, и на катоде восстанавливается только металл:
Me n+ + nē → Me 0
Например, при электролизе раствора сульфата меди (II) на катоде будет восстанавливаться медь:
Cu 2+ + 2ē → Cu 0
4. Если на катод попадают катионы водорода H + , то они и восстанавливаются до молекулярного водорода:
2H + + 2ē → H2 0
Анодные процессы
Положительно заряженный анод притягивает анионы и молекулы воды. Анод – окислитель. В качестве восстановителей выступаю либо анионы кислотных остаток, либо молекулы воды (за счет кислорода в степени окисления -2: H 2 O -2 ).
При электролизе растворов солей на аноде наблюдаются следующие закономерности:
1. Если на анод попадает бескислородный кислотный остаток , то он окисляется до свободного состояния (до степени окисления 0):
неМе n- – nē = неМе 0
Например : при электролизе раствора хлорида натрия на аноде окисляют-ся хлорид-ионы:
2Cl — – 2ē = Cl2 0
Действительно, если вспомнить Периодический закон: при увеличении электроотрицательности неметалла его восстановительные свойства уменьшаются. А кислород – второй по величине электроотрицательности элемент. Таким образом, проще окислить практически любой неметалл, а не кислород. Правда, есть одно исключение . Наверное, вы уже догадались. Конечно же, это фтор. Ведь электроотрицательность фтора больше, чем у кислорода. Таким образом, при электролизе растворов фторидов окисляться будут именно молекулы воды, а не фторид-ионы :
2H2 O -2 – 4ē → O2 0 + 4H +
2. Если на анод попадает кислородсодержащий кислотный остаток, либо фторид-ион , то окислению подвергается вода с выделением молекулярно-го кислорода:
2H2 O -2 – 4ē → O2 0 + 4H +
3. Если на анод попадает гидроксид-ион, то он окисляется и происходит выделение молекулярного кислорода:
4 O -2 H – – 4ē → O2 0 + 2H2O
4. При электролизе растворов солей карбоновых кислот окислению под-вергается атом углерода карбоксильной группы, выделяется углекислый газ и соответствующий алкан.
Например , при электролизе растворов ацетатов выделяется углекислый газ и этан:
2 CH3 C +3 OO – –2ē → 2 C +4 O2+ CH3-CH3
Суммарные процессы электролиза
Рассмотрим электролиз растворов различных солей.
Например , электролиз раствора сульфата меди. На катоде восстанавливаются ионы меди:
Катод (–): Cu 2+ + 2ē → Cu 0
На аноде окисляются молекулы воды:
Анод (+): 2H2 O -2 – 4ē → O2 + 4H +
Сульфат-ионы в процессе не участвуют. Мы их запишем в итоговом уравнении с ионами водорода в виде серной кислоты:
2 Cu 2+ SO4 + 2H2 O -2 → 2 Cu 0 + 2H2SO4 + O2 0
Электролиз раствора хлорида натрия выглядит так:
На катоде восстанавливается водород:
Катод (–): 2 H + 2O +2ē → H2 0 + 2OH –
На аноде окисляются хлорид-ионы:
Анод (+): 2 Cl – – 2ē → Cl2 0
Ионы натрия в процессе электролиза не участвуют. Мы записываем их с гидроксид-анионами в суммарном уравнении электролиза раствора хлорида натрия :
2 H + 2O +2Na Cl – → H2 0 + 2NaOH + Cl2 0
Следующий пример : электролиз водного раствора карбоната калия.
На катоде восстанавливается водород из воды:
Катод (–): 2 H + 2O +2ē → H2 0 + 2OH –
На аноде окисляются молекулы воды до молекулярного кислорода:
Анод (+): 2H2 O -2 – 4ē → O2 0 + 4H +
Таким образом, при электролизе раствора карбоната калия ионы калия и карбонат-ионы в процессе не участвуют. Происходит электролиз воды:
2 H2 + O -2 → 2 H2 0 + O2 0
Еще один пример : электролиз водного раствора хлорида меди (II).
На катоде восстанавливается медь:
Катод (–): Cu 2+ + 2ē → Cu 0
На аноде окисляются хлорид-ионы до молекулярного хлора:
Анод (+): 2 Cl – – 2ē → Cl2 0
Таким образом, при электролизе раствора карбоната калия происходит электролиз воды:
Cu 2+ Cl2 – → Cu 0 + Cl2 0
Еще несколько примеров: электролиз раствора гидроксида натрия.
На катоде восстанавливается водород из воды:
Катод (–): 2 H + 2O +2ē → H2 0 + 2OH –
На аноде окисляются гидроксид-ионы до молекулярного кислорода:
Анод (+): 4 O -2 H – – 4ē → O2 0 + 2H2O
Таким образом, при электролизе раствора гидроксида натрия происходит разложение воды, катионы натрия в процессе не участвуют:
2 H2 + O -2 → 2 H2 0 + O2 0
Видео:Все об электролизе и задании 20 за 20 минут | Химия ЕГЭ 2023 | УмскулСкачать

Электролиз расплавов
При электролизе расплава на аноде окисляются анионы кислотных остатков, а на катоде восстанавливаются катионы металлов. Молекул воды в системе нет.
Например: электролиз расплава хлорида натрия. На катоде восстанавли-ваются катионы натрия:
Катод (–): Na + + ē → Na 0
На аноде окисляются анионы хлора:
Анод (+): 2 Cl – – 2ē → Cl2 0
Суммарное уравнение электролиза расплава хлорида натрия:
2 Na + Cl – → 2 Na 0 + Cl2 0
Еще один пример: электролиз расплава гидроксида натрия. На катоде восстанавливаются катионы натрия:
Катод (–): Na + + ē → Na 0
На аноде окисляются гидроксид-ионы:
Анод (+): 4 OH – – 4ē → O2 0 + 2H2O
Суммарное уравнение электролиза расплава гидроксида натрия:
4 Na + OH – → 4 Na 0 + O2 0 + 2H2O
Многие металлы получают в промышленности электролизом расплавов.
Например , алюминий получают электролизом раствора оксида алюминия в расплаве криолита. Криолит – Na3[AlF6] плавится при более низкой температуре (1100 о С), чем оксид алюминия (2050 о С). А оксид алюминия отлично растворяется в расплавленном криолите.
В растворе криолите оксид алюминия диссоциирует на ионы:
На катоде восстанавливаются катионы алюминия:
Катод (–): Al 3+ + 3ē → Al 0
На аноде окисляются алюминат-ионы:
Анод (+): 4Al O 3 3 – – 12ē → 2Al2O3 + 3 O2 0
Общее уравнение электролиза раствора оксида алюминия в расплаве криолита:
2 Al 2 О 3 = 4 Al 0 + 3 О 2 0
В промышленности при электролизе оксида алюминия в качестве электродов используют графитовые стержни. При этом электроды частично окисляются (сгорают) в выделяющемся кислороде:
C 0 + О2 0 = C +4 O2 -2
Видео:Электролиз раствора нитрата калияСкачать

Электролиз с растворимыми электродами
Если материал электродов выполнен из того же металла, который присут-ствует в растворе в виде соли, или из более активного металла, то на аноде разряжаются не молекулы воды или анионы, а окисляются частицы самого металла в составе электрода.
Например , рассмотрим электролиз раствора сульфата меди (II) с медными электродами.
На катоде разряжаются ионы меди из раствора:
Катод (–): Cu 2+ + 2ē → Cu 0
На аноде окисляются частицы меди из электрода :
Анод (+): Cu 0 – 2ē → Cu 2+
Видео:Получаю золото из раствора этим методом и чихаю на все реактивы!Скачать

Электролиз. 11-й класс
Класс: 11
Цели:
Оборудование: таблицы “Растворимость кислот, солей, оснований в воде”, “Электрохимический ряд напряжений металлов”, “Электрохимическое производство”, ПК, проектор.
План урока
1. Организация урока.
Учитель: Ребята, мы с вами продолжим изучение химических реакций. Тема урока “Электролиз”.
Домашнее задание: параграф 19, вопросы 7-10, задача 15.37(Хомченко), задачи №2,3 (стр. 89), материалы ЕГЭ В-3.
II. Изучение новой темы.
Мы должны знать:
— какие реакции называются электролизом;
— какие вещества подвергаются электролизу;
— как происходит электролиз: а) расплавов, б) растворов различных электролитов;
Электролиз — окислительно-восстановительные реакции, протекающие на электродах, если через раствор или расплав электролита пропускают постоянный электрический ток.
1. Электролизу подвергаются расплавы и растворы электролитов.
2. При электролизе химическая реакция осуществляется за счет энергии электрического тока, подводимой извне.
3. Электролиз проводят в особых приборах – электролизерах. Основные процессы протекают на электродах – катодах и анодах.
Рассмотрим протекание электролиза на инертных электродах:
Электролиз расплавов хлорида натрия, йодида калия, получение алюминия (использование таблицы “Электрохимическое производство”):
на катоде (“-”) Na + + 1e —> Na 0
на катоде (“-”) K + + 1e > K 0
в) Современный способ получения алюминия изобрели американец Ч.Холл и француз П.Эру в 1886 году из раствора оксида алюминия в расплавленном криолите. В результате чего стоимость алюминия резко упала: если в 1854 году стоимость 1 кг алюминия составила 1200 рублей, т.е. в 270 раз дороже серебра, то в 1899 году — 1 рубль.
Металлы, расположенные в электрохимическом ряду напряжений левее марганца, получают из расплавов солей.
Алюминий получают из раствора оксида в расплавленном криолите.
2. Электролиз растворов солей имеет особенности, т. к. в реакции могут участвовать еще молекулы воды. При электролизе растворов солей с инертным электродом используют следующие правила (работа по таблице “Электрохимическое напряжение металлов”):
а) на катоде (“-”) восстанавливается вода и выделяется водород, если металл расположен левее марганца,
б) восстанавливается металл, если металл расположен правее водорода;
в) если металл находится между марганцем и водородом, то в зависимости среды реакции могут восстанавливаться металл и водород.
На аноде (“+”) происходит окисление:
выделяется кислород O2
Протекает та реакция, которая требует наименьшую затрату энергии.
Электролизу подвергаются соли органических кислот по следующей схеме:
Выполнение задания 15.41. (по Хомченко)
на катоде (“-”) 2H +1 2O -2 + 2e —> H2 + 2OH —
Металлы, расположенные левее марганца, можно получить из расплавов солей.
на катоде (“-”) Fe 2+ + 2e —> Fe 0 восстановление
Пример 1. Электролиз водного раствора хлорида бария на инертных электродах:
на катоде (“-”) 2H +1 2O -2 + 2e —> H2 + 2OH —
на катоде восстанавливаются молекулы воды
Пример 2. Электролиз раствора гидроксида рубидия:
на катоде (“-”) 2H +1 2O -2 + 2e —> H2 + 2OH —
2H2O —> 2H2 + O2 , т.е. гидроксид рубидия RbOH не участвует.
Пример 3. Задача №4 (стр. 89 учебника):
При электролизе водного раствора нитрата серебра (I) выделилось 5,6 л газа. Сколько граммов металла отложилось на катоде?
Ответ: на катоде отложилось 108 г серебра.
Сообщения учащихся о применении электролиза.
1-й ученик: Электролитическое осаждение металлов из растворов солей на поверхность изделий – гальванотехника – появляется в первой половине 19 веке и она связана с именем русского ученого и инженера Б.С.Якоби. В 1838 году он получил тонкие металлические копии с предметов сложной формы. Этот способ был назван гальванопластикой и в наши дни нашел широкое применение в полиграфии и в монетном деле.
2-й ученик: Гальванотехника ученым была использована и в других целях: если в качестве катода использовать металлическую деталь или конструкцию, то они будут покрываться тонкой металлической пленкой. Этот способ нанесения покрытий, называемый гальваностегией, применяют для защиты железных и стальных изделий от коррозии. Оцинкование, хромирование, никелирование, лужение (оловом), меднение, золочение, серебрение, платинирование – это отдельные виды гальваностегии.
Учитель: Электролиз используют для очистки меди, никеля, свинца, серебра, золота (электролитическое рафинирование). Электролизом получают активные металлы отличающиеся высокой чистотой, активные неметаллы (хлор, фтор), сложные вещества, широко применяемые в химической промышленности (например, едкий натр, едкий калий, хлорат калия и др.). Получают электронные платы, служащие основой всех электронных изделий (чипы, микросхемы, сотовые телефоны, цифровые фотоаппараты, приборы для управления движением, приборы регулирующие отопление, компьютеры).
А как получают платы? На диэлектрик наклеивают тонкую медную пластину, особой краской наносят сложную картину соединяющих проводов. Пластинку помещают в электролит, где вытравливаются незакрытые краской участки медного слоя, потом краска смывается и на плате появляются детали микросхем.
3-й ученик: Для ремесленников и любителей гальванотехники исследователями были опубликованы многочисленные пособия и руководства. Первой книгой на татарском языке была “С?наиге галфания” К.Насыри. Она была издана в Императорском университете Казани в 1900 году. Татарские ювелиры с древних времен славились изготовлением прекрасных ювелирных изделий. Однако в их технологии использовались не только золото и серебро, но и другие металлы и сплавы с нанесением на них золотых и серебряных покрытий путем амальгамирования, т.е. нанесения на поверхность изделия растворенного в ртути золота или серебра, а пары ртути вредны для здоровья человека. Поэтому для татарских ремесленников книга К.Насыри была крайне необходима.
Учитель: Спасибо за интересные сообщения.
Самостоятельная работа на компьютере.
Установите соответствие между формулой вещества и продуктом, который образуется при электролизе водного раствора этого вещества:
🎥 Видео
Часть 3-2. Электролиз водных растворов. Примеры решений уравнений (подробно).Скачать

Опыты по химии. Электролиз раствора хлорида медиСкачать

Как писать уравнения электролиза? | Химия ЕГЭ 2022 | УмскулСкачать

ХИМИЯ Задание 22 ЕГЭ 2019 Электролиз растворов солей Нитрат натрия Видеоурок Вебинар 9, 11 классыСкачать

Электролиз растворов. 3 часть. 10 класс.Скачать
Электролиз золота какая нужна зарядка для электролизаСкачать

ЭЛЕКТРОЛИЗ ЗАСТРЯВШЕГО ЗОЛОТА ИЗ РАСТВОРА ЦАРЯ !Скачать

Золото методом электролизаСкачать

Опыты по химии. Электролиз раствора сульфата натрияСкачать

Металлы. Тема 39. Электролиз расплавов солей. Видеоопыт «Электролиз раствора хлорида меди»Скачать

Делаю электролиз раствора нитрата калия при помощи модуля НПО УнитехСкачать

САМЫЙ ПРОСТОЙ СПОСОБ ПОЛУЧИТЬ ЗОЛОТО ИЗ РАСТВОРА.(ЭЛЕКТРОЛИЗ)...GOLDEN CHANNEL...Скачать

Электролиз | ХИМИЯ ЕГЭ | Лия МенделееваСкачать





