I. Коррозия металлов и методы защиты от коррозии.
Задание 1. Коррозия металлов в кислой среде.
Zn + 2HCl = ZnCl2 + H2↑ (достаточно активный металл реагирует с кислотой с выделение водорода)
Cu + HCl = нет признаков реакции (Медь стоит после водорода в ряду активности металлов, и не реагирует с кислотами с выделением водорода)
Процессы, возможные на аноде:
· Zn – 2e → Zn 2+ (EZn 2+ /Zn= -0.763B) → имеет наименьший потенциал, на аноде протекает именно эта реакция
Процессы, возможные на катоде:
· 2H + + 2e → H2↑ (кислая среда, поэтому E2H + /H2=0B) протекает именно эта реакция.
Вывод: до начала опыта мы видели, что цинк активно реагирует с соляной кислотой, в то время, как медь не проявляет никаких признаков реакции. Однако, как только образовалась гальванопара, на цинке прекратилось выделение водорода и оно началось на меди. На самом деле медь не начала растворяться в соляной кислоте, просто в результате работы гальванической пары катодный процесс – выделение водорода(катод – пластинка меди), а анодный – растворение цинка(растворение анода), от сюда можно сделать вывод, что контакт более активного металла с менее активным никак не влияет на коррозию исходного металла.
Задание 2. Коррозия при участии гальванических микроэлементов(коррозия углеродной стали).
Углерод, как инертный электрод, выступает в качестве катода.
Возможные анодные реакции:
· Fe – 2e → Fe 2+ (EFe 2+ /Fe= -0.441B) → имеет наименьший потенциал, следовательно протекает именно эта реакция.
Возможные процессы на катоде:
· [Fe(CN)6] 3- + e → [Fe(CN)6] 4- (E[Fe(CN)6] 3- /[Fe(CN)6] 4- = 0.543B) → обладает наибольшим потенциалом, поэтому именно она будет протекать на катоде.
Выводы: наблюдая образования многочисленных гальванических микроэлементов(вкрапления углерода в стали) можно сделать вывод, что различные примеси в металле могут служить причиной быстрой коррозии этого металла.
Задание 3. Протекторная защита от коррозии.
· Zn – 2e → Zn 2+ (EZn 2+ /Zn = -0.763B) → имеет наименьший потенциал, на аноде протекает именно эта реакция
Вывод: около железа наблюдается окрашивание раствора в малиновый цвет, а так как индикатор, который мы используем в данном задании – ф/ф, то окраска свидетельствует о щелочной среде, которая наблюдается около железа, следовательно выделяются гидроксид ионы, что является доказательством работы гальванической пары. Из работы можно сделать вывод, что при соприкосновении металла, который мы хотим защитить от коррозии, с более активным металлом(металлом, имеющим меньший потенциал) можно обеспечить протекторную защиту изделия.
Задание 4. Электрозащита от коррозии.
· Fe – 2e → Fe 2+ (EFe 2+ /Fe= -0.441B) → имеет наименьший потенциал, протекает именно эта реакция.
· Fe 2+ – e → Fe 3+ (EFe 3+ /Fe 2+ = 0.771B)
На катоде вначале протекает реакция восстановления Fe(III) до Fe(II) в комплексном ионе, но так как красной кровяной соли в растворе не очень много, очень скоро все комплексные ионы оказываются восстановленными, и начинается восстановление водорода из воды.
Вывод: около анода начинает выделятся окрашенная синяя «рубашка»
Очевидно, что ионы железа Fe 3+ появляются в результате окисления ионов железа Fe 2+ до Fe 3+ на воздухе, чему способствует кислород, который находится в воздухе.
В ходе работы установили, что отличным способом зашиты металла от коррозии может служить анодная защита, так как анод не коррозирует при пропускании тока.
II. Электролиз водных растворов солей.
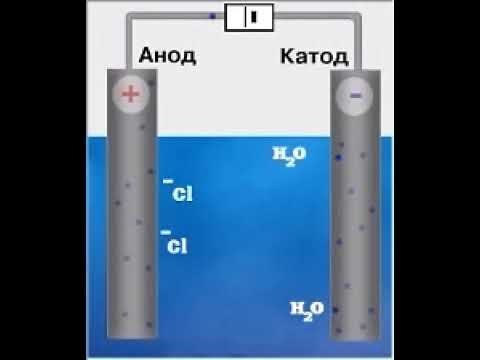
Задание 1. Электролиз иодида калия KI.
(Анод) + C|KI, H2O, фф|C – (катод)
· 2I — — 2e → I2↓ (E2I — /I2 = 0.535 B) → имеет наименьший потенциал, протекает именно эта реакция.
· 2H2O + 2e → H2↑ + 2OH — (E2H2O/H2= -0.414B) → имеет наибольший потенциал, протекает именно эта реакция.
Вывод: Растворы окрасились так как идет выделение йода (имеющий желтый цвет) около анода, и выделение гидроксид ионов около катода, если учесть, что в растворе находится ф/ф, который в щелочной среде окрашивается в малиновый цвет, что мы и наблюдаем около катода.
Задание 2. Электролиз сульфата натрия Na2SO4
· SO4 2- в водной среде не подвергается окислению.
· 2H2O + 2e → H2↑ + 2OH — (E2H2O/H2= -0.414B) → имеет наибольший потенциал, протекает именно эта реакция.
Вывод: предварительно рассчитав анодный и катодные процессы в «анодную» трубку U-образной колбы добавим индикатор метиловый оранжевый, а в «катодную» — фенолфталеин. В результате электролиза выделяются ионы водорода и гидроксид ионы около анода и катода соответственно. В ходе электролиза раствор около анода окрасится в красный цвет, что говорит от выделении ионов водорода а около катода раствор окрасится в розовый цвет, что свидетельствует о наличии гидроксид ионов.
Общий вывод: в ходе работы достаточно подробно изучили основы электрохимии, а точнее коррозию металлов и способы защиты от нее, а так же электролиз водных растворов некоторых солей.
Видео:Опыты по химии. Электролиз раствора йодида калияСкачать

Электролиз иодида калия уравнения катодного и анодного процессов
16 лет успешной работы в сфере подготовки к ЕГЭ и ОГЭ!
1602 поступивших (100%) в лучшие вузы Москвы
Подготовка к ЕГЭ, ОГЭ и предметным Олимпиадам в Москве
| До окончания записи осталось: | |||||||
| Записаться в Летнюю Школу’22! | |||||||
- home
- map
У Вас возникли вопросы?
Мы обязательно Вам перезвоним:
Электролиз раствора йодида калия
Распад химических веществ под действием электрического тока называется электролизом. Электролиз йодида калия происходит с образованием щелочи, водорода (на катоде) и йода (на аноде):
Для проведения опыта приготавливается электролизер и две пробирки с раствором иодида калия.
В первую пробирку (для катода) добавляется фенолфталеин для определения щелочной среды. Во вторую (для анода) добавляется крахмал для качественной реакции на йод.
Пробирки помещаются на электроды, и подключается ток. При пропускании тока через раствор на катоде наблюдается выделение водорода – раствор с фенолфталеином приобретает малиновый цвет, так как образовалась щелочь KOH. На аноде выделился йод, который окрасил крахмальный раствор в синий цвет.
Мы видим, как при электролизе раствора йодида калия происходит образование гидроксида калия, йода и водорода.
Видео:Электролиз раствора иодида калияСкачать

Электролиз
Электролиз (греч. elektron — янтарь + lysis — разложение) — химическая реакция, происходящая при прохождении постоянного тока через электролит. Это разложение веществ на их составные части под действием электрического тока.
Процесс электролиза заключается в перемещении катионов (положительно заряженных ионов) к катоду (заряжен отрицательно), и отрицательно заряженных ионов (анионов) к аноду (заряжен положительно).
Итак, анионы и катионы устремляются соответственно к аноду и катоду. Здесь и происходит химическая реакция. Чтобы успешно решать задания по этой теме и писать реакции, необходимо разделять процессы на катоде и аноде. Именно так и будет построена эта статья.
Катод
К катоду притягиваются катионы — положительно заряженные ионы: Na + , K + , Cu 2+ , Fe 3+ , Ag + и т.д.
Чтобы установить, какая реакция идет на катоде, прежде всего, нужно определиться с активностью металла: его положением в электрохимическом ряду напряжений металлов.
Если на катоде появился активный металл (Li, Na, K) то вместо него восстанавливаются молекулы воды, из которых выделяется водород. Если металл средней активности (Cr, Fe, Cd) — на катоде выделяется и водород, и сам металл. Малоактивные металлы выделяются на катоде в чистом виде (Cu, Ag).
Замечу, что границей между металлами активными и средней активности в ряду напряжений считается алюминий. При электролизе на катоде металлы до алюминия (включительно!) не восстанавливаются, вместо них восстанавливаются молекулы воды — выделяется водород.
В случае, если на катод поступают ионы водорода — H + (например при электролизе кислот HCl, H2SO4) восстанавливается водород из молекул кислоты: 2H + — 2e = H2
К аноду притягиваются анионы — отрицательно заряженные ионы: SO4 2- , PO4 3- , Cl — , Br — , I — , F — , S 2- , CH3COO — .
При электролизе кислородсодержащих анионов: SO4 2- , PO4 3- — на аноде окисляются не анионы, а молекулы воды, из которых выделяется кислород.
Бескислородные анионы окисляются и выделяют соответствующие галогены. Сульфид-ион при оксилении окислении серу. Исключением является фтор — если он попадает анод, то разряжается молекула воды и выделяется кислород. Фтор — самый электроотрицательный элемент, поэтому и является исключением.
Анионы органических кислот окисляются особым образом: радикал, примыкающий к карбоксильной группе, удваивается, а сама карбоксильная группа (COO) превращается в углекислый газ — CO2.
Примеры решения
В процессе тренировки вам могут попадаться металлы, которые пропущены в ряду активности. На этапе обучения вы можете пользоваться расширенным рядом активности металлов.
Теперь вы точно будете знать, что выделяется на катоде 😉
Итак, потренируемся. Выясним, что образуется на катоде и аноде при электролизе растворов AgCl, Cu(NO3)2, AlBr3, NaF, FeI2, CH3COOLi.
Иногда в заданиях требуется записать реакцию электролиза. Сообщаю: если вы понимаете, что образуется на катоде, а что на аноде, то написать реакцию не составляет никакого труда. Возьмем, например, электролиз NaCl и запишем реакцию:
NaCl + H2O → H2 + Cl2 + NaOH (обычно в продуктах оставляют именно запись «NaOH», не подвергая его дальнейшему электролизу)
Натрий — активный металл, поэтому на катоде выделяется водород. Анион не содержит кислорода, выделяется галоген — хлор. Мы пишем уравнение, так что не можем заставить натрий испариться бесследно 🙂 Натрий вступает в реакцию с водой, образуется NaOH.
Запишем реакцию электролиза для CuSO4:
Медь относится к малоактивным металлам, поэтому сама в чистом виде выделяется на катоде. Анион кислородсодержащий, поэтому в реакции выделяется кислород. Сульфат-ион никуда не исчезает, он соединяется с водородом воды и превращается в серую кислоту.
Электролиз расплавов
Все, что мы обсуждали до этого момента, касалось электролиза растворов, где растворителем является вода.
Перед промышленной химией стоит важная задача — получить металлы (вещества) в чистом виде. Малоактивные металлы (Ag, Cu) можно легко получать методом электролиза растворов.
Но как быть с активными металлами: Na, K, Li? Ведь при электролизе их растворов они не выделяются на катоде в чистом виде, вместо них восстанавливаются молекулы воды и выделяется водород. Тут нам как раз пригодятся расплавы, которые не содержат воды.
В безводных расплавах реакции записываются еще проще: вещества распадаются на составные части:
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
🌟 Видео
Электролиз. 10 класс.Скачать

Электролиз раствора KIСкачать

ЭЛЕКТРОЛИЗ РАСТВОРА ЙОДИДА КАЛИЯСкачать

Электролиз раствора иодида калияСкачать

Электролиз йодида калияСкачать

Все об электролизе и задании 20 за 20 минут | Химия ЕГЭ 2023 | УмскулСкачать

ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Электролиз. Часть 1. Процесс электролиза, основные закономерности.Скачать

уравнения электролизаСкачать

Электролиз растворов. 2 часть. 10 класс.Скачать

Электролиз раствора нитрата калияСкачать

Задание ЕГЭ №20. Электролиз расплавов и растворов.Скачать

91. Электролиз. Задачи (часть 2)Скачать

электролиз хлорида натрияСкачать
7. ЭлектролизСкачать

Электролиз растворов. 1 часть. 10 класс.Скачать

Химия / 9 класс / ЭлектролизСкачать

Онлайн урок. 10-11 класс. Электролиз в заданиях ЕГЭ по химииСкачать








