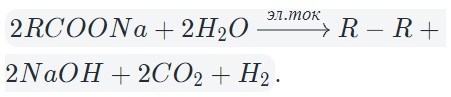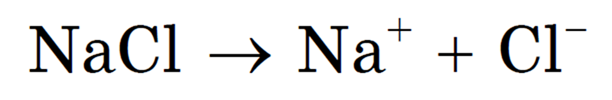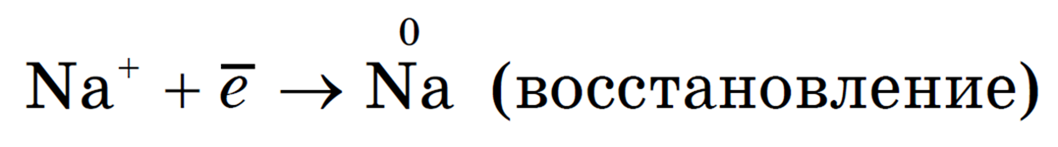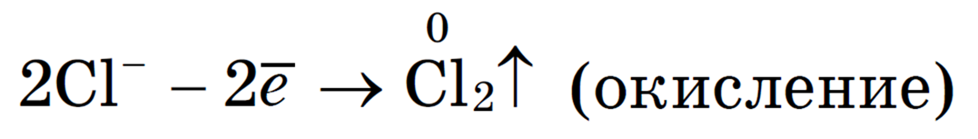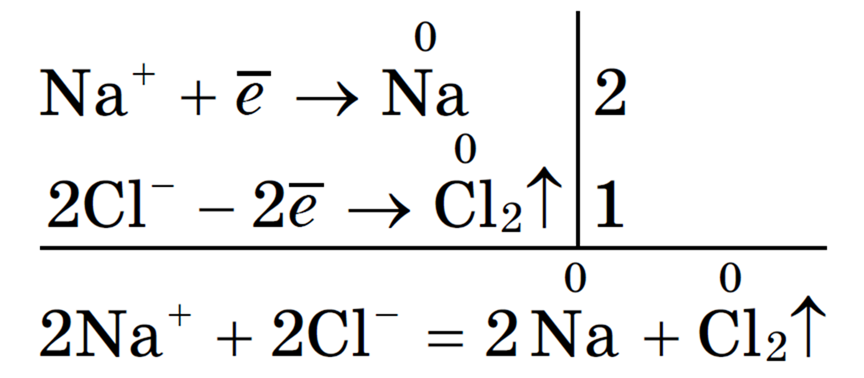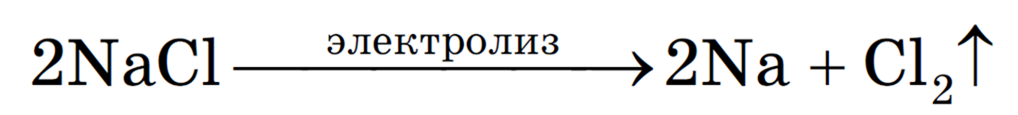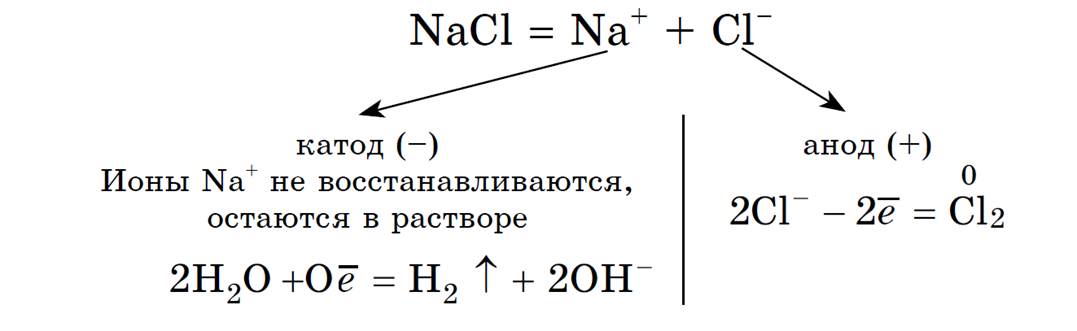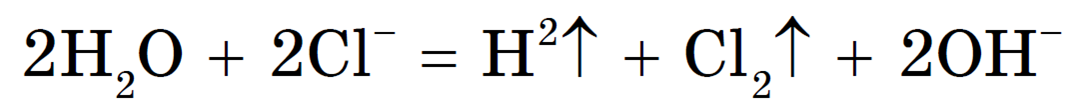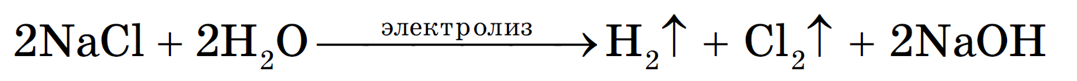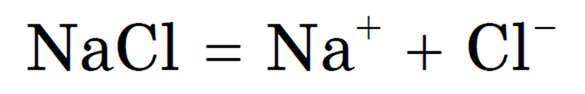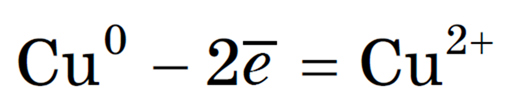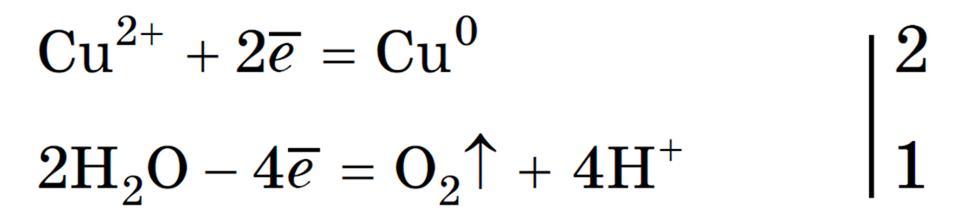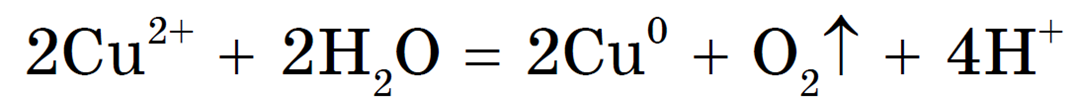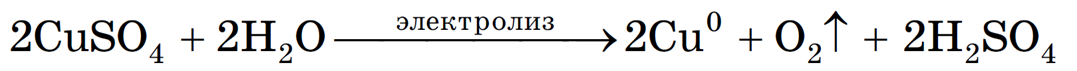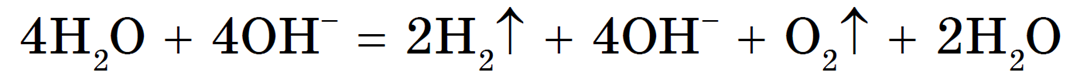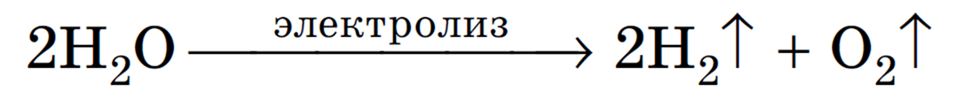О чем эта статья:
11 класс, ЕГЭ/ОГЭ
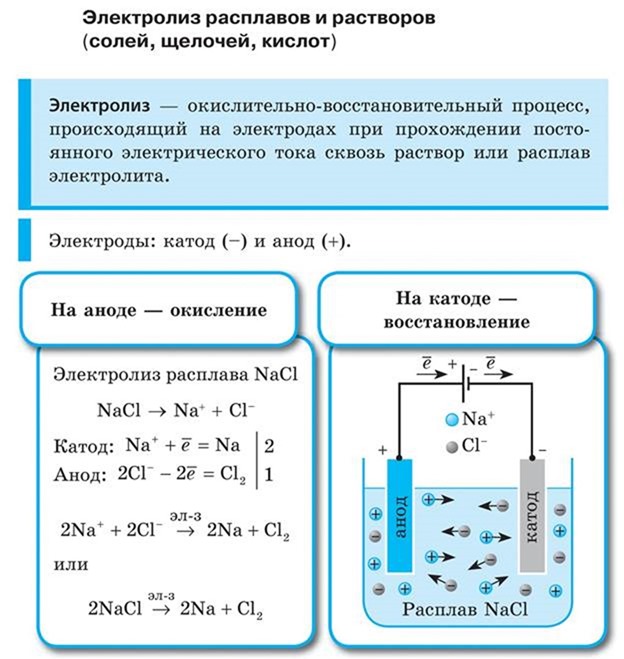
Электролиз — это окислительно-восстановительная реакция, которая протекает на электродах и основана на пропускании электрического тока через раствор или расплав.
Не менее важными участниками электролиза являются электроды: катод и анод. Если вы вдруг забыли, что такое катод и анод в химии, напомним.
Катод — это отрицательно заряженный электрод, который притягивает положительно заряженные ионы (катионы). А анод — это положительно заряженный электрод, который притягивает к себе отрицательно заряженные ионы (анионы). Таким образом, на катоде всегда происходит процесс восстановления, а на аноде всегда происходит процесс окисления.
Электроды бывают растворимые и инертные. Растворимые изготавливаются из металлов, например, меди и подвергаются химическим превращениям в ходе электролиза. А вот инертные или нерастворимые электроды не подвергаются химическим превращениям и остаются в неизменном виде как до реакции, так и после нее. Как правило, такие электроды изготавливают из графита или платины.
- Виды электролиза
- Электролиз расплава
- Электролиз раствора
- Применение электролиза
- Вопросы для самопроверки
- Тема №34 «Электролиз расплавов и растворов»
- Электролиз расплавов и растворов
- Оглавление
- Электролиз расплавленных солей
- Главное, что вы должны помнить: в процессе электролиза за счет электрической энергии осуществляется химическая реакция, которая самопроизвольно идти не может.Электролитические диссоциация и ассоциация
- 1. Процесс на катоде зависит не от материала катода, из которого он сделан, а от положения металла (катиона электролита) в электрохимическом ряду напряжений, при этом, если:
- 2. Процесс на аноде зависит от материала анода и от природы аниона:
- Попробуем применить эти правила в конкретных ситуациях.
- 1. Анод нерастворимый (например, графитовый).
- 2. Анод растворимый (например, медный):
- Рассмотрим электролиз раствора гидроксида калия на нерастворимом аноде:
- Шпаргалка
- Электролиз гидроксида калия в водном растворе уравнение
- 🎬 Видео
Видео:Электролиз раствора гидроксида натрияСкачать

Виды электролиза
Различают два вида электролиза:
Электролиз водного раствора.
Прежде чем мы рассмотрим каждый процесс отдельно, давай познакомимся с общими для двух видов процессами на электродах.
Процесс на катоде K (−)
Катион принимает электроны и восстанавливается:
Me +n + ne − → Me 0 (восстановление).
Процесс на аноде A (+)
Анион отдает электроны и окисляется:
неMe −n − ne − → неMe 0 (окисление).
Процессы, протекающие при электролизе в общем случае:
К − : Ме +n + ne − → Ме 0 ;
А + : неМе −n − ne − → неМе 0 .
Суммарное уравнение электролиза:
Видео:Все об электролизе и задании 20 за 20 минут | Химия ЕГЭ 2023 | УмскулСкачать

Электролиз расплава
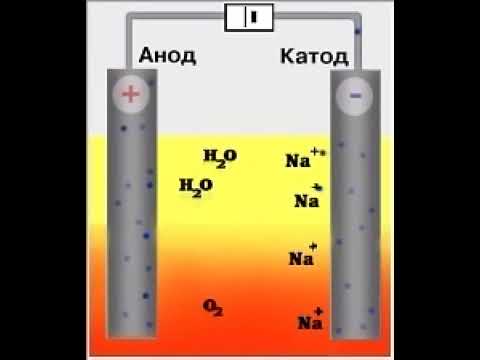
Рассмотрим электролиз расплава пищевой соли — хлорида натрия. При сильном нагревании кристаллический твердый хлорид натрия плавится. Полученный расплав содержит подвижные ионы хлора и натрия, освободившиеся из кристаллической решетки, и проводит электрический ток.
К − : 2Na + + 2e − = 2Na 0
А + : 2Cl − − 2e − = Cl2
Суммарное уравнение электролиза:
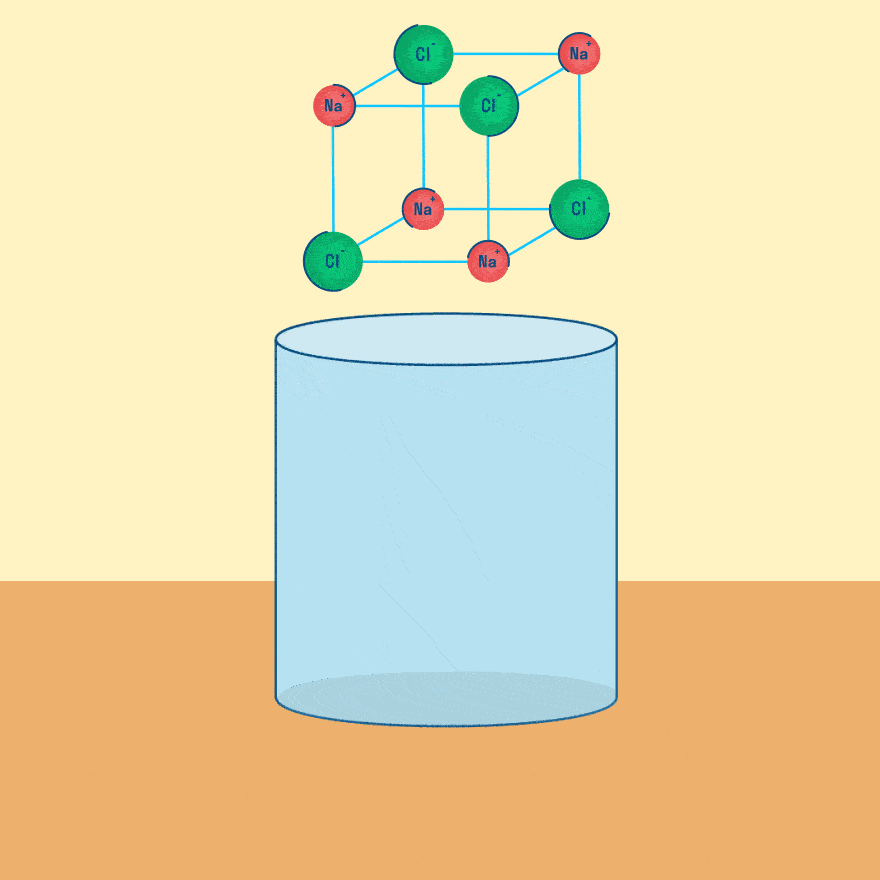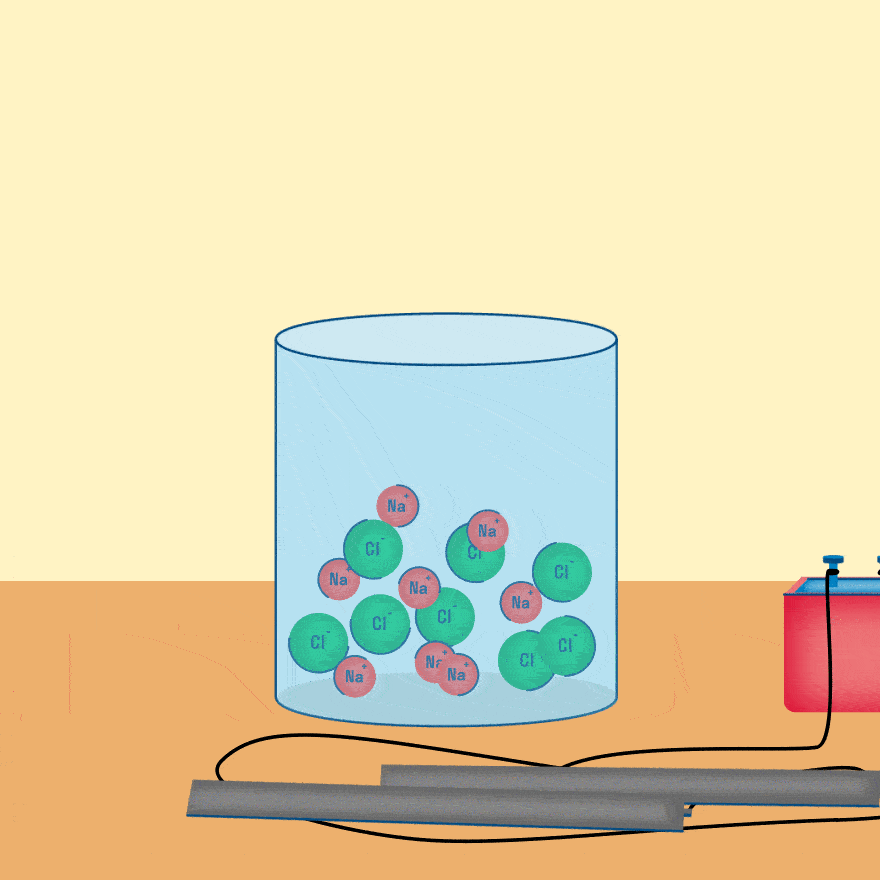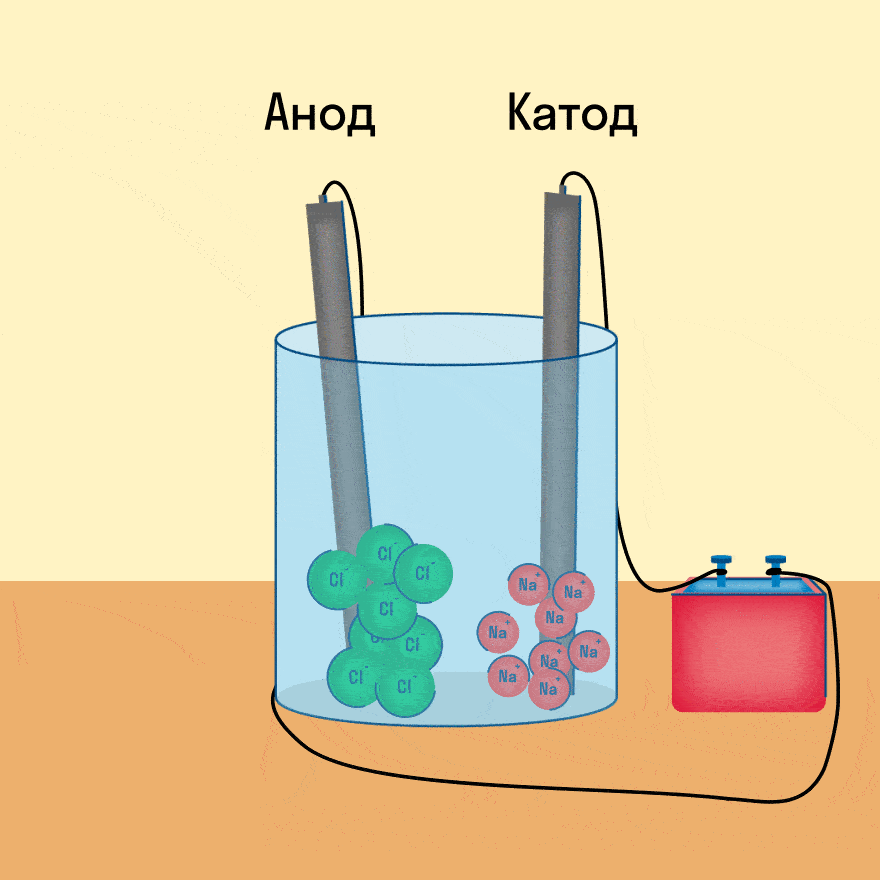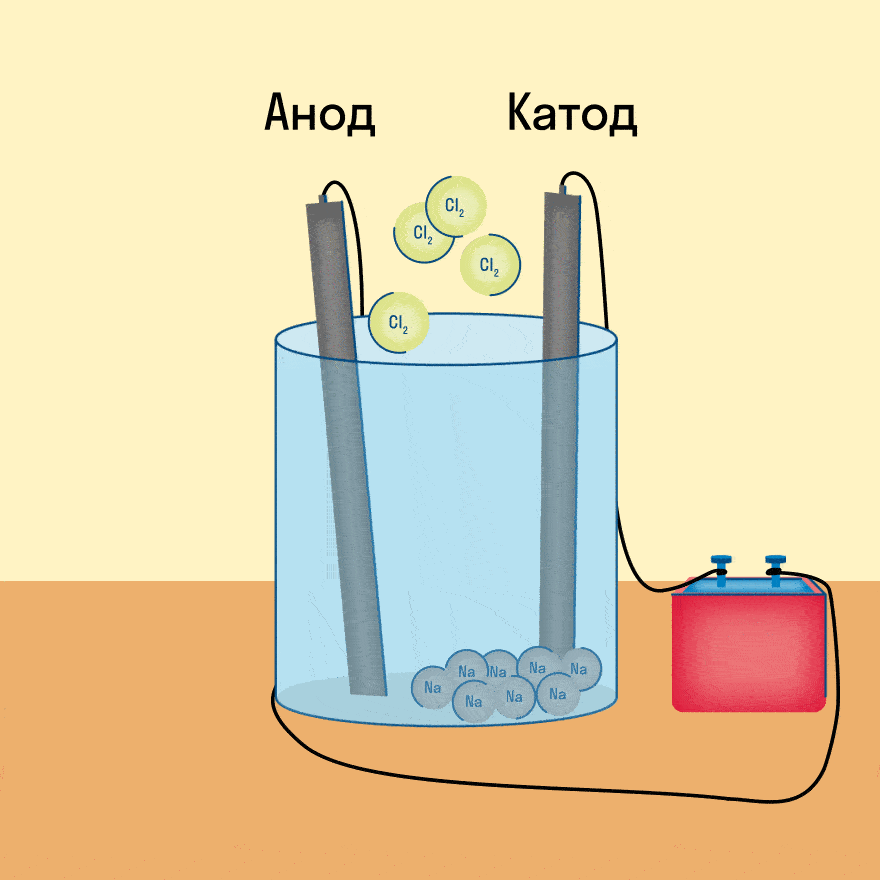
При опускании в расплав угольных (инертных) электродов, присоединенных к источнику тока, ионы приобретают направленное движение: катионы движутся к отрицательно заряженному электроду (катоду), анионы — к положительно заряженному электроду (аноду) и отдают электроны.
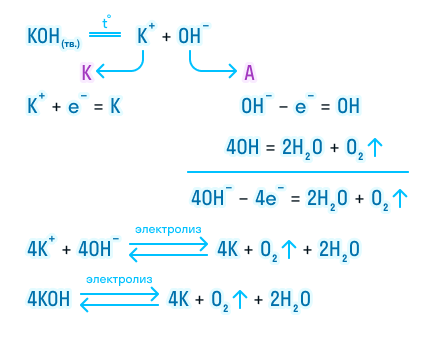
Теперь давайте рассмотрим электролиз расплава гидроксида калия.
На катоде происходит восстановление калия за счет принятия электронов. А на аноде протекает более сложная реакция. Гидроксогруппы отдают свой электрон и становятся нейтральными, но такое состояние для них крайне невыгодно, так как неустойчиво, и они объединяются в группы, чтобы потом разложиться с выделением газообразного кислорода и воды
Итог электролиза расплава — металлический калий на катоде, газообразный кислород и пары воды на аноде.
Видео:Электролиз. 10 класс.Скачать

Электролиз раствора
Основным отличием водного раствора от расплава является присутствие молекул воды и ионов H + и OH — как продуктов диссоциации воды. В связи с этим возле катода и анода скапливаются ионы, которые конкурируют как друг с другом, так и с молекулами воды. Рассмотрим электролиз на примере водного раствора KF:
К − : 4H2O + 4e − = 2H2 0 + 4OH −
Суммарное уравнение электролиза:
Как видно, ни калий, ни фтор не фигурируют в продуктах электролиза. Почему так происходит?
Наиболее активные металлы — сильные восстановители. Калий — как раз такой металл, поэтому обратный процесс восстановления активных металлов из соединений осуществить сложно. При электролизе водных растворов солей активных металлов на катоде протекает восстановление не катионов этих металлов, а воды с образованием водорода.
Разберем порядок восстановления катионов металлов на катоде в зависимости от их активности.
Последовательность разрядки катионов зависит от положения металла в электрохимическом ряду напряжения.
Если у катода накапливаются молекулы воды и катионы металла, который находится в ряду напряжения после водорода, то восстанавливаются ионы металла.
Если у катода накапливаются молекулы воды и катионы металла, который стоит в начале ряда напряжения от лития до алюминия включительно, то восстанавливаются ионы водорода из молекул воды. Катионы металла не восстанавливаются, остаются в растворе.
Если у катода накапливаются молекулы воды и катионы металла, который расположен в ряду напряжения между алюминием и водородом, то восстанавливаются и ионы металла, и частично ионы водорода из молекул воды.
Если в растворе находится смесь катионов разных металлов, то сначала восстанавливаются катионы менее активного металла.
При электролизе раствора кислоты на катоде восстанавливаются катионы водорода до газообразного водорода.
Для удобства мы собрали информацию об электролизе в таблице:
Теперь разберемся, что происходит с анионами в водных растворах при электролизе. Для начала познакомимся с последовательностью восстановления анионов на аноде:
Чем меньше выражена восстановительная активность, тем хуже анионы могут окисляться на аноде. К тому же процесс на аноде зависит от материала анода и от природы аниона.
Если анод инертный или нерастворимый, то на нем протекают следующие реакции:
При электролизе растворов солей бескислородных кислот (кроме фторидов!), на аноде происходит процесс окисления аниона.
При электролизе растворов солей кислородсодержащих кислот и фторидов на аноде выделяется газообразный кислород вследствие окисления молекул воды. Анион при этом не окисляется, оставаясь в растворе.
При электролизе растворов щелочей происходит окисление гидроксид-ионов.
Если анод растворимый, то на нем всегда происходит окисление металла анода — независимо от природы аниона.
Исключением является электролиз солей карбоновых кислот. Таблица выше не описывает происходящее на аноде. Давайте рассмотрим, что же там происходит.
В результате электролиза водных растворов солей щелочных металлов карбоновых кислот происходит образование углеводородов вследствие рекомбинации углеводородных радикалов.
В общем виде электролиз солей карбоновых кислот можно записать так:
На катоде образуется газообразный водород, а на аноде — углекислый газ, углеводород, полученный удвоением радикала. В катодном пространстве накапливается щелочь.
В случае разделения катодного и анодного пространства углекислый газ реагирует со щелочью с образованием гидрокарбоната.
Видео:Электролиз раствора хлорида калия / electrolysis of potassium chloride solutionСкачать

Применение электролиза
А теперь самое главное: зачем вообще нужен электролиз? Рассмотрим применение этого вида ОВР:
С помощью электролиза расплавов природных соединений в металлургической промышленности получают активные металлы (калий, натрий, бериллий, кальций, барий). С помощью электролиза растворов солей — цинк, кадмий, кобальт и другие.
В химической промышленности электролиз используют для получения фтора, хлора, водорода, кислорода, щелочей, бертолетовой соли и других веществ.
Электролиз с растворимым анодом используют для нанесения металлических покрытий (из хрома, золота, никеля, серебра), что предохраняет металлические изделия от коррозии и придает им декоративный вид.
Видео:Электролиз водного раствора хлорида натрияСкачать

Вопросы для самопроверки
1. Выберите верное продолжение фразы «катод — это. »:
Положительно заряженный электрод, к которому притягиваются положительно заряженные ионы.
Положительно заряженный электрод, к которому притягиваются отрицательно заряженные ионы.
Отрицательно заряженный электрод, к которому притягиваются положительно заряженные ионы.
Отрицательно заряженный электрод, к которому притягиваются отрицательно заряженные ионы.
2. Продолжите фразу «электролиз — это…»:
ОВР с применением тока.
Реакция без изменения степеней окисления с применением тока.
ОВР с применением катализаторов.
3. Как заряжен анион?
Не имеет заряда.
4. Чем отличается электролиз раствора от электролиза расплава?
В расплаве плавится твердое.
Присутствием молекул воды и продуктов ее диссоциации.
5. Если металл стоит в ряду активности металлов между алюминием и водородом, что выделится на катоде?
Металл и водород.
При электролиза водного раствора фторида лития что на аноде выделится?
Видео:Электролиз расплава гидроксида натрияСкачать
Тема №34 «Электролиз расплавов и растворов»
Электролиз — это окислительно-восстановительный процесс, протекающий на электродах при прохождении электрического тока через расплав или раствор электролита.
Видео:Электролиз растворов. 1 часть. 10 класс.Скачать

Электролиз расплавов и растворов
Видео:Получение гидроксида калия электролизомСкачать

Оглавление
Видео:Самый *ПРОСТОЙ* способ ПОЛУЧИТЬ ГИДРОКСИД КАЛИЯСкачать

Электролиз расплавленных солей
Электролиз — это окислительно-восстановительный процесс, протекающий на электродах при прохождении электрического тока через расплав или раствор электролита.
Рассмотрим процесс электролиза расплава хлорида натрия. В расплаве идет процесс термической диссоциации:
Под действием электрического тока катионы Na + движутся к катоду и принимают от него электроны:
Анионы Cl — движутся к аноду и отдают электроны:
Суммарное уравнение процессов:
На катоде образуется металлический натрий, на аноде — газообразный хлор.
Видео:Электролиз водного раствора хлорида натрия. Алгоритм записи уравнения.Скачать

Главное, что вы должны помнить: в процессе электролиза за счет электрической энергии осуществляется химическая реакция, которая самопроизвольно идти не может.
Электролитические диссоциация и ассоциация
Более сложный случай — электролиз растворов электролитов. В растворе соли кроме ионов металла и кислотного остатка присутствуют молекулы воды. Поэтому при рассмотрении процессов на электродах необходимо учитывать их участие в электролизе.
Для определения продуктов электролиза водных растворов электролитов существуют следующие правила.
1. Процесс на катоде зависит не от материала катода, из которого он сделан, а от положения металла (катиона электролита) в электрохимическом ряду напряжений, при этом, если:
1) катион электролита расположен в ряду напряжений в начале ряда по Al включительно, то на катоде идет процесс восстановления воды (выделяется водород H2↑). Катионы металла не восстанавливаются, они остаются в растворе;
2) катион электролита находится в ряду напряжений между алюминием и водородом, то на катоде восстанавливаются одновременно и ионы металла, и молекулы воды;
3) катион электролита находится в ряду напряжений после водорода, то на катоде восстанавливаются катионы металла;
4) в растворе содержатся катионы разных металлов, то сначала восстанавливается катион металла, стоящий в ряду напряжений правее.
2. Процесс на аноде зависит от материала анода и от природы аниона:
1) если анод растворяется (железо, цинк, медь, серебро и все металлы, которые окисляются в процессе электролиза), то окисляется металл анода, несмотря на природу аниона;
2) если анод не растворяется (его называют инертным — графит, золото, платина), то:
• при электролизе растворов солей бескислородных кислот (кроме фторидов) на аноде идет процесс окисления аниона;
• при электролизе растворов солей кислородсодержащих кислот и фторидов на аноде идет процесс окисления воды (выделяется 02↑). Анионы не окисляются, они остаются в растворе;
• анионы по их способности окисляться располагаются в следующем порядке:
Попробуем применить эти правила в конкретных ситуациях.
Рассмотрим электролиз раствора хлорида натрия в случае, если анод нерастворимый и если анод растворимый.
1. Анод нерастворимый (например, графитовый).
В растворе идет процесс электролитической диссоциации:
Учитывая присутствие ионов Na + в растворе, составляем молекулярное уравнение:
(гидроксид натрия образуется в катодном пространстве)
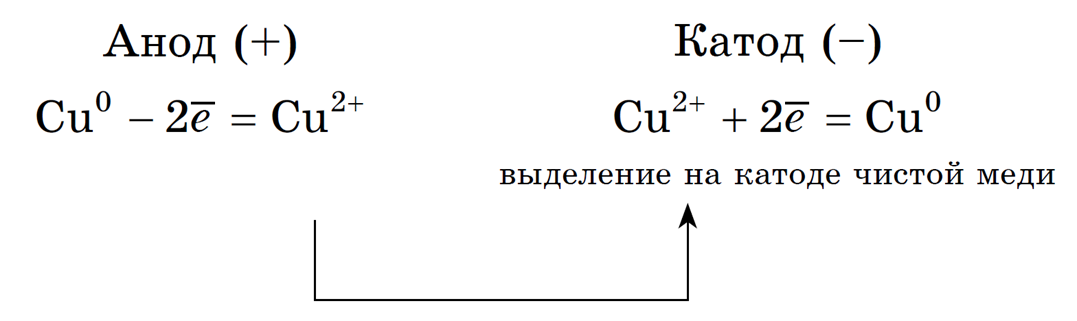
2. Анод растворимый (например, медный):
Если анод растворимый, то металл анода будет окисляться:
Катионы Cu 2+ в ряду напряжений стоят после (Н + ), поэтому они и будут восстанавливаться на катоде.
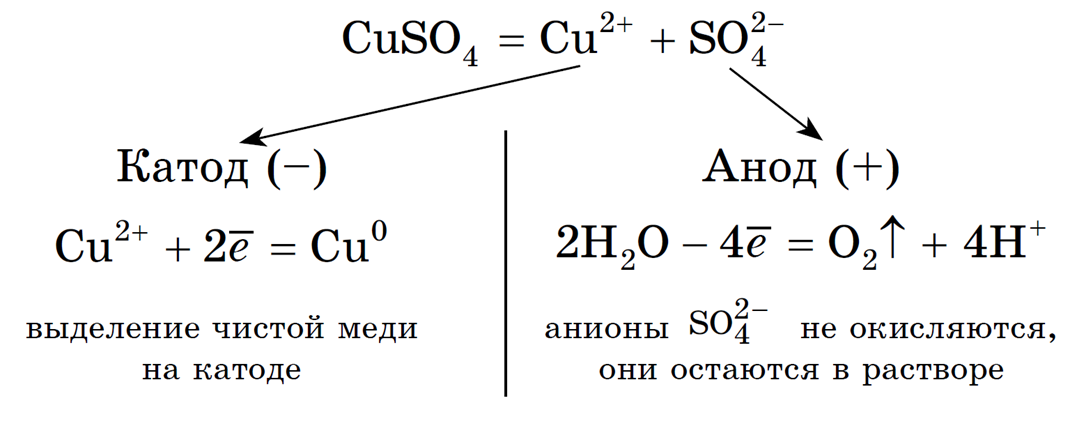
Концентрация NaCl в растворе не меняется. Рассмотрим электролиз раствора сульфата меди (II) на нерастворимом аноде:
Суммарное ионное уравнение:
Суммарное молекулярное уравнение с учетом присутствия анионов SO4 2- в растворе:
(серная кислота образуется в анодном пространстве)
Рассмотрим электролиз раствора гидроксида калия на нерастворимом аноде:
Суммарное ионное уравнение:
Суммарное молекулярное уравнение:
В данном случае, оказывается, идет только электролиз воды. Аналогичный результат получим и в случае электролиза растворов H2SO4, NaNO3, K2SO4 и др.
Электролиз расплавов и растворов веществ широко используется в промышленности.
Видео:Часть 3-2. Электролиз водных растворов. Примеры решений уравнений (подробно).Скачать

Шпаргалка
Справочный материал для прохождения тестирования:
Видео:электролиз хлорида натрияСкачать
Электролиз гидроксида калия в водном растворе уравнение
Одним из способов получения металлов является электролиз. Активные металлы встречаются в природе только в виде химических соединений. Как выделить из этих соединений в свободном состоянии?
Растворы и расплавы электролитов проводят электрический ток. Однако при пропускании тока через раствор электролита могут происходить химические реакции. Рассмотрим, что будет происходить, если в раствор или расплав электролита поместить две металлические пластинки, каждая из которых соединена с одним из полюсов источника тока. Эти пластинки называются электродами. Электрический ток представляет собой движущийся поток электронов. В результате того, что электроны в цепи движутся от одного электрода к другому, на одном из электродов возникает избыток электронов. Электроны имеют отрицательный заряд, поэтому этот электрод заряжается отрицательно. Его называют катодом. На другом электроде создается недостаток электронов, и он заряжается положительно. Этот электрод называют анодом. Электролит в растворе или расплаве диссоциирует на положительно заряженные ионы — катионы и отрицательно заряженные ионы — анионы. Катионы притягиваются к отрицательно заряженному электроду — катоду. Анионы притягиваются к положительно заряженному электроду — аноду. На поверхности электродов может происходить взаимодействие между ионами и электронами.
Электролизом называются процессы, происходящие при пропускании через растворы или расплавы электролитов электрического тока.
Процессы, происходящие при электролизе растворов и расплавов электролитов, достаточно сильно отличаются. Рассмотрим подробно оба этих случая.
В качестве примера рассмотрим электролиз расплава хлорида натрия. В расплаве хлорид натрия диссоциирует на ионы Na +
и Cl — : NaCl = Na + + Cl —
Катионы натрия перемещаются к поверхности отрицательно заряженного электрода — катода. На поверхности катода имеется избыток электронов. Поэтому происходит передача электронов от поверхности электрода к ионам натрия. При этом ионы Na + превращаются в атомы натрия, то есть происходит восстановление катионов Na + . Уравнение процесса:
Хлорид-ионы Cl — перемещаются к поверхности положительно заряженного электрода — анода. На поверхности анода создан недостаток электронов и происходит передача электронов от анионов Cl — к поверхности электрода. При этом отрицательно заряженные ионы Cl — превращаются в атомы хлора, которые сразу же соединяются в молекулы хлора С l 2 :
2С l — -2е — = Cl 2
Хлорид-ионы теряют электроны, то есть происходит их окисление.
Запишем вместе уравнения процессов, происходящих на катоде и аноде
2 С l — -2 е — = Cl2
В процессе восстановления катионов натрия участвует один электрон, а в процессе окисления ионов хлора — 2 электрона. Однако должен соблюдаться закон сохранения электрического заряда, то есть общий заряд всех частиц в растворе должен быть постоянным Следовательно, число электронов, участвующих в восстановлении катионов натрия, должно быть равно числу электронов, участвующих в окислении хлорид-ионов Поэтому первое уравнение умножим на 2:
2С l — -2е — = Cl 2 1
Сложим вместе оба уравнения и получим общее уравнение реакции.
2 Na + + 2С l — = 2 Na + Cl 2 (ионное уравнение реакции), или
2 NaCl = 2 Na + Cl 2 (молекулярное уравнение реакции)
Итак, на рассмотренном примере мы видим, что электролиз является окислительно-восстановительной реакцией. На катоде происходит восстановление положительно заряженных ионов — катионов, на аноде окисление отрицательно заряженных ионов – анионов. Запомнить, какой процесс где происходит, можно с помощью «правила Т»:
каТод — каТион – воссТановление.
Пример 2. Электролиз расплава гидроксида натрия.
Гидроксида натрия в растворе диссоциирует на катионы и гидроксид-ионы .
Катод (-) Na + + OH — à Анод (+)
На поверхности катода происходит восстановление катионов натрия, при этом образуются атомы натрия:
катод (-) Na + +e à Na
На поверхности анода окисляются гидрокисд-ионы, при этом выделяется кислород и образуются молекулы воды:
анод (+) 4 OH — – 4 e à 2 H 2 O + O 2
Запишем вместе уравнения процессов, происходящих на катоде и аноде:
катод (-) Na + + e à Na
анод (+) 4 OH — – 4 e à 2 H 2 O + O 2
Число электронов, участвующих в реакции восстановления катионов натрия и в реакции окисления гидроксид-ионов, должно быть одинаковым. Поэтому умножим первое уравнение на 4:
катод (-) Na + + e à Na 4
анод (+) 4 OH — – 4 e à 2 H 2 O + O 2 1
Сложим вместе оба уравнения и получим уравнение реакции электролиза:
4 NaOH à 4 Na + 2 H 2 O + O 2
Пример 3. Рассмотрим электролиз расплава Al 2 O 3
При помощи этой реакции получают алюминий из боксита – природного соединения, в котором содержится много оксида алюминия. Температура плавления оксида алюминия очень высокая (более 2000º С), поэтому к нему добавляют специальные добавки, понижающие температуру плавления до 800-900º С. В расплаве оксид алюминия диссоциирует на ионы Al 3+ и O 2- . H а катоде восстанавливаются катионы Al 3+ , превращаясь в атомы алюминия:
На аноде окисляются анионы O 2- , превращаясь в атомы кислорода. Атомы кислорода сразу же соединяются в молекулы О2:
2 O 2- – 4 e à O 2
Число электронов, участвующих в процессах восстановления катионов алюминия и окисления ионов кислорода, должно быть равно, поэтому умножим первое уравнение на 4, а второе на 3:
Al 3+ +3 e à Al 0 4
2 O 2- – 4 e à O 2 3
Сложим оба уравнения и получим общее уравнение электролиза:
4 Al 3+ + 6 O 2- à 4 Al 0 +3 O 2 0 (ионное уравнение реакции)
В случае пропускания электрического тока через водный раствор электролита дело осложняется тем, что в растворе присутствуют молекулы воды, которые также могут взаимодействовать с электронами. Вспомним, что в молекуле воды атомы водорода и кислорода связаны полярной ковалентной связью. Электроотрицательность кислорода больше, чем электроотрицательность водорода, поэтому общие электронные пары смещены к атому кислорода. На атоме кислорода возникает частичный отрицательный заряд, его обозначают δ-, а на атомах водорода -частичный положительный заряд, его обозначают δ+.
Благодаря такому смещению зарядов молекула воды имеет положительный и отрицательный «полюса». Поэтому молекулы воды могут положительно заряженным полюсом притягиваться к отрицательно заряженному электроду — катоду, а отрицательным полюсом — к положительно заряженному электроду — аноду. На катоде может происходить восстановление молекул воды, при этом выделяется водород:
На аноде может происходить окисление молекул воды с выделением кислорода:
Поэтому на катоде могут восстанавливаться либо катионы электролита, либо молекулы воды. Эти два процесса как бы конкурируют между собой. Какой процесс в действительности происходит на катоде, зависит от природы металла. Будут ли на катоде восстанавливаться катионы металла или молекулы воды, зависит от положения металла в ряду напряжений металлов.
Li K Na Ca Mg Al ¦¦ Zn Fe Ni Sn Pb (H2) ¦¦ Cu Hg Ag Au
Если металл находится в ряду напряжений правее водорода, на катоде восстанавливаются катионы металла и выделяется свободный металл. Если металл находится в ряду напряжений левее алюминия, на катоде восстанавливаются молекулы воды и выделяется водород. Наконец, в случае катионов металлов от цинка до свинца может происходить либо выделение металла, либо выделение водорода, а иногда одновременно выделяются и водород, и металл. Вообще это довольно сложный случай, многое зависит от условий реакции: концентрации раствора, сипы электрического тока и других.
На аноде также может происходить один из двух процессов — либо окисление анионов электролита, либо окисление молекул воды. Какой именно процесс будет протекать на самом деле, зависит от природы аниона. При электролизе солей бескислородных кислот или самих кислот на аноде окисляются анионы. Единственным исключением является фторид-ион F — . В случае кислородсодержащих кислот на аноде окисляются молекулы воды и выделяется кислород.
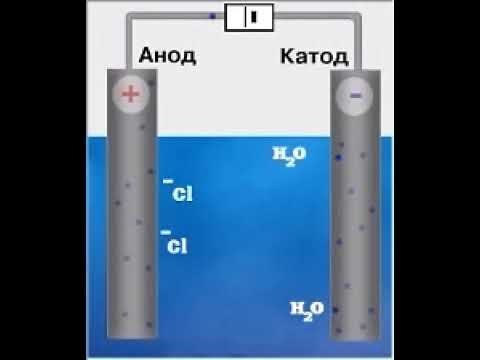
Пример 1. Давайте рассмотрим электролиз водного раствора хлорида натрия.
В водного растворе хлорида натрия будут находиться катионы натрия Na + , анионы хлора Cl — и молекулы воды.
2 NaCl à 2 Na + + 2 Cl —
2Н2О à 2 H + + 2 OH —
катод (-) 2 Na + ; 2 H + ; 2Н + + 2е à Н 0 2
анод (+) 2 Cl — ; 2 OH — ; 2 Cl — – 2е à 2 Cl 0
Химическая активность анионов в ряду уменьшается.
Пример 2. А если в состав соли входит SO 4 2- ? Рассмотрим электролиз раствора сульфата никеля ( II ). Сульфата никеля ( II ) диссоциирует на ионы Ni 2+ и SO 4 2- :
Катионы никеля находятся между ионами металлов Al 3+ и Pb 2+ , занимающих в ряду напряжения среднее положение, процесс восстановления на катоде происходит по обеим схемам:
катод (-) Ni 2+ ; H + ; Ni 2+ + 2е à Ni 0
Анионы кислородсодержащих кислот не окисляются на аноде ( ряд активности анионов), происходит окисление молекул воды:
анод (+) SO4 2- ; OH — ; 2H2O – 4 е à O2 + 4H +
Запишем вместе уравнения процессов, происходящих на катоде и аноде:
катод (-) Ni 2+ ; H + ; Ni 2+ + 2е à Ni 0
анод (+) SO4 2- ; OH — ; 2H2O – 4 е à O2 + 4H +
В процессах восстановления участвуют 4 электрона и в процессе окисления тоже участвуют 4 электрона. Сложим вместе эти уравнения и получим общее уравнение реакции:
Ni 2+ +2 H 2 О + 2 H 2 О à Ni 0 + H 2 + 2ОН — + O 2 + 4 H +
В правой части уравнения находятся одновременно ионы Н + и OH — , которые соединяются с образованием молекул воды:
Н + + OH — à H 2 О
Поэтому в правой части уравнения вместо 4 ионов Н + и 2 ионов OH — запишем 2 молекулы воды и 2 иона Н + :
Ni 2+ +2 H 2 О + 2 H 2 О à Ni 0 + H 2 +2 H 2 О + O 2 + 2 H +
Сократим по две молекулы воды в обеих частях уравнения:
Ni 2+ +2 H 2 О à Ni 0 + H 2 + O 2 + 2 H +
Это краткое ионное уравнение. Чтобы получить полное ионное уравнение, нужно добавить в обе части по сульфат-иону SO 4 2- , образовавшиеся при диссоциации сульфата никеля ( II ) и не участвовавшие в реакции:
Таким образом, у нас при электролизе раствора сульфата никеля ( II ) на катоде выделяется водород и никель, а на аноде – кислород.
Пример 3. Написать уравнения процессов, происходящих при электролизе водного раствора сульфата натрия с инертным анодом.
Стандартный электродный потенциал системы Na + + e = Na 0 значительно отрицательнее потенциала водного электрода в нейтральной водной среде (-0,41 В).Поэтому на катоде будет происходить электрохимическое восстановление воды, сопровождающееся выделением водорода
2Н2О à 2 H + + 2 OH —
а ионы Na + , приходящие к катоду, будут накапливаться в прилегающей к нему части раствора (катодное пространство).
На аноде будет происходить электрохимическое окисление воды, приводящее к выделению кислорода
2 H 2 O – 4е à O 2 + 4 H +
поскольку отвечающий этой системе стандартный электродный потенциал (1,23 В) значительно ниже, чем стандартный электродный потенциал (2,01 В), характеризующий систему
Ионы SO 4 2- , движущиеся при электролизе к аноду, будут накапливаться в анодном пространстве.
Умножая уравнение катодного процесса на два, и складывая его с уравнением анодного процесса, получаем суммарное уравнение процесса электролиза:
6 H 2 O = 2 H 2 + 4 OH — + O 2 + 4 H +
Приняв во внимание, что одновременно происходит накопление ионов в катодном пространстве и ионов в анодном пространстве, суммарное уравнение процесса можно записать в следующей форме:
Таким образом, одновременно с выделением водорода и кислорода образуется гидроксид натрия (в катодном пространстве) и серная кислота (в анодном пространстве).
Пример 4. Электролиз раствора сульфата меди ( II ) CuSO 4 .
Катод (-) 2+ + SO4 2- à анод (+)
катод (-) Cu 2+ + 2e à Cu 0 2
анод (+) 2H2O – 4 е à O2 + 4H + 1
В растворе остаются ионы Н + и SO 4 2- , т. к. накапливается серная кислота.
Пример 5. Электролиз раствора хлорида меди ( II ) CuCl 2 .
Катод (-) 2+ + 2Cl — à анод (+)
катод (-) Cu 2+ + 2e à Cu 0
анод (+) 2Cl — – 2e à Cl 0 2
В обоих уравнениях участвуют по два электрона.
Cu 2+ + 2e à Cu 0 1
2Cl — -– 2e à Cl2 1
Cu 2+ + 2 Cl — à Cu 0 + Cl 2 (ионное уравнение)
CuCl 2 à Cu + Cl 2 (молекулярное уравнение)
Пример 6. Электролиз раствора нитрата серебра AgNO 3 .
Катод (-) + + NO3 — à Анод (+)
катод (-) Ag + + e à Ag 0
Ag + + e à Ag 0 4
4 Ag + + 2 H 2 O à 4 Ag 0 + 4 H + + O 2 (ионное уравнение)
4 Ag + + 2 H 2 O à 4 Ag 0 + 4 H + + O 2 + 4 NO 3 — (полное ионное уравнение)
4 AgNO 3 + 2 H 2 O à 4 Ag 0 + 4 HNO 3 + O 2 (молекулярное уравнение)
Пример 7. Электролиз раствора соляной кислоты HCl .
Катод (-) H + + Cl — à анод (+)
катод (-) 2 H + + 2 e à H 2
анод (+) 2 Cl — – 2 e à Cl 2
2 H + + 2 Cl — à H 2 + Cl 2 (ионное уравнение)
2 HCl à H 2 + Cl 2 (молекулярное уравнение)
Пример 8. Электролиз раствора серной кислоты H 2 SO 4 .
Катод (-) + + SO4 2- à анод (+)
катод (-) 2H+ + 2e à H2
Пример 9. Электролиз раствора гидроксида калия KOH .
Катод (-) K + + OH — à анод (+)
Катионы калия не будут восстанавливаться на катоде, так как калий находится в ряду напряжения металлов левее алюминия, вместо этого будет происходить восстановление молекул воды:
катод (-) 2H2O + 2e à H2 +2OH — 2
анод (+) 4OH — — 4e à 2H2O +O2 1
Пример 10. Электролиз раствора нитрата калия KNO 3 .
катод (-) 2H2O + 2e à H2 + 2OH- 2
анод (+) 2H2O – 4 е à O2 + 4H+ 1
При пропускании электрического тока через растворы кислородосодержащих кислот, щелочей и солей кислородсодержащих кислот с металлами, находящимися в ряду напряжения металлов, левее алюминия, практически происходит электролиз воды. При этом на катоде выделяется водород, а на аноде кислород.
Выводы. При определении продуктов электролиза водных растворов электролитов можно в простейших случаях руководствоваться следующими соображениями:
1. Ионы металлов с малой алгебраической величиной стандартного потенциала – от Li + до Al 3+ включительно – обладают весьма слабой тенденцией к обратному присоединению электронов, уступая в этом отношении ионам H + (см. Ряд активности катионов). При электролизе водных растворов соединений, содержащих эти катионы, функцию окислителя на катоде выполняют ионы H + , восстанавливаясь при этом по схеме:
2 H 2 O + 2 е à H 2 + 2OH —
2. Катионы металлов с положительными значениями стандартных потенциалов ( Cu 2+ , Ag + , Hg 2+ и др.) обладают большой тенденцией к присоединению электронов по сравнению с ионами. При электролизе водных растворов их солей функцию окислителя на катоде выделяют эти катионы, восстанавливаясь при этом до металла по схеме, например:
Cu 2+ +2 e à Cu 0
3. При электролизе водных растворов солей металлов Zn , Fe , Cd , Ni и др., занимающих в ряду напряжения среднее положение между перечисленными группами, процесс восстановления на катоде происходит по обеим схемам. Масса, выделившегося металла не соответствует в этих случаях количеству протекшего электрического тока, часть которого расходуется на образование водорода.
4. В водных растворах электролитов функцию восстановителей по отношению к аноду-окислитею могут одноатомные анионы ( Cl — , Br — , J — ), кислородосодержащие анионы ( NO 3 — , SO 4 2- , PO 4 3- и другие), а также гидроксильные ионы воды. Более сильными восстановительными свойствами из них обладают галогенид ионы, за исключением F . Ионы OH занимают промежуточное положение между ними и многоатомными анионами. Поэтому при электролизе водных растворов HCl , HBr , HJ или их солеей на аноде происходит окисление галогенид-ионов по схеме:
2 X — -2 e à X 2 0
При электролизе водных растворов сульфатов, нитратов, фосфатов и т.п. функцию восстановителя выполняют ионы , окисляясь при этом по схеме:
4 HOH – 4 e à 2 H 2 O + O 2 + 4 H +
З а дача 1. При электролизе раствора сульфата меди на катоде выделилось 48 г меди. Найдите объем газа, выделившегося на аноде, и массу серной кислоты, образовавшейся в растворе.
Сульфат меди в растворе диссоциирует ни ионы Си 2+ и S 04 2 ‘.
Запишем уравнения процессов, происходящих на катоде и аноде. На катоде восстанавливаются катионы Си , на аноде происходит электролиз воды:
2H20-4e- = 4H + + 02 
Общее уравнение электролиза:
2Cu2+ + 2H2O = 2Cu + 4H+ + O2 (краткоеионное уравнение)
Добавим в обе части уравнения по 2 сульфат-иона, которые образуются при диссоциации сульфата меди, получим полное ионное уравнение:
2Си2+ + 2S042″ + 2Н20 = 2Cu + 4Н+ + 2SO4 2′ + О2
Перепишем уравнение в молекулярном виде:
2CuSO4 + 2H2O = 2Cu + 2H2SO4 + О2
Газ, выделяющийся на аноде — кислород. В растворе образуется серная кислота.
Молярная масса меди равна 64 г/моль, вычислим количество вещества меди:
По уравнению реакции при выделении на катоде 2 моль меди ла аноде выделяется 1 моль кислорода. На катоде выделилось 0,75 моль меди, пусть на аноде выделилось х моль кислорода. Составим пропорцию:
На аноде выделилось 0,375 моль кислорода,
Вычислим объем выделившегося кислорода:
V(O2) = v(O2)«VM = 0,375 моль«22,4 л/моль = 8,4 л
По уравнению реакции при выделении на катоде 2 моль меди в растворе образуется 2 моль серной кислоты, значит, если на катоде выделилось 0,75 моль меди, то в растворе образовалось 0,75 моль серной кислоты, v(H2SO4) = 0,75 моль. Вычислим молярную массу серной кислоты:
M(H2SO4) = 2-1+32+16-4 = 98 г/моль.
Вычислим массу серной кислоты:
m(H2S04) = v(H2S04>M(H2S04) = = 0,75 моль«98 г/моль = 73,5 г.
Ответ: на аноде выделилось 8,4 л кислорода; в растворе образовалось 73,5 г серной кислоты
Задача 2. Найдите объем газов, выделившихся на катоде и аноде, при электролизе водного раствора, содержащего 111,75 г хлорида калия. Какое вещество образовалось в растворе? Найдите его массу.
Хлорид калия в растворе диссоциирует на ионы К+ и Сl:
Ионы калия не восстанавливаются на катоде, вместо этого происходит восстановление молекул воды. На аноде окисляются хлорид-ионы и выделяется хлор:
2Н2О + 2е’ = Н2 + 20Н- |1
Общее уравнение электролиза:
2СГl+ 2Н2О = Н2 + 2ОН» + С12 (краткое ионное уравнение) В растворе присутствуют также ионы К+, образовавшиеся при диссоциации хлорида калия и не участвующие в реакции:
2К+ + 2Сl + 2Н20 = Н2 + 2К+ + 2ОН’ + С12
Перепишем уравнение в молекулярном виде:
2КС1 + 2Н2О = Н2 + С12 + 2КОН
На катоде выделяется водород, на аноде хлор, в растворе образуется гидроксид калия.
В растворе содержалось 111,75 г хлорида калия.
Вычислим молярную массу хлорида калия:
М(КС1) = 39+35,5 = 74,5 г/моль
Вычислим количество вещества хлорида калия:

По уравнению реакции при электролизе 2 моль хлорида калия выделяется 1 моль хлора. Пусть при электролизе 1,5 моль хлорида калия выделяется х моль хлора. Составим пропорцию:


Выделится 0,75 моль хлора, v(C!2) = 0,75 моль. По уравнению реакции при выделении 1 моль хлора на аноде на катоде выделяется 1 моль водорода. Следовательно, если на аноде выделится 0,75 моль хлора, то на катоде выделится 0,75 моль водорода, v(H2) = 0,75 моль.
Вычислим объем хлора, выделившегося на аноде:
V(C12) = v(Cl2)-VM = 0,75 моль«22,4 л/моль = 16,8 л.
Объем водорода равен объему хлора:
По уравнению реакции при электролизе 2 моль хлорида калия образуется 2 моль гидроксида калия, значит, при электролизе 0,75 моль хлорида калия образуется 0,75 моль гидроксида калия. Вычислим молярную массу гидроксида калия:
М(КОН) = 39+16+1 — 56 г/моль.
Вычислим массу гидроксида калия:
m(KOH) = v(KOH>M(KOH) = 0,75 моль-56 г/моль = 42 г.
Ответ: на катоде выделилось 16,8 л водорода, на аноде выделилось 16,8 л хлора, в растворе образовалось 42 г гидроксида калия.
Задача 3. При электролизе раствора 19 г хлорида двухвалентного металла на аноде выделилось 8,96 л хлора. Определите, хлорид какого металла подвергли электролизу. Вычислите объем водорода, выделившегося на катоде.
Обозначим неизвестный металл М, формула его хлорида МС12. На аноде окисляются хлорид-ионы и выделяется хлор. В условии сказано, что на катоде выделяется водород, следовательно, происходит восстановление молекул воды:
2Н20 + 2е- = Н2 + 2ОH |1
Общее уравнение электролиза:
2Сl + 2Н2О = Н2 + 2ОН» + С12 (краткое ионное уравнение)
В растворе присутствуют также ионы М2+, которые при реакции не изменяются. Запишем полное ионное уравнение реакции:
2СГ + М2+ + 2Н2О = Н2 + М2+ + 2ОН- + С12
Перепишем уравнение реакции в молекулярном виде:
МС12 + 2Н2О — Н2 + М(ОН)2 + С12
Найдем количество вещества выделившегося на аноде хлора:
По уравнению реакции при электролизе 1 моль хлорида неизвестного металла выделяется 1 моль хлора. Если выделилось 0,4 моль хлора, то электролизу подвергли 0,4 моль хлорида металла. Вычислим молярную массу хлорида металла:
Молярная масса хлорида неизвестного металла 95 г/моль. На два атома хлора приходится 35,5»2 = 71 г/моль. Следовательно, молярная масса металла равна 95-71 = 24 г/моль. Этой молярной массе соответствует магний.
По уравнению реакции на 1 моль выделившегося на аноде хлора приходится 1 моль выделившегося на катоде водорода. В нашем случае на аноде выделилось 0,4 моль хлора, значит, на катоде выделилось 0,4 моль водорода. Вычислим объем водорода:
V(H2) = v(H2>VM = 0,4 моль«22,4 л/моль = 8,96 л.
Ответ: электролизу подвергли раствор хлорида магния; на катоде выделилось 8,96 л водорода.
*3адача 4. При электролизе 200 г раствора сульфата калия с концентрацией 15% на аноде выделилось 14,56 л кислорода. Вычислите концентрацию раствора по окончании электролиза.
В растворе сульфата калия и на катоде, и на аноде реагируют молекулы воды:
2Н20 + 2е’ = Н2 + 20Н- |2
2Н2О — 4е’ = 4Н+ + О2 ! 1
Сложим вместе оба уравнения:
6Н2О = 2Н2 + 4ОН» + 4Н+ + О2, или
6Н2О = 2Н2 + 4Н2О + О2, или
Фактически при электролизе раствора сульфата калия происходит электролиз воды.
Концентрация растворенного вещества в растворе определяется по формуле:
С=m(растворенного вещества) 
Чтобы найти концентрацию раствора сульфата калия по окончании электролиза, необходимо знать массу сульфата калия и массу раствора. Масса сульфата калия при реакции не изменяется. Вычислим массу сульфата калия в исходном растворе. Обозначим концентрацию исходного раствора Сь
m(K2S04) = C2 (K2S04 ) 

Масса раствора во время электролиза изменяется, так как часть воды превращается в водород и кислород. Вычислим количество вещества выделившегося кислорода:

По уравнению реакции из 2 моль воды образуется 1 моль кислорода. Пусть 0,65 моль кислорода выделяется при разложении х моль воды. Составим пропорцию:
Разложилось 1,3 моль воды, v(H2O) = 1,3 моль.
Вычислим молярную массу воды:
М(Н2О) =1-2+16=18 г/моль.
Вычислим массу разложившейся воды:
m(H2O) = v(H2O>M(H2O) = 1,3 моль* 18 г/моль = 23,4 г.
Масса раствора сульфата калия уменьшилась на 23,4 г и стала равна 200-23,4 = 176,6 г. Вычислим теперь концентрацию раствора сульфата калия по окончании электролиза:
С2 (K2 SO4 )=m(K2 SO4 ) 

Ответ: концентрация раствора по окончании электролиза равна 17%.
*3адача 5. 188,3 г смеси хлоридов натрия и калия растворили в воде и пропустили через полученный раствор электрический ток. При электролизе на катоде выделилось 33,6 л водорода. Вычислите состав смеси в процентах по массе.
После растворения смеси хлоридов калия и натрия в воде в растворе содержатся ионы К+, Na+ и Сl-. Ни ионы калия, ни ионы натрия не восстанавливаются на катоде, восстанавливаются молекулы воды. На аноде окисляются хлорид-ионы и выделяется хлор:
2Н2О + 2е’ = Н2 + 2ОН» ] 1
Общее уравнение электролиза:
2СГ + 2Н2О = Н2 + 2ОН» + С12 (краткое ионное уравнение)
Полные ионные уравнения реакций электролиза хлорида натрия и хлорида калия.
2К+ + 2Cl 

2Na+ + 2С1 

Перепишем уравнения в молекулярном виде:
2КС1 + 2Н20 = Н2 + С12 + 2КОН
2NaCl + 2Н2О = Н2 + С12 + 2NaOH
Обозначим количество вещества хлорида калия, содержащегося в смеси, х моль, а количество вещества хлорида натрия у моль. По уравнению реакции при электролизе 2 моль хлорида натрия или калия выделяется 1 моль водорода. Поэтому при электролизе х моль хлорида калия образуется х/2 или 0,5х моль водорода, а при электролизе у моль хлорида натрия 0,5у моль водорода. Найдем количество вещества водорода, выделившегося при электролизе смеси:
Составим уравнение: 0,5х + 0,5у =1,5
Вычислим молярные массы хлоридов калия и натрия:
М(КС1) = 39+35,5 = 74,5 г/моль
M(NaCl) = 23+35,5 = 58,5 г/моль
Масса х моль хлорида калия равна:
m(KCl) = v(KCl)-M(KCl) = х моль-74,5 г/моль = 74,5х г.
Масса у моль хлорида натрия равна:
m(KCl) = v(KCl)-M(KCl) = у моль-74,5 г/моль = 58,5у г.
Масса смеси равна 188,3 г, составим второе уравнение:
74,5х + 58,5у= 188,3
Итак, решаем систему из двух уравнений с двумя неизвестными:
Из первого уравнения выразим х:
Подставим это значение х во второе уравнение, получим:
74,5-(3-у) + 58,5у= 188,3
223,5-74,5у + 58,5у= 188,3
Найдем теперь значение х:
В смеси содержится 0,8 моль хлорида калия и 2,2 моль хлорида натрия.
Вычислим массу хлорида калия и хлорида натрия:
m(KCl) = v(KCl) 
m(KCl) = v(KCl) 
Вычислим массовую долю хлорида калия в смеси:
w(KCl)=m(KCl) 

Вычислим массовую долю хлорида натрия:
w(NaCl) = 100% — w(KCl) = 68,35%
Ответ: в смеси содержится 31,65% хлорида калия и 68,35% хлорида натрия.
🎬 Видео
ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Электролиз растворов. 2 часть. 10 класс.Скачать

Электролиз расплава гидроксида хлорида КАЛИЯ_Скачать

Электролиз. Часть 6. Раствор и расплав KOHСкачать

Водный раствор гидроксида натрия подвергли электролизу в течение 96500 секунд при силе тока 60 А.Скачать

Задачи по химии. Электролиз 6Скачать

Электролиз. Как составлять уравнения электролиза водных растворов солей.Скачать

Электролиз раствора KIСкачать