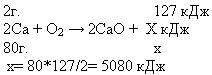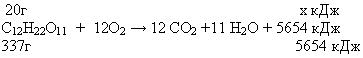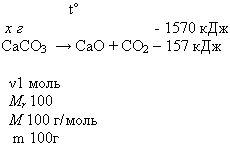Тепловой эффект химической реакции. Термохимические уравнения.
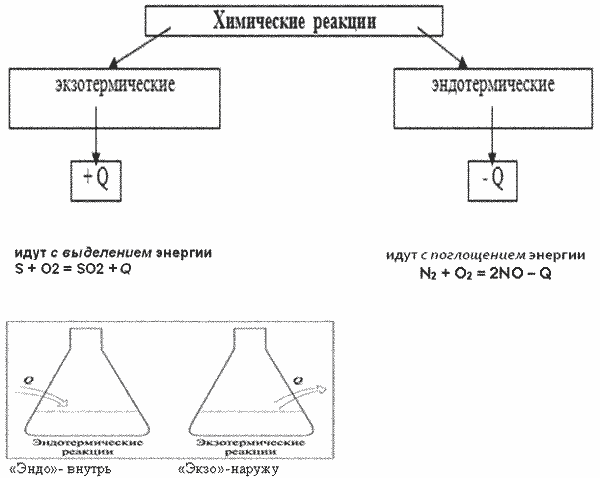
Химические реакции протекают либо с выделением теплоты, либо с поглощением теплоты.
Экзотермические реакции протекают с выделением теплоты (теплота указывается со знаком «+»). Эндотермические реакции – с поглощением теплоты (теплота Q указывается со знаком «–»).
Тепловой эффект химической реакции – это изменение внутренней энергии системы вследствие протекания химической реакции и превращения исходных веществ (реагентов) в продукты реакции в количествах, соответствующих уравнению химической реакции.
При протекании химических реакций наблюдаются некоторые закономерности, которые позволяют определить знак теплового эффекта химической реакции:
- Реакции, которые протекают самопроизвольно при обыных условиях, скорее всего экзотермические. Для запуска экзотермических реакций может потребоваться инициация – нагревание и др.
Например, после поджигания горение угля протекает самопроизвольно, реакция экзотермическая:
- Реакции образования устойчивых веществ из простых веществ экзотермические, реакции разложения чаще всего – эндотермические.
Например, разложение нитрата калия сопровождается поглощением теплоты:
- Реакции, в ходе которых из менее устойчивых веществ образуются более устойчивые, чаще всего экзотермические. И наоборот, образование более устойчивых веществ из менее устойчивых сопровождается поглощением теплоты. Устойчивость можно примерно определить по активности и стабильности вещества при обычных условиях. Как правило, в быту нас окружают вещества сравнительно устойчивые.
Например, горение амиака (взаимодействие активных, неустойчивых веществ — аммиака и кислорода) приводит к образованию устойчивых веществ – азота и воды. Следовательно, реакция экзотермическая:
Количество теплоты обозначают буквой Q, измеряют в кДж (килоджоулях) или Дж (джоулях).
Количество теплоты, выделяющейся в результате реакции, пропорционально количеству вещества, вступившего в реакцию.
В термохимии используются термохимические уравнения . Это уравнение реакции с указанием количества теплоты, выделившейся в ней (на число моль вещества, равное коэффициентам в уравнении).
Например, рассмотрим термохимическое уравнение сгорания водорода:
Из термохимического уравнения видно, что 484 кДж теплоты выделяются при сгорании 2 моль водорода, 1 моль кислорода. Также можно сказать, что при образовании 2 моль воды выделяется 484 кДж теплоты.
Теплота образования вещества – количество теплоты, выделяющееся при образовании 1 моль данного вещества из простых веществ.
Например, при сгорании алюминия:
теплота образования оксида алюминия равна 1675 кДж/моль. Если мы запишем термохимическое уравнение без дробных коэффициентов:
теплота образования Al2O3 все равно будет равна 1675 кДж/моль, т.к. в термохъимическом уравнении приведен тепловой эффект образования 2 моль оксида алюминия.
Теплота сгорания – количество теплоты, выделяющееся при горении 1 моль данного вещества.
Например, при горении метана:
теплота сгорания метана равна 802 кДж/моль.
Разберемся, как решать задачи на термохимические уравнения (задачи на термохимию) из ЕГЭ. Для этого разберем несколько примеров термохимических задач.
1. В результате реакции, термохимическое уравнение которой:
получено 98 л (н.у.) оксида азота (II). Определите количество теплоты, которое затратили при этом (в кДж). (Запишите число с точностью до целых.).
Решение.
Из термохимического уравнения видно, что на образование 2 моль оксида азота (II) потребуется 180 кДж теплоты. 2 моль оксида азота при н.у. занимают объем 44,8 л. Составляем простую пропорцию:
на получение 44,8 л оксида азота (II) затрачено 180 кДж теплоты,
на получение 98 л оксида азота затрачено х кДж теплоты.
Отсюда х= 180*98/44,8 = 393,75 кДж. Округляем ответ до целых, как требуется в условии: Q=394 кДж.
Ответ: потребуется 394 кДж теплоты.
2. В результате реакции, термохимическое уравнение которой
выделилось 1452 кДж теплоты. Вычислите массу образовавшейся при этом воды (в граммах). (Запишите число с точностью до целых.)
Решение.
Из термохимического уравнения видно, что при образовании 2 моль воды выделится 484 кДж теплоты. Масса 2 моль воды равна 36 г. Составляем простую пропорцию:
при образовании 36 г воды выделится 484 кДж теплоты,
при образовании х г воды выделится 1452 кДж теплоты.
Отсюда х= 1452*36/484 = 108 г.
Ответ: образуется 108 г воды.
3. В результате реакции, термохимическое уравнение которой
израсходовано 80 г серы. Определите количество теплоты, которое выделится при этом (в кДж). (Запишите число с точностью до целых).
Решение.
Из термохимического уравнения видно, что при сгорании 1 моль серы выделится 296 кДж теплоты. Масса 1 моль серы равна 32 г. Составляем простую пропорцию:
при сгорании 32 г серы выделится 296 кДж теплоты,
при сгорании 80 г серы выделится х кДж теплоты.
Отсюда х= 80*296/32 = 740 кДж.
Ответ: выделится 740 кДж теплоты.
Видео:Решение задач на термохимические уравнения. 8 класс.Скачать

Решение задач. Экзотермические и эндотермические реакции.
Данный урок -это решение задач на тепловой эффект химической реакции. Учащиеся работают по определенному алгоритму предоставленный учителем.
Просмотр содержимого документа
«Решение задач. Экзотермические и эндотермические реакции.»
Решение задач. Экзотермические и эндотермические реакции.
Цель: рассмотреть процесс решения задач с тепловыми эффектами.
Задачи: Продолжить знакомить учащихся с понятием “тепловой эффект химических реакций”, классификацией химических реакций (явлений) по тепловому эффекту. Развитие умений составлять термохимические уравнения и производить расчеты теплоты по уравнению реакции. Воспитание интереса к предмету.
Методы: словесный; письменный; наглядный.
I. Мотивационный момент.
Отметить отсутствующих. Настроить класс на работу.
II. Проверка домашнего задания.
III. Изучение новой темы
2. Понятие тепловой эффект химических реакций
Причина теплового эффекта — разница внутренней энергии продуктов реакции и внутренней энергии реагентов.
(работа с учебником стр. 65 –определение )
3. Термохимия, термохимические уравнения.
Термохимия — раздел химии, в задачу которого входит определение и изучение тепловых эффектов реакции.
Термохимические уравнения – уравнения в которых указывается количество поглощенной или выделенной теплоты.
2HgO — 2Hg + O2 – 180 кДж, С(тв) + O2(г) — СO2(г) + 394 кДж
4. По термохимическим уравнениям реакций можно проводить различные расчёты. Для решения задач по термохимическим уравнениям реакций нужно записать само уравнение и провести необходимые расчеты по нему.
Алгоритм решения задач по термохимическому уравнению реакции
Кратко записать условия задачи (“дано”).
Записать термохимическое уравнение реакции (ТХУ), одной чертой в уравнении реакции подчеркивают то, что известно, двумя чертами подчёркивают то, что необходимо определить.
Провести вспомогательные вычисления (корень квадратный, Мr, М, m).
Составить соотношение, используя вспомогательные вычисления и условия задачи; решить соотношение (пропорцию).
Ответ: 2Са + О2 — 2СаО + 5080 кДж
Решение задач учениками.
х= 20* 5654/337 = 38,81 кДж
2. Вычислите массу разложившегося мела (СаСО3), если известно, что на его разложение затрачено 1570 кДж.
M(СаСО3) = 1 моль* 100 г/моль = 100г
100г : 157 кДж = х г : 1570 кДж
Ответ: m (СаСО3) = 1 кг (или разложилось 1000г мела)
IV. Закрепление изученного материала
1. Заполни пропуски
Реакции, протекающие с выделением теплоты и света, называют реакциями
Выберите пропущенные слова (укажи буквы, соответствующие по смыслу пропускам):
а) разложения; б) горения; в) эндотермические; г) экзотермические.
2. Какие схемы можно назвать термохимическими уравнениями реакций?
3. Какая запись, соответствует эндотермической реакции?
а) С(тв) + O2(г) = СO2(г) + 394 кДж б) СаСO3 = СO2 + СаО – 310 кДж
4. Установите соответствие между схемой реакции и её типом:
1. Эндотермическая реакция 2. Экзотермическая реакция
5. Приведены уравнения реакций:
Определите тип, к которому относятся данные реакции.
1) обе реакции экзотермические 2) обе реакции эндотермические
3) А – эндотермическая, а Б – экзотермическая 4) А – экзотермическая, а Б – эндотермическая
V. Итог по уроку:
— Как классифицируются реакции по тепловому эффекту?
— Что такое тепловой эффект реакции? — Чем отличаются термохимические уравнения VI. Д/з
1. Заполни пропуски
Реакции, протекающие с выделением теплоты и света, называют реакциями
Выберите пропущенные слова (укажи буквы, соответствующие по смыслу пропускам):
а) разложения; б) горения; в) эндотермические; г) экзотермические.
2. Какие схемы можно назвать термохимическими уравнениями реакций?
3. Какая запись, соответствует эндотермической реакции?
а) С(тв) + O2(г) = СO2(г) + 394 кДж б) СаСO3 = СO2 + СаО – 310 кДж
4. Установите соответствие между схемой реакции и её типом:
1. Эндотермическая реакция 2. Экзотермическая реакция
5. Приведены уравнения реакций:
Определите тип, к которому относятся данные реакции.
1) обе реакции экзотермические 2) обе реакции эндотермические
3) А – эндотермическая, а Б – экзотермическая 4) А – экзотермическая, а Б – эндотермическая
1. Заполни пропуски
Реакции, протекающие с выделением теплоты и света, называют реакциями
Выберите пропущенные слова (укажи буквы, соответствующие по смыслу пропускам):
а) разложения; б) горения; в) эндотермические; г) экзотермические.
2. Какие схемы можно назвать термохимическими уравнениями реакций?
3. Какая запись, соответствует эндотермической реакции?
а) С(тв) + O2(г) = СO2(г) + 394 кДж б) СаСO3 = СO2 + СаО – 310 кДж
4. Установите соответствие между схемой реакции и её типом:
1. Эндотермическая реакция 2. Экзотермическая реакция
5. Приведены уравнения реакций:
Определите тип, к которому относятся данные реакции.
1) обе реакции экзотермические 2) обе реакции эндотермические
3) А – эндотермическая, а Б – экзотермическая 4) А – экзотермическая, а Б – эндотермическая
Видео:Экзо- и эндотермические реакции. Тепловой эффект химических реакций. 8 класс.Скачать

Тепловой эффект химических реакций. Эндо- и экзо-термические реакции. Решение задач.
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
Урок № 38 (5) Предмет химия класс 8 (а,б,в), дата 25.01.17
Тема урока: Тепловой эффект химических реакций. Эндо- иэкзо-термические реакции. Решение задач.
Цели урока: Д ать учащимся понятия « поглощение теплоты», « выделение теплоты», « энергия», « эндо – и экзотермические реакции», « тепловой эффект химической реакции».
Обучающая: Научить учащихся решать задачи по термохимическим уравнениям реакций. ;
Развивающая: способствовать развитию у учащихся логического мышления, умения анализировать и сравнивать, работать с дополнительной информацией;
Воспитывающая: продолжать воспитывать интерес к предмету, умение работать в коллективе, бережное отношение к природе (атмосфере).
Тип урока: комбинированный
Форма проведения: лекция, самостоятельная работа.
Методы : словесный, проблема, практический, объяснително-иллюстрационный,
Оборудование урока: учебные таблицы.
приветствие, перекличка, рабочий настрой, мотивационный аспект начала урока.
2. Актуализация опорных знаний (Мобилизующее начало урока):
1. Рассказать о термохимических реакциях?
2.какие реакции называют эндотермическими?
3. какие реакции называют экзотермическими?
Основной этап урока (Познавательно-операционная часть урока):
Термохимические уравнения включают в себя кроме химических формул тепловой эффект реакции. Числовое значение в уравнении реакции строго соответствует количествам веществ, участников реакции, т.е. коэффициентам. Благодаря этому соответствию, можно установить пропорциональные отношения между количеством вещества или массой и количеством теплоты в этой реакции.
Например: Термохимическое уравнение разложения малахита
( CuOH ) 2 CO 3 = 2 CuO + H 2 O + CO 2 — 47 кДж
Мы видим, что на разложение 1 моля малахита необходимо израсходовать 47 кДж, при этом образуется 2 моля оксида меди, 1 моль воды и 1 моль углекислого газа. Если мы затратим энергии в 2 раза больше, мы сумеем разложить 2 моля малахита, при этом получим 4 моля оксида меди, 2 моля воды и 2 моля углекислого газа.
Аналогично можно установить пропорциональные отношения, используя коэффициенты и молярные массы участников реакции. 47 кДж энергии затратится на разложение 94 г малахита, при этом выделится 160 г оксида меди, 18 г воды и 44 г углекислого газа. Пропорция несложная, но, используя массовые числа, учащиеся часто допускают расчетные ошибки, поэтому я рекомендую решать задачи с пропорциями через количество вещества.
Задача 1. Определите количество теплоты, которое выделится при образовании 120 г MgO в результате реакции горения магния, с помощью термохимического уравнения.
2 Mq + O 2 = 2 MqO + 1204 кДж
1) Определяем количества оксида магния, используя формулу для нахождения количества вещества через массу.
n ( MqO ) = 120г/ 40 г/моль = 3 моль
2) Составляем пропорцию с учетом коэффициентов в уравнении реакции
📺 Видео
Задачи на ТЕПЛОВОЙ ЭФФЕКТ | Термохимические уравненияСкачать

Химия | Тепловой эффект химической реакции (энтальпия)Скачать

Термохимические уравнения. Экзо- и эндотермические реакции. Задачи на тепловой эффект | Урок 17Скачать

Тепловой эффект реакции. Экзотермические и эндотермические реакцииСкачать

ЭКЗО- и ЭНДО- термические реакции. Химия – ПростоСкачать

Тепловой эффект реакции. ЗадачиСкачать

Термохимические реакции. Практическая часть - решение задачи. 9 класс.Скачать

78. Тепловой эффект реакции. Термохимические уравнения (часть 1)Скачать

Хим для экзамена: Экзо и эндотермические реакции. Задачи.Скачать

Задача на термохимические уравнения: разбор задания 27 | ХИМИЯ ЕГЭ 2022Скачать

Уравнивание органических ОВР за 12 минут | ХИМИЯ ЕГЭ | СОТКАСкачать

Экзотермические и эндотермические реакции (видео 9) | Энергия| БиологияСкачать

Тепловой эффект химических реакций. Понятие об экзо- и эндотермических реакцияхСкачать

Химия 9 класс (Урок№2 - Тепловой эффект химических реакций. )Скачать

Термохимическое уравнение | ХимияСкачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Экзотермические и эндотермические реакцииСкачать

79. Тепловой эффект реакции. Термохимические уравнения (часть 2)Скачать