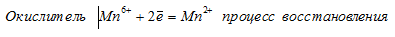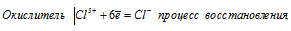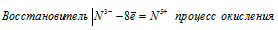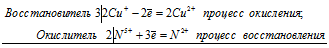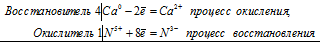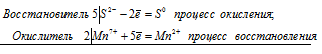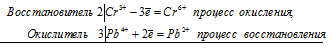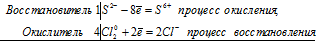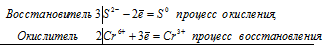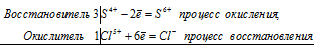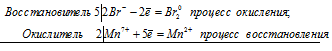1) 4Ca+5H2SO4->4CaSO4+H2S+4H2O
Ca(0)+2e- = Ca(+2)
S(+6)-8e- = S(-2)
Правило креста, поэтому 8 перед кальцием и 2 перед серой, но мы можем сократить и поэтому ставим 4 и 1, а если 1 то коэффициенты не нужны. Дальше уравниваем по группировкам SO4 вместе с S в правой части. Потом по H2 и O2
2) m(р-ра h2so4)=245 г
+BaCl2
w(омега=0,1
Решение:
H2SO4+BaCl2->BaSO4+2HCl, BaSO4 — осадок
w=m(веществаm(раствора => 0,1=m(BaSO4)245 => m(BaSO4)=0,1*245=24,5 г
- Вычислите стандартную ЭДС реакции, закончите уравнение и расставьте коэффициенты Ca+H2SO4(конц) ->H2S+.
- Ваш ответ
- Похожие вопросы
- Методы составления уравнений окислительно-восстановительных реакций
- Решение задач по химии на определение коэффициентов в уравнении реакции методом электронного баланса
- 🎬 Видео
Видео:ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

Вычислите стандартную ЭДС реакции, закончите уравнение и расставьте коэффициенты Ca+H2SO4(конц) ->H2S+.
Видео:Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Ваш ответ
Видео:89. Как расставить коэффициенты реакции методом электронного баланса (закрепление)Скачать

Похожие вопросы
- Все категории
- экономические 43,415
- гуманитарные 33,633
- юридические 17,906
- школьный раздел 608,079
- разное 16,856
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Видео:ЭТОТ метод поможет на уроках ХИМИИ / Химия 9 классСкачать

Методы составления уравнений окислительно-восстановительных реакций
Видео:Составление ур-й окислительно-восст. реакций методом ионно-электронного баланса. 1ч. 10 класс.Скачать

Решение задач по химии на определение коэффициентов в уравнении реакции методом электронного баланса
Задание 226.
Составьте электронные уравнения и укажите, какой процесс — окисление или восстановление — происходит при следующих превращениях:
Мn 6+ ⇔ Мn 2+ ; С1 5+ ⇔ С l- ; N 3- ⇔ N 5+ . На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме:
Сu2O + HNO3 ⇔ Cu(NO3)2 + NO + H2O.
Решение:
При превращении Мn 6+ ⇔ Мn 2+ происходит процесс восстановления (присоединение электронов).
При превращении С1 5+ ⇔ С l- происходит процесс восстановления (присоединение электронов).
При превращении N 3- ⇔ N 5+ происходит процесс окисления (отдача электронов).
Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях:
6Сu + + 2N 5+ = 6Cu 2+ + 2N 2+
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов шесть. Разделив это число на 3, получаем коэффициент 2 для окислителя и продукта его восстановления, а при делении 6 на 2 получаем коэффициент 3 для восстановителя и продукта его окисления. Коэффициент перед веществами, атомы которых не меняют свою степень окисления, находят подбором. Молекулярное уравнение реакции:
Задание 227.
Реакции выражаются схемами:
HNO3 + Ca ⇔ NH4NO3 + Ca(NO3)2 + H2O;
K2S + KMnO4 +Н2SO4 ⇔ S + K2SO4 + MnSO4 + H2O
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое — восстановителем; какое вещество окисляется, какое — восстанавливается.
Решение:
Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях. Коэффициенты для восстановителя и окислителя идентичны для продуктов окисления и восстановления. . Коэффициент перед веществами, атомы которых не меняют свою степень окисления, находят подбором.
4Са 0 + N 5+ = 4Са 2+ + N 3-
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов восемь. Разделив это число на 8, получаем коэффициент 1 для окислителя и продукта его восстановления, а при делении 8 на 2 получаем коэффициент 4 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
В данной реакции: Са – восстановитель, HNO3 – окислитель; Са окисляется до Ca(NO3)2, HNO3 – восстанавливается до NH4NO3.
5S 2- + 2Mn 7+ ⇔ 5S 0 + 2Mn 2+
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов десять. Разделив это число на 5, получаем коэффициент 2 для окислителя и продукта его восстановления, а при делении 10 на 2 получаем коэффициент 5 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
В данной реакции: К2S – восстановитель, KMnO4 – окислитель; К2S окисляется до К2SO4, KMnO4 – восстанавливается до MnSO4.
Задание 228.
Исходя из степени окисления хрома, йода и серы в соединениях К2Cr2O7, КI и Н2SO4, определите, какое из них является только окислителем, только восстановителем и какое может проявлять как окислительные, так и восстановительные свойства. Почему? На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме
NaCrO 2 + РbO 2 + NаОН ⇔ Na 2 CrO 4 + Na 2 PbO 2 + Н 2 O
Решение:
а) Степень окисления хрома, йода и серы в указанных соединениях соответственно равна +6 (высшая), -1 (низшая) и +6 (высшая). Отсюда: К2Cr2O7 только окислитель; КI — только восстановитель; Н2SO4 — только окислитель.
б) NaCrO 2 + РbO 2 + NаОН ⇔ Na 2 CrO 4 + Na 2 PbO 2 + Н 2 O
Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях. Коэффициенты для восстановителя и окислителя идентичны для продуктов окисления и восстановления. . Коэффициент перед веществами, атомы которых не меняют свою степень окисления, находят подбором.
2Сr 3+ + 3Pb 4+ ⇔ 2Сr 6+ + Pb 2+
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов шесть. Разделив это число на 2, получаем коэффициент 3 для окислителя и продукта его восстановления, а при делении 6 на 3 получаем коэффициент 2 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
Задание 229.
Реакции выражаются схемами:
H2S + Cl2 + H2O ⇔ H2SO4 + HCl
K 2Cr 2O 7 + H 2 S + Н 2 SO 4 ⇔ S + Cr 2 (SO 4 ) 3 + K 2 SO 4 + H 2 O
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое — восстановителем; какое вещество окисляется, какое — восстанавливается.
Решение:
Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях. Коэффициенты для восстановителя и окислителя идентичны для продуктов окисления и восстановления. Коэффициент перед веществами, атомы которых не меняют свою степень окисления, находят подбором.
Уравнения электронного баланса:
S -2 + 4Cl2 0 ⇔ S +6 + 8Cl -1
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов восемь. Разделив это число на 2, получаем коэффициент 4 для окислителя и продукта его восстановления, а при делении 8 на 8 получаем коэффициент 1 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
В данной реакции: Н2S – восстановитель, Cl2 – окислитель; Н2S окисляется до Н2SO4, Cl2 – восстанавливается до HCl.
б) K 2Cr 2O 7 + H 2 S + Н 2 SO 4 ⇔ S + Cr 2 (SO 4 ) 3 + K 2 SO 4 + H 2 O
3S 2- + 2Cr 6+ ⇔3S 0 + 2Cr 3+
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов шесть. Разделив это число на 3, получаем коэффициент 2 для окислителя и продукта его восстановления, а при делении 6 на 3 получаем коэффициент 2 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
Задание 230.
Реакции выражаются схемами:
KClO3 + Na2SO3 ⇔ KCl + Na2SO4;
KMnO4 + HBr ⇔ Br2 + KBr + MnBr2 + H2O
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое — восстановителем; какое вещество окисляется, какое — восстанавливается.
Решение:
Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях. Коэффициенты для восстановителя и окислителя идентичны для продуктов окисления и восстановления. Коэффициент перед веществами, атомы которых не меняют свою степень окисления, находят подбором.
3S 4+ + Cl 5+ = 3S 6+ + Cl —
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов шесть. Разделив это число на 6, получаем коэффициент 1 для окислителя и продукта его восстановления, а при делении 6 на 2 получаем коэффициент 3 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
В данной реакции: Na2SO3 – восстановитель, KClO3 – окислитель; Na2SO3 окисляется до Na2SO4, KClO3 – восстанавливается до KCl.
10Br — + 2Mn 7+ ⇔ 5Br2 0 + 2Mn 2+
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов десять. Разделив это число на 5, получаем коэффициент 2 для окислителя и продукта его восстановления, а при делении 10 на 2 получаем коэффициент 5 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
В данной реакции: HBr – восстановитель, KMnO4 – окислитель; HBr окисляется до Br2, KMnO4 – восстанавливается до MnBr2.
🎬 Видео
How to Balance Ca + H2SO4 = CaSO4 + H2 (Calcium + Sulfuric acid)Скачать

8 класс. ОВР. Окислительно-восстановительные реакции.Скачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Окислительно-восстановительные реакции в кислой среде. Упрощенный подход.Скачать

Решение цепочек превращений по химииСкачать

Окислительно-восстановительные реакции. Метод электронно-ионного баланса.Скачать

Химия, 9 класс, тема "Окислительно-восстановительные реакции" (учитель Швецова Елена Евгеньевна)Скачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Расстановка коэффициентов методом электронного баланса | Химия TutorOnlineСкачать

Окислительно-восстановительные реакции. 1 часть. 9 класс.Скачать

Химия 9 класс — Как определять Степень Окисления?Скачать

ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Окислительно-восстановительные реакции. Метод электронного баланса. ЕГЭСкачать

Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать