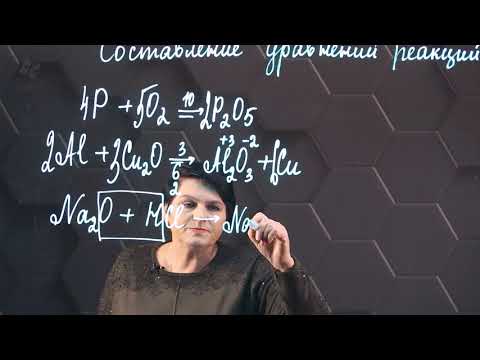- Ваш ответ
- решение вопроса
- Похожие вопросы
- Закончите схемы возможных реакций, приведите для них молекулярные , полные и краткие ионные уравнения 2 задание пожалуйста?
- Cрочно надо, Напишите уравнение реакций (молекулярные / полные ионные и сокращенные ионные)Нужны что бы были решены все задания пожалуйста?
- Закончите схемы возможных реакций, приведите для них молекулярные, полные и сокращённые ионные уравнения :б) NaOH + PbCl2 →в) CuBr2 + AgNO3 →г) KOH + H3PO4 →д) Na2SO3 + H2SO4→?
- Закончите молекулярные уравнения возможных реакций , протекающих в растворах, и запишите соответствующие им полные и сокращенные ионные уравнения СuSO4 + HCl — > ; Cu + AgNO3 — > ?
- Закончите схемы возможных реакций, приведите для них молекулярные, полные и краткие ионные уравнения : LiOH + BaCl2 = ?
- Закончите уравнения возможных реакций?
- Для реакции 3 приведите полное и сокращенное ионно — молекулярные уравнения?
- Молекулярные полные и сокращенные ионные уравнения возможных реакций KNO3 + HCl?
- Закончите молекулярные уравнения возможных реакций, протекающих в растворах, и запишите соответствующие им ионные уравнения?
- Помогите закончить запись молекулярного уравнения, составить полное и краткое ионно — молекулярное уравнение FeSO4 + (NH4)2s?
- Закончить молекулярное уравнение и написать полные и краткие ионные уравнения реакций взаимодействия следующих веществ : Fe(OH)3 + HBr → ?
- Серная кислота
- Серная кислота
- Строение молекулы и физические свойства
- Способы получения
- Химические свойства
- Please wait.
- We are checking your browser. gomolog.ru
- Why do I have to complete a CAPTCHA?
- What can I do to prevent this in the future?
- 📸 Видео
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Ваш ответ
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

решение вопроса
Видео:Химия | Молекулярные и ионные уравненияСкачать

Похожие вопросы
- Все категории
- экономические 43,429
- гуманитарные 33,634
- юридические 17,906
- школьный раздел 608,227
- разное 16,858
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Закончите схемы возможных реакций, приведите для них молекулярные , полные и краткие ионные уравнения 2 задание пожалуйста?
Химия | 1 — 4 классы
Закончите схемы возможных реакций, приведите для них молекулярные , полные и краткие ионные уравнения 2 задание пожалуйста.
A) AgNO₃ + KCl = AgCl↓ + KNO₃
Ag⁺ + NO₃⁻ + K⁺ + Cl⁻ = AgCl↓ + K⁺ + NO₃⁻
б) реакция не идет
в) CuSO₄ + Ba(OH)₂ = Cu(OH)₂↓ + BaSO₄↓
Cu²⁺ + SO₄²⁻ + Ba²⁺ + 2OH⁻ = Cu(OH)₂↓ + BaSO₄↓
г) Al₂(SO₄)₃ + 6KOH = 2Al(OH)₃↓ + 3K₂SO₄
2Al³⁺ + 3SO₄²⁻ + 6K⁺ + 6OH⁻ = 2Al(OH)₃↓ + 3K⁺ + 3SO₄²⁻
2Al³⁺ + 6OH⁻ = 2Al(OH)₃↓
д) Fe(OH)₃ + 3HCl = FeCl₃ + 3H₂O
Fe(OH)₃ + 3H⁺ + 3Cl⁻ = Fe³⁺ + 3Cl⁻ + 3H₂O
Fe(OH)₃ + 3H⁺ = 3H₂O + Fe³⁺
е) MgCO₃ + H₂SO₄ = MgSO₄ + H₂O + CO₂↑
MgCO₃ + 2H⁺ + SO₄²⁻ = Mg²⁺ + SO₄²⁻ + H₂O + CO₂↑
MgCO₃ + 2H⁺ = Mg²⁺ + H₂O + CO₂↑.
Видео:Ионные уравнения реакций. Как составлять полные и сокращенные уравненияСкачать

Cрочно надо, Напишите уравнение реакций (молекулярные / полные ионные и сокращенные ионные)Нужны что бы были решены все задания пожалуйста?
Cрочно надо, Напишите уравнение реакций (молекулярные / полные ионные и сокращенные ионные)Нужны что бы были решены все задания пожалуйста!
Видео:составляем молекулярные уравнения по сокращённым ионнымСкачать

Закончите схемы возможных реакций, приведите для них молекулярные, полные и сокращённые ионные уравнения :б) NaOH + PbCl2 →в) CuBr2 + AgNO3 →г) KOH + H3PO4 →д) Na2SO3 + H2SO4→?
Закончите схемы возможных реакций, приведите для них молекулярные, полные и сокращённые ионные уравнения :
д) Na2SO3 + H2SO4→.
Видео:Реакции ионного обмена. 9 класс.Скачать

Закончите молекулярные уравнения возможных реакций , протекающих в растворах, и запишите соответствующие им полные и сокращенные ионные уравнения СuSO4 + HCl — > ; Cu + AgNO3 — > ?
Закончите молекулярные уравнения возможных реакций , протекающих в растворах, и запишите соответствующие им полные и сокращенные ионные уравнения СuSO4 + HCl — > ; Cu + AgNO3 — > ;
Видео:Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Закончите схемы возможных реакций, приведите для них молекулярные, полные и краткие ионные уравнения : LiOH + BaCl2 = ?
Закончите схемы возможных реакций, приведите для них молекулярные, полные и краткие ионные уравнения : LiOH + BaCl2 = .
Видео:Реакции ионного обмена. 9 класс.Скачать

Закончите уравнения возможных реакций?
Закончите уравнения возможных реакций.
Запишите уравнение в молекулярном и ионном виде.
Видео:Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

Для реакции 3 приведите полное и сокращенное ионно — молекулярные уравнения?
Для реакции 3 приведите полное и сокращенное ионно — молекулярные уравнения.
Видео:ХИМИЧЕСКИЕ УРАВНЕНИЯ | Как составлять уравнения реакций | Химия 8 классСкачать

Молекулярные полные и сокращенные ионные уравнения возможных реакций KNO3 + HCl?
Молекулярные полные и сокращенные ионные уравнения возможных реакций KNO3 + HCl.
Видео:9 класс. Реакции ионного обмена. Ионные уравнения.Скачать

Закончите молекулярные уравнения возможных реакций, протекающих в растворах, и запишите соответствующие им ионные уравнения?
Закончите молекулярные уравнения возможных реакций, протекающих в растворах, и запишите соответствующие им ионные уравнения.
Видео:Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Помогите закончить запись молекулярного уравнения, составить полное и краткое ионно — молекулярное уравнение FeSO4 + (NH4)2s?
Помогите закончить запись молекулярного уравнения, составить полное и краткое ионно — молекулярное уравнение FeSO4 + (NH4)2s.
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Закончить молекулярное уравнение и написать полные и краткие ионные уравнения реакций взаимодействия следующих веществ : Fe(OH)3 + HBr → ?
Закончить молекулярное уравнение и написать полные и краткие ионные уравнения реакций взаимодействия следующих веществ : Fe(OH)3 + HBr → .
1. Укажите сумму всех коэффициентов в полном ионно — молекулярном уравнении
Укажите коэффициент перед формулой слабого электролита в молекулярном уравнении
Укажите сумму всех коэффициентов в кратком ионно — молекулярном уравнении.
На этой странице сайта размещен вопрос Закончите схемы возможных реакций, приведите для них молекулярные , полные и краткие ионные уравнения 2 задание пожалуйста? из категории Химия с правильным ответом на него. Уровень сложности вопроса соответствует знаниям учеников 1 — 4 классов. Здесь же находятся ответы по заданному поиску, которые вы найдете с помощью автоматической системы. Одновременно с ответом на ваш вопрос показаны другие, похожие варианты по заданной теме. На этой странице можно обсудить все варианты ответов с другими пользователями сайта и получить от них наиболее полную подсказку.
Ω(C) = 14, 3% DH2(СnH2n) = 21 _______________ СnH2n — ? Mr(СnH2n) = 21ˣ2 = 42 Мr(СnH2n) = 12n + 2n = 42 Решаем как простое уравнение с одним неизвестным : 12n + 2n = 42 14n = 42 n = 42 : 14 n = 3 это значит, что количество атомов С = 3, подставляем ..
Ответ : буква б). Калий, кальций, стронций.
Видео:ЭТОТ метод поможет на уроках ХИМИИ / Химия 9 классСкачать

Серная кислота
Серная кислота
Строение молекулы и физические свойства
Серная кислота H2SO4 – это сильная кислота, двухосновная, прочная и нелетучая. При обычных условиях серная кислота – тяжелая маслянистая жидкость, хорошо растворимая в воде.
Растворение серной кислоты в воде сопровождается выделением значительного количества кислоты. Поэтому по правилам безопасности в лаборатории при смешивании серной кислоты и воды мы добавляем серную кислоту в воду небольшими порциями при постоянном перемешивании.
Валентность серы в серной кислоте равна VI.
Способы получения
1. Серную кислоту в промышленности производят из серы, сульфидов металлов, сероводорода и др. Один из вариантов — производство серной кислоты из пирита FeS2.
Основные стадии получения серной кислоты :
- Сжигание или обжиг серосодержащего сырья в кислороде с получением сернистого газа.
- Очистка полученного газа от примесей.
- Окисление сернистого газа в серный ангидрид.
- Взаимодействие серного ангидрида с водой.
Рассмотрим основные аппараты, используемые при производстве серной кислоты из пирита (контактный метод):
| Аппарат | Назначение и уравнения реакций |
| Печь для обжига | 4FeS2 + 11O2 → 2Fe2O3 + 8SO2 + Q Измельченный очищенный пирит сверху засыпают в печь для обжига в «кипящем слое». Снизу (принцип противотока) пропускают воздух, обогащенный кислородом, для более полного обжига пирита. Температура в печи для обжига достигает 800 о С |
| Циклон | Из печи выходит печной газ, который состоит из SO2, кислорода, паров воды и мельчайших частиц оксида железа. Такой печной газ очищают от примесей. Очистку печного газа проводят в два этапа. Первый этап — очистка газа в циклоне. При этом за счет центробежной силы твердые частички ссыпаются вниз. |
| Электрофильтр | Второй этап очистки газа проводится в электрофильтрах. При этом используется электростатическое притяжение, частицы огарка прилипают к наэлектризованным пластинам электрофильтра). |
| Сушильная башня | Осушку печного газа проводят в сушильной башне – снизу вверх поднимается печной газ, а сверху вниз льется концентрированная серная кислота. |
| Теплообменник | Очищенный обжиговый газ перед поступлением в контактный аппарат нагревают за счет теплоты газов, выходящих из контактного аппарата. |
| Контактный аппарат | 2SO2 + O2 ↔ 2SO3 + Q В контактном аппарате производится окисление сернистого газа до серного ангидрида. Процесс является обратимым. Поэтому необходимо выбрать оптимальные условия протекания прямой реакции (получения SO3):
Как только смесь оксида серы и кислорода достигнет слоев катализатора, начинается процесс окисления SO2 в SO3. Образовавшийся оксид серы SO3 выходит из контактного аппарата и через теплообменник попадает в поглотительную башню. |
| Поглотительная башня | Получение H2SO4 протекает в поглотительной башне. Однако, если для поглощения оксида серы использовать воду, то образуется серная кислота в виде тумана, состоящего из мельчайших капелек серной кислоты. Для того, чтобы не образовывался сернокислотный туман, используют 98%-ную концентрированную серную кислоту. Оксид серы очень хорошо растворяется в такой кислоте, образуя олеум: H2SO4·nSO3. Образовавшийся олеум сливают в металлические резервуары и отправляют на склад. Затем олеумом заполняют цистерны, формируют железнодорожные составы и отправляют потребителю. |
Общие научные принципы химического производства:
- Непрерывность.
- Противоток
- Катализ
- Увеличение площади соприкосновения реагирующих веществ.
- Теплообмен
- Рациональное использование сырья
Химические свойства
Серная кислота – это сильная двухосновная кислота .
1. Серная кислота практически полностью диссоциирует в разбавленном в растворе по первой ступени:
По второй ступени серная кислота диссоциирует частично, ведет себя, как кислота средней силы:
HSO4 – ⇄ H + + SO4 2–
2. Серная кислота реагирует с основными оксидами, основаниями, амфотерными оксидами и амфотерными гидроксидами.
Например , серная кислота взаимодействует с оксидом магния:
Еще пример : при взаимодействии серной кислоты с гидроксидом калия образуются сульфаты или гидросульфаты:
Серная кислота взаимодействует с амфотерным гидроксидом алюминия:
3. Серная кислота вытесняет более слабые из солей в растворе (карбонаты, сульфиды и др.). Также серная кислота вытесняет летучие кислоты из их солей (кроме солей HBr и HI).
Например , серная кислота взаимодействует с гидрокарбонатом натрия:
Или с силикатом натрия:
Концентрированная серная кислота реагирует с твердым нитратом натрия. При этом менее летучая серная кислота вытесняет азотную кислоту:
Аналогично – концентрированная серная кислота вытесняет хлороводород из твердых хлоридов, например , хлорида натрия:
4. Т акже серная кислота вступает в обменные реакции с солями.
Например , серная кислота взаимодействует с хлоридом бария:
5. Разбавленная серная кислота взаимодействует с металлами, которые расположены в ряду активности металлов до водорода. При этом образуются соль и водород.
Например , серная кислота реагирует с железом. При этом образуется сульфат железа (II):
Серная кислота взаимодействует с аммиаком с образованием солей аммония:
Концентрированная серная кислота является сильным окислителем . При этом она обычно восстанавливается до сернистого газа SO2. С активными металлами может восстанавливаться до серы S, или сероводорода Н2S.
Железо Fe, алюминий Al, хром Cr пассивируются концентрированной серной кислотой на холоде. При нагревании реакция возможна.
При взаимодействии с неактивными металлами концентрированная серная кислота восстанавливается до сернистого газа:
При взаимодействии с щелочноземельными металлами и магнием концентрированная серная кислота восстанавливается до серы:
При взаимодействии с щелочными металлами и цинком концентрированная серная кислота восстанавливается до сероводорода:
6. Качественная реакция на сульфат-ионы – взаимодействие с растворимыми солями бария. При этом образуется белый кристаллический осадок сульфата бария:
Видеоопыт взаимодействия хлорида бария и сульфата натрия в растворе (качественная реакция на сульфат-ион) можно посмотреть здесь.
7. Окислительные свойства концентрированной серной кислоты проявляются и при взаимодействии с неметаллами.
Например , концентрированная серная кислота окисляет фосфор, углерод, серу. При этом серная кислота восстанавливается до оксида серы (IV):
Уже при комнатной температуре концентрированная серная кислота окисляет галогеноводороды и сероводород:
Видео:Решение задач по уравнениям параллельно протекающих реакций. 1 часть. 11 класс.Скачать

Please wait.
Видео:Реакция ионного обмена. Полное и сокращенное ионное уравнение. Практика. Видеоурок 39. Химия 9 классСкачать

We are checking your browser. gomolog.ru
Видео:Ионные уравнения | Химия 8 класс #42 | ИнфоурокСкачать

Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 708aa3d22e529785 • Your IP : 178.45.22.152 • Performance & security by Cloudflare
📸 Видео
Составление уравнений реакций. 1 часть. 9 класс.Скачать