Спецификой многих ОВР является то, что при составлении их уравнений подбор коэффициентов вызывает затруднение.
Для облегчения подбора коэффициентов чаще всего используют метод электронного баланса и ионно-электронный метод (метод полуреакций). Рассмотрим применение каждого из этих методов на примерах.
- Метод электронного баланса
- Ионно-электронный метод (метод полуреакций)
- Please wait.
- We are checking your browser. gomolog.ru
- Why do I have to complete a CAPTCHA?
- What can I do to prevent this in the future?
- Составление уравнений ОВР методом электронного баланса материал по химии по теме
- Скачать:
- Предварительный просмотр:
- 📺 Видео
Видео:Окислительно-восстановительные реакции. Метод электронного баланса. ЕГЭСкачать

Метод электронного баланса
В его основе метода электронного баланса лежит следующее правило: общее число электронов, отдаваемое атомами-восстановителями, должно совпадать с общим числом электронов, которые принимают атомы-окислители .
В качестве примера составления ОВР рассмотрим процесс взаимодействия сульфита натрия с перманганатом калия в кислой среде.
1) Составить схему реакции:
Записать исходные вещества и продукты реакции, учитывая, что в кислой среде MnO4 — восстанавливается до Mn 2+ (см. схему):
Найдем степень окисления элементов:
Из приведенной схемы понятно, что в процессе реакции происходит увеличение степени окисления серы с +4 до +6. S +4 отдает 2 электрона и является восстановителем. Степень окисления марганца уменьшилась от +7 до +2, т.е. Mn +7 принимает 5 электронов и является окислителем.
3) Составить электронные уравнения и найти коэффициенты при окислителе и восстановителе.
S +4 – 2e — = S +6 | 5 восстановитель, процесс окисления
Mn +7 +5e — = Mn +2 | 2 окислитель, процесс восстановления
Чтобы число электронов, отданных восстановителем, было равно числу электронов, принятых восстановителем, необходимо:
- Число электронов, отданных восстановителем, поставить коэффициентом перед окислителем.
- Число электронов, принятых окислителем, поставить коэффициентом перед восстановителем.
Таким образом, 5 электронов, принимаемых окислителем Mn +7 , ставим коэффициентом перед восстановителем, а 2 электрона, отдаваемых восстановителем S +4 коэффициентом перед окислителем:
4) Уравнять количества атомов элементов, не изменяющих степень окисления
Соблюдаем последовательность: число атомов металлов, кислотных остатков, количество молекул среды (кислоты или щелочи). В последнюю очередь подсчитывают количество молекул образовавшейся воды.
Итак, в нашем случае число атомов металлов в правой и левой частях совпадают.
По числу кислотных остатков в правой части уравнения найдем коэффициент для кислоты.
В результате реакции образуется 8 кислотных остатков SO4 2- , из которых 5 – за счет превращения 5SO3 2- → 5SO4 2- , а 3 – за счет молекул серной кислоты 8SO4 2- — 5SO4 2- = 3SO4 2- .
Таким образом, серной кислоты надо взять 3 молекулы:
Аналогично, находим коэффициент для воды по числу ионов водорода, во взятом количестве кислоты
6H + + 3O -2 = 3H2O
Окончательный вид уравнения следующий:
Признаком того, что коэффициенты расставлены правильно является равное количество атомов каждого из элементов в обеих частях уравнения.
Видео:ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

Ионно-электронный метод (метод полуреакций)
Реакции окисления-восстановления, также как и реакции обмена, в растворах электролитов происходят с участием ионов. Именно поэтому ионно-молекулярные уравнения ОВР более наглядно отражают сущность реакций окисления-восстановления.
При написании ионно-молекулярных уравнений, сильные электролиты записывают в виде ионов, а слабые электролиты, осадки и газы записывают в виде молекул (в недиссоциированном виде).
При написании полуреакций в ионной схеме указывают частицы, подвергающиеся изменению их степеней окисления, а также характеризующие среду, частицы:
H + — кислая среда, OH — — щелочная среда и H2O – нейтральная среда.
Пример 1.
Рассмотрим пример составления уравнения реакции между сульфитом натрия и перманганатом калия в кислой среде.
1) Составить схему реакции:
Записать исходные вещества и продукты реакции:
2) Записать уравнение в ионном виде
В уравнении сократим те ионы, которые не принимают участие в процессе окисления-восстановления:
SO3 2- + MnO4 — + 2H + = Mn 2+ + SO4 2- + H2O
3) Определить окислитель и восстановитель и составить полуреакции процессов восстановления и окисления.
В приведенной реакции окислитель — MnO4 — принимает 5 электронов восстанавливаясь в кислой среде до Mn 2+ . При этом освобождается кислород, входящий в состав MnO4 — , который, соединяясь с H + образует воду:
MnO4 — + 8H + + 5e — = Mn 2+ + 4H2O
Восстановитель SO3 2- — окисляется до SO4 2- , отдав 2 электрона. Как видно образовавшийся ион SO4 2- содержит больше кислорода, чем исходный SO3 2- . Недостаток кислорода восполняется за счет молекул воды и в результате этого происходит выделение 2H + :
SO3 2- + H2O — 2e — = SO4 2- + 2H +
4) Найти коэффициенты для окислителя и восстановителя
Необходимо учесть, что окислитель присоединяет столько электронов, сколько отдает восстановитель в процессе окисления-восстановления:
MnO4 — + 8H + + 5e — = Mn 2+ + 4H2O |2 окислитель, процесс восстановления
SO3 2- + H2O — 2e — = SO4 2- + 2H + |5 восстановитель, процесс окисления
5) Просуммировать обе полуреакции
Предварительно умножая на найденные коэффициенты, получаем:
2MnO4 — + 16H + + 5SO3 2- + 5H2O = 2Mn 2+ + 8H2O + 5SO4 2- + 10H +
Сократив подобные члены, находим ионное уравнение:
2MnO4 — + 5SO3 2- + 6H + = 2Mn 2+ + 5SO4 2- + 3H2O
6) Записать молекулярное уравнение
Молекулярное уравнение имеет следующий вид:
Пример 2.
Далее рассмотрим пример составления уравнения реакции между сульфитом натрия и перманганатом калия в нейтральной среде.
В ионном виде уравнение принимает вид:
Также, как и предыдущем примере, окислителем является MnO4 — , а восстановителем SO3 2- .
В нейтральной и слабощелочной среде MnO4 — принимает 3 электрона и восстанавливается до MnО2. SO3 2- — окисляется до SO4 2- , отдав 2 электрона.
Полуреакции имеют следующий вид:
MnO4 — + 2H2O + 3e — = MnО2 + 4OH — |2 окислитель, процесс восстановления
SO3 2- + 2OH — — 2e — = SO4 2- + H2O |3 восстановитель, процесс окисления
Запишем ионное и молекулярное уравнения, учитывая коэффициенты при окислителе и восстановителе:
Пример 3.
Составление уравнения реакции между сульфитом натрия и перманганатом калия в щелочной среде.
В ионном виде уравнение принимает вид:
В щелочной среде окислитель MnO4 — принимает 1 электрон и восстанавливается до MnО4 2- . Восстановитель SO3 2- — окисляется до SO4 2- , отдав 2 электрона.
Полуреакции имеют следующий вид:
MnO4 — + e — = MnО2 |2 окислитель, процесс восстановления
SO3 2- + 2OH — — 2e — = SO4 2- + H2O |1 восстановитель, процесс окисления
Запишем ионное и молекулярное уравнения, учитывая коэффициенты при окислителе и восстановителе:
Необходимо отметить, что не всегда при наличии окислителя и восстановителя, возможно самопроизвольное протекание ОВР. Поэтому для количественной характеристики силы окислителя и восстановителя и для определения направления реакции пользуются значениями окислительно-восстановительных потенциалов.
Еще больше примеров составления окислительно-восстановительных реакций приведены в разделе Задачи к разделу Окислительно-восстановительные реакции. Также в разделе тест Окислительно-восстановительные реакции
Видео:Составление ур-й окислительно-восст. реакций методом ионно-электронного баланса. 1ч. 10 класс.Скачать

Please wait.
Видео:ЭТОТ метод поможет на уроках ХИМИИ / Химия 9 классСкачать

We are checking your browser. gomolog.ru
Видео:Окислительно-восстановительные реакции. Метод электронно-ионного баланса.Скачать

Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
Видео:Учимся составлять электронный баланс/овр/8классСкачать

What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6fee47d6ade49702 • Your IP : 178.45.155.83 • Performance & security by Cloudflare
Видео:Окислительно-восстановительные реакции. Электронный балансСкачать

Составление уравнений ОВР методом электронного баланса
материал по химии по теме
Составления ОВР методом электронного баланса. Тест на ОВР.
Видео:Метод электронного баланса. Окислительно-восстановительные реакции. 1 часть. 11 класс.Скачать
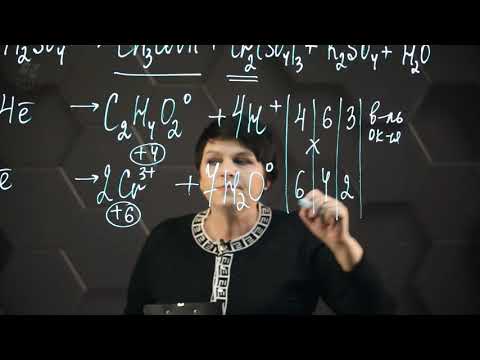
Скачать:
| Вложение | Размер |
|---|---|
| okislitelno-vosstanovitelnye_reaktsii.doc | 167.5 КБ |
Видео:Химия, 9 класс, тема "Окислительно-восстановительные реакции" (учитель Швецова Елена Евгеньевна)Скачать

Предварительный просмотр:
Окислительно-восстановительные реакции – это реакции, протекающие с изменением степеней окисления атомов элементов, входящих в состав молекул реагирующих веществ:
2KClO 3 2KCl + 3O 2 .
Напомним, что степень окисления – это условный заряд атома в молекуле, возникающий исходя из предположения, что электроны не смещены, а полностью отданы атому более электроотрицательного элемента.
Наиболее электроотрицательные элементы в соединении имеют отрицательные степени окисления, а атомы элементов с меньшей электроотрицательностью – положительные.
Степень окисления – формальное понятие; в ряде случаев значение степени окисления элемента не совпадает с его валентностью.
Для нахождения степени окисления атомов элементов, входящих в состав реагирующих веществ, следует иметь в виду следующие правила:
1. Степень окисления атомов элементов в молекулах простых веществ равна нулю.
2. Степень окисления атомов водорода в соединениях обычно равна +1.
Исключения: в гидридах (соединениях водорода с металлами) cтепень окисления атомов водорода равна –1.
3. Степень окисления атомов кислорода в соединениях обычно равна –2.
степень окисления кислорода во фториде кислорода (OF 2 ) равна +2.
степень окисления кислорода в пероксидах (Н 2 О 2 , Na 2 O 2 ), содержащих группу –O–O–, равна –1.
4. Степень окисления металлов в соединениях обычно положительная величина.
5. Степень окисления неметаллов может быть и отрицательной, и положительной.
6. Сумма cтепеней окисления всех атомов в молекуле равна нулю.
Окислительно-восстановительные реакции представляют собой два взаимосвязанных процесса – процесса окисления и процесса восстановления.
Процесс окисления – это процесс отдачи электронов атомом, молекулой или ионом; при этом степень окисления увеличивается, а вещество является восстановителем:
– 2ē 2H + процесс окисления,
Fe +2 – ē Fe +3 процесс окисления,
2J – – 2ē процесс окисления.
Процесс восстановления – это процесс присоединения электронов, при этом степень окисления уменьшается, а вещество является окислителем:
+ 4ē 2O –2 процесс восстановления,
Mn +7 + 5ē Mn +2 процесс восстановления,
Cu +2 +2ē Cu 0 процесс восстановления.
Окислитель – вещество, которое принимает электроны и при этом восстанавливается (степень окисления элемента понижается).
Восстановитель – вещество, которое отдает электроны и при этом окисляется (степень окисления элемента понижается).
Сделать обоснованное заключение о характере поведения вещества в конкретных окислительно-восстановительных реакциях можно на основании значения окислительно-восстановительного потенциала, который рассчитывается по величине стандартного окислительно-восстановительного потенциала. Однако, в ряде случаев, можно, не прибегая к расчетам, а зная общие закономерности, определить, какое вещество будет являться окислителем, а какое — восстановителем, и сделать заключение о характере протекания окислительно — восстановительной реакции.
Типичными восстановителями являются:
некоторые простые вещества:
металлы: например, Na, Mg, Zn, Al, Fe,
неметаллы: например, H 2 , C, S;
некоторые сложные вещества: например, сероводород (H 2 S) и сульфиды (Na 2 S), сульфиты (Na 2 SO 3 ), оксид углерода (II) (CO), галогеноводороды (HJ, HBr, HCI) и соли галогеноводородных кислот (KI, NaBr), аммиак (NH 3 );
катионы металлов в низших степенях окисления: например, SnCl 2 , FeCl 2 , MnSO 4 , Cr 2 (SO 4 ) 3 ;
катод при электролизе.
Типичными окислителями являются:
некоторые простые вещества – неметаллы: например,галогены (F 2 , CI 2 , Br 2 , I 2 ), халькогены (О 2 , О 3 , S);
некоторые сложные вещества: например, азотная кислота (HNO 3 ),серная кислота (H 2 SO 4 конц. ), прерманганат калия (K 2 MnO 4 ), бихромат калия (K 2 Cr 2 O 7 ), хромат калия (K 2 CrO 4 ), оксид марганца (IV) (MnO 2 ), оксид свинца (IV) (PbO 2 ), хлорат калия (KCIO 3 ), пероксид водорода (H 2 O 2 );
анод при электролизе.
При составлении уравнений окислительно-восстановительных реакций следует иметь в виду, что число электронов, отданных восстановителем, равно числу электронов, принятых окислителем.
Существуют два метода составления уравнений окислительно-восстановительных реакций – метод электронного баланса и электронно-ионный метод (метод полуреакций) .
При составлении уравнений окислительно-восстановительных реакций методом электронного баланса следует придерживаться определенного порядка действий. Рассмотрим порядок составления уравнений этим методом на примере реакции между перманганатом калия и сульфитом натрия в кислой среде.
- Записываем схему реакции (указываем реагенты и продукты реакции):
KMnO 4 + Na 2 SO 3 + H 2 SO 4 → MnSO 4 + Na 2 SO 4 + K 2 SO 4 + H 2 O.
- Определяем степени окисления у атомов элементов, изменяющих ее величину:
KMnO 4 + Na 2 SO 3 + H 2 SO 4 → MnSO 4 + Na 2 SO 4 + K 2 SO 4 + H 2 O.
3) Составляем схему электронного баланса. Для этого записываем химические знаки элементов, атомы которых изменяют степень окисления, и определяем, сколько электронов отдают или присоединяют соответствующие атомы или ионы.
Указываем процессы окисления и восстановления, окислитель и восстановитель.
Уравниваем количество отданных и принятых электронов и, таким образом, определяем коэффициенты при восстановителе и окислителе (в данном случае они соответственно равны 5 и 2):
5 S +4 – 2 e- → S +6 процесс окисления, восстановитель
2 Mn +7 + 5 e- → Mn +2 процесс восстановления, окислитель.
4) Далее остальные элементы уравниваем обычным путем и заменяем стрелку в схеме на знак равенства в уравнении реакции:
2KMnO 4 +5Na 2 SO 3 + 8H 2 SO 4 = 2MnSO 4 + 5Na 2 SO 4 + K 2 SO 4 + 8H 2 O.
5) Если водород и кислород не меняет своих степеней окисления, то их количество подсчитывают в последнюю очередь и добавляют нужное количество молекул воды в левую или правую часть уравнения.
Окислительно-восстановительные реакции подразделяются на три типа: межмолекулярные, внутримолекулярные и реакции самоокисления – самовосстановления (диспропорционирования).
Реакциями межмолекулярного окисления – восстановления называются окислительно-восстановительные реакции, окислитель и восстановитель в которых представлены молекулами разных веществ .
2Al + Fe 2 O 3 = 2Fe + Al 2 O 3 ,
Al 0 – 3e – → Al +3 окисление, восстановитель,
Fe +3 +3e – → Fe 0 восстановление, окислитель.
В этой реакции восстановитель (Al) и окислитель (Fe +3 ) входят в состав различных молекул.
Реакциями внутримолекулярного окисления – восстановления называются реакции, в которых окислитель и восстановитель входят в состав одной молекулы (и представлены либо разными элементами, либо одним элементом, но с разными степенями окисления):
2 KClO 3 = KCl + 3O 2
2 CI +5 + 6e – → CI –1 восстановление, окислитель
3 2O –2 – 4е – → окисление, восстановитель
В этой реакции восстановитель (O –2 ) и окислитель (CI +5 ) входят в состав одной молекулы и представлены различными элементами.
В реакции термического разложения нитрита аммония меняют свои степени окисления атомы одного и того же химического элемента – азота, входящие в состав одной молекулы:
NH 4 NO 2 = N 2 + 2H 2 O
N –3 – 3e – → N 0 восстановление, окислитель
N +3 + 3e – → N 0 окисление, восстановитель.
Реакции подобного типа часто называют реакциями контрпропорционирования .
Реакции самоокисления – самовосстановления (диспропорционирования) – это реакции, при протекании которых один и тот же элемент с одной и той же степенью окисления сам и повышает, и понижает свою степень окисления.
Cl 2 + H 2 O = HCI + HCIO
CI 0 + 1e – → CI –1 восстановление, окислитель
CI 0 – 1e – → CI +1 окисление, восстановитель.
Реакции диспропорционирования возможны, когда в исходном веществе элемент имеет промежуточную степень окисления.
Свойства простых веществ могут прогнозироваться по положению атомов их элементов в периодической системе элементов Д.И. Менделеева. Так, все металлы в окислительно-восстановительных реакциях будут являться восстановителями. Катионы металлов могут быть и окислителями. Неметаллы в виде простых веществ могут быть как окислителями, так и восстановителями (исключая фтор и инертные газы).
Окислительная способность неметаллов усиливается в периоде слева направо, а в группе – снизу вверх.
Восстановительные способности, наоборот, уменьшаются слева направо и снизу вверх как для металлов, так и для неметаллов.
Если окислительно-восстановительная реакция металлов происходит в растворе, то для определения восстановительной способности используют ряд стандартных электродных потенциалов (ряд активности металлов). В этом ряду металлы расположены по мере убывания восстановительной способности их атомов и возрастания окислительной способности их катионов ( см. табл. 9 приложения ).
Наиболее активные металлы, стоящие в ряду стандартных электродных потенциалов до магния, могут реагировать с водой, вытесняя из нее водород.
Ca + 2H 2 O = Ca(OH) 2 + H 2 ↑
При взаимодействии металлов с растворами солей следует иметь в виду, что каждый более активный металл (не взаимодействующий с водой) способен вытеснять (восстанавливать) стоящий за ним металл из раствора его соли .
Так, атомы железа могут восстановить катионы меди из раствора сульфата меди (CuSO 4 ):
Fe + CuSO 4 = Cu + FeSO 4
Fe 0 – 2e – = Fe +2 окисление, восстановитель
Cu +2 + 2e – = Cu 0 восстановление, окислитель.
В этой реакции железо (Fe) расположено в ряду активности до меди (Cu) и является более активным восстановителем.
Реакция, например, серебра с раствором хлорида цинка будет невозможна, так как серебро расположено в ряду стандартных электродных потенциалов правее цинка и является менее активным восстановителем.
Все металлы, которые стоят в ряду активности до водорода, могут вытеснять водород из растворов обычных кислот, то есть восстанавливать его:
Zn + 2HCl = ZnCI 2 + H 2 ↑
Zn 0 – 2e – = Zn +2 окисление, восстановитель
2H + + 2e – → восстановление, окислитель.
Металлы, которые стоят в ряду активности после водорода, не будут восстанавливать водород из растворов обычных кислот.
Чтобы определить, может ли быть окислителем или восстановителем сложное вещество, необходимо найти степень окисления элементов, его составляющих. Элементы, находящиеся в высшей степени окисления , могут ее только понижать, принимая электроны. Следовательно, вещества, молекулы которых содержат атомы элементов в высшей степени окисления, будут только окислителями .
Например, HNO 3 , KMnO 4 , H 2 SO 4 в окислительно-восстановитель-ных реакциях будут выполнять функцию только окислителя. Степени окисления азота (N +5 ), марганца (Mn +7 ) и серы (S +6 ) в этих соединениях имеют максимальные значения (совпадают с номером группы данного элемента).
Если элементы в соединениях имеет низшую степень окисления, то они могут ее только повышать, отдавая электроны. При этом такие вещества, содержащие элементы в низшей степени окисления, будут выполнять функцию только восстановителя .
Например, аммиак, сероводород и хлороводород (NH 3 , H 2 S, НCI) будут только восстановителями, так как степени окисления азота (N –3 ), серы (S –2 ) и хлора (Cl –1 ) являются для этих элементов низшими.
Вещества, в состав которых входят элементы, имеющие промежуточные степени окисления, могут быть как окислителями, так и восстановителями , в зависимости от конкретной реакции. Таким образом, они могут проявлять окислительно-восстановительную двойственность.
К таким веществам относятся, например, пероксид водорода (H 2 O 2 ), водный раствор оксида серы (IV) (сернистая кислота), сульфиты и др. Подобные вещества, в зависимости от условий среды и наличия более сильных окислителей (восстановителей) могут проявлять в одних случаях окислительные свойства, а в других — восстановительные.
Как известно, многие элементы имеют переменную степень окисления, входя в состав различных соединений. Например, сера в соединениях H 2 S, H 2 SO 3 , H 2 SО 4 и сера S в свободном состоянии имеет соответственно степени окисления –2, +4, +6 и 0. Сера относится к элементам р -электронного семейства, ее валентные электроны расположены на последнем s — и р -подуровнях (. 3 s 3 р ). У атома серы со степенью окисления – 2 валентные подуровни полностью укомплектованы. Поэтому, атом серы с минимальной степенью окисления (–2) может только отдавать электроны (окисляться) и быть только восстановителем. Атом серы со степенью окисления +6 потерял все свои валентные электроны и в данном состоянии может только принимать электроны (восстанавливаться). Поэтому атом серы с максимальной степенью окисления (+6) может быть только окислителем.
Атомы серы с промежуточными степенями окисления (0, +4) могут и терять и присоединять электроны, то есть быть как восстановителями, так и окислителями.
Аналогичные рассуждения правомочны при рассмотрении окислительно-восстановительных свойств атомов других элементов .
На характер протекания окислительно-восстановительной реакции влияет концентрация веществ, среда раствора и сила окислителя и восстановителя. Так, концентрированная и разбавленная азотная кислота по-разному реагирует с активными и малоактивными металлами. Глубина восстановления азота (N +5 ) азотной кислоты (окислителя) будет определяться активностью металла (восстановителя) и концентрацией (разбавлением) кислоты.
4HNO 3(конц.) + Cu = Cu(NO 3 ) 2 + 2NO 2 + 2H 2 O,
8HNO 3(разб.) + 3Cu = 3Cu(NO 3 ) 2 + 2NO + 4H 2 O,
10HNO 3(конц.) + 4Мg = 4Mg(NO 3 ) 2 + N 2 O + 5H 2 O,
10HNO 3(c. разб.) + 4Мg = 4Mg(NO 3 ) 2 + NH 4 NO 3 + 3H 2 O.
Существенное влияние на протекание окислительно-восстановительных процессов оказывает реакция среды.
Если в качестве окислителя используют перманганат калия (KMnO 4 ), то в зависимости от реакции среды раствора, Mn +7 будет восстанавливаться по-разному:
в кислой среде (до Mn +2 ) продуктом восстановления будет соль, например, MnSO 4 ,
в нейтральной среде (до Mn +4 ) продуктом восстановления будет MnO 2 или MnO(OH) 2 ,
в щелочной среде (до Mn +6 ) продуктом восстановления будет манганат, например, К 2 MnO 4 .
Например, при восстановлении раствора перманганата калия сульфитом натрия, в зависимости от реакции среды, будут получаться соответствующие продукты:
2KMnO 4 + 5Na 2 SO 3 + 3H 2 SO 4 = 5Na 2 SO 4 + 2MnSO 4 + K 2 SO 4 +H 2 O
2KMnO 4 + 3Na 2 SО 3 + H 2 O = 3Na 2 SO 4 + 2MnO 2 + 2KOH
2KMnO 4 + Na 2 SO 3 + 2NaOH = Na 2 SO 4 + Na 2 MnO 4 + K 2 MnO 4 + H 2 O.
Температура системы также влияет на ход окислительно-восстановительной реакции. Так, продукты взаимодействия хлора с раствором щелочи будут различны в зависимости от температурных условий.
При взаимодействии хлора с холодным раствором щелочи реакция идет с образованием хлорида и гипохлорита:
Cl 2 + KOH → KCI + KCIO + H 2 O
CI 0 + 1e – → CI –1 восстановление, окислитель
CI 0 – 1e – → CI +1 окисление, восстановитель.
Если взять горячий концентрированный раствор КОН , то в результате взаимодействия с хлором получим хлорид и хлорат:
3CI 2 + 6KOH → 5KCI + KCIO 3 + 3H 2 O
5 │ CI 0 + 1e – → CI –1 восстановление, окислитель
1 │ CI 0 – 5e – → CI +5 окисление, восстановитель.
📺 Видео
Составление ур-й окислительно-восст. реакций методом ионно-электронного баланса. 3ч. 10 класс.Скачать

ОВР часть 2. Окислительно-восстановительные реакции. Электродный потенциал.Скачать

Метод электронно-ионного балансаСкачать

Расстановка коэффициентов методом электронного баланса | Химия TutorOnlineСкачать

Окислительно-восстановительные реакции. 3 часть. 9 класс.Скачать

Метод электронно-ионного баланса (полуреакций). Органическая химия.Скачать

Расстановка коэффициентов в окислительно-восстановительных реакцияхСкачать

140. Расставляем коэффициенты методом электронного балансаСкачать

89. Как расставить коэффициенты реакции методом электронного баланса (закрепление)Скачать

Электронные эффекты заместителейСкачать

Электролиз. 10 класс.Скачать
