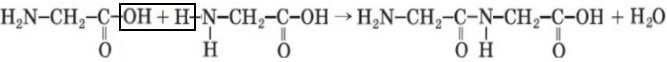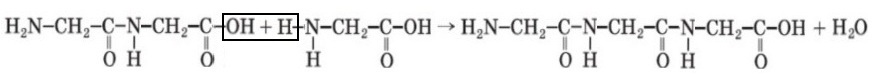Вопрос по химии:
Напишите уравнение реакции доказывающие амфотерный характер аминоуксусной кислоты
Трудности с пониманием предмета? Готовишься к экзаменам, ОГЭ или ЕГЭ?
Воспользуйся формой подбора репетитора и занимайся онлайн. Пробный урок — бесплатно!
- Как написать хороший ответ?
- Докажите что аминоуксусная кислота амфотерное соединение напишите уравнения соответствующих реакций
- Аминоуксусная кислота взаимодействует с
- Калькулятор молярной массы, молекулярной массы и строения элементов
- Вычисление молярной массы
- Аминоуксусная кислота взаимодействует с
- Вычисление молекулярной массы (молекулярная масса)
- Определение молекулярной массы, молекулярный вес, молекулярная масса и молярная масса
- Аминоуксусная кислота взаимодействует ли с этанолом
- Аминокислоты, белки
- Аминоуксусная кислота: получение и применение
- Химические свойства аминокислот.
- Аминокислоты. Свойства аминокислот.
- Свойства аминокислот
- Химические свойства аминокислот
- Физические свойства аминокислот
- 🔥 Видео
Ответы и объяснения 1
Аминоуксусная кислота имеет амфотерный характер, так как содержит карбоксильную и Амино- группы, за счёт этого она может взаимодействовать как с щелочами (как кислоты), так и с кислотами (как основания, коими являются амины). Это доказывается следующими реакциями: 1) NH2-CH2-COOH + HCl —> [NH3CH2COOH]Cl (HCl — соляная кислота) 2) NH2-CH2-COOH + NaOH —> NH2-CH2-COONa + H2O (NaOH — щелочь (основание))
Знаете ответ? Поделитесь им!
Как написать хороший ответ?
Чтобы добавить хороший ответ необходимо:
- Отвечать достоверно на те вопросы, на которые знаете правильный ответ;
- Писать подробно, чтобы ответ был исчерпывающий и не побуждал на дополнительные вопросы к нему;
- Писать без грамматических, орфографических и пунктуационных ошибок.
Этого делать не стоит:
- Копировать ответы со сторонних ресурсов. Хорошо ценятся уникальные и личные объяснения;
- Отвечать не по сути: «Подумай сам(а)», «Легкотня», «Не знаю» и так далее;
- Использовать мат — это неуважительно по отношению к пользователям;
- Писать в ВЕРХНЕМ РЕГИСТРЕ.
Есть сомнения?
Не нашли подходящего ответа на вопрос или ответ отсутствует? Воспользуйтесь поиском по сайту, чтобы найти все ответы на похожие вопросы в разделе Химия.
Трудности с домашними заданиями? Не стесняйтесь попросить о помощи — смело задавайте вопросы!
Химия — одна из важнейших и обширных областей естествознания, наука о веществах, их составе и строении, их свойствах, зависящих от состава и строения, их превращениях, ведущих к изменению состава — химических реакциях, а также о законах и закономерностях, которым эти превращения подчиняются.
Видео:КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать

Докажите что аминоуксусная кислота амфотерное соединение напишите уравнения соответствующих реакций
FOR-DLE.ru — Всё для твоего DLE 😉
Привет, я Стас ! Я занимаюсь так называемой «вёрсткой» шаблонов под DataLife Engine.
На своем сайте я выкладываю уникальные, адаптивные, и качественные шаблоны. Все шаблоны проверяются на всех самых популярных браузерх.
Раньше я занимался простой вёрсткой одностраничных, новостных и т.п. шаблонов на HTML, Bootstrap. Однажды увидев сайты на DLE решил склеить пару шаблонов и выложить их в интернет. В итоге эта парочка шаблонов набрала неплохую популярность и хорошие отзывы, и я решил создать отдельный проект.
Кроме шаблонов я так же буду выкладывать полезную информацию для DataLife Engin и «статейки» для веб мастеров. Так же данный проект будет очень полезен для новичков и для тех, кто хочет правильно содержать свой сайт на DataLife Engine. Надеюсь моя работа вам понравится и вы поддержите этот проект. Как легко и удобно следить за обновлениями на сайте?
Достаточно просто зарегистрироваться на сайте, и уведомления о каждой новой публикации будут приходить на вашу электронную почту!
Задание 1
Какие оксиды и гидроксиды называются амфотерными?
Оксиды и гидроксиды, проявляющие свойства кислоты или основания в зависимости от природы второго реагента, называются амфотерными.
Почему их так называют? Амфотерность (от др. греч. amfoteroi – двоякий, двойственный) ― это способность веществ проявлять двойственные химические свойства (основных и кислотных оксидов, оснований и кислот).
Задание 2
Приведите примеры амфотерных оксидов и гидроксидов.
Оксид цинка ZnO и гидроксид Zn(OH)2, оксид алюминия Аl2O3 и гидроксид алюминия Аl(ОН)3, оксид бериллия ВеО и гидроксид бериллия Ве(ОН)2, оксид хрома (III) Сг2O3 и гидроксид хрома (III) Сг(ОН)3
Подтвердите амфотерные свойства одной из пар молекулярными и ионными уравнениями химических реакций.
ZnO + 2NaOH + H2O = Na2[Zn(OH)4]
ZnO + 2Na + + 2OH — + H2O = 2Na + + [Zn(OH)4] —
ZnO + 2OH — + H2O = [Zn(OH)4] —
ZnO + 2HCl = ZnCl2 + H2O
ZnO + 2H + + 2Cl — = Zn 2+ + 2Cl — + H2O
ZnO + 2H + = Zn 2+ + H2O
Задание 3 Какие органические соединения имеют двойственный кислотно-основный характер? Аминокислоты
Какие функциональные группы его определяют? Аминокислоты могут проявлять как кислотные свойства за счет карбоксильной группы —COOH, так и основные свойства за счет аминогруппы —NH2.
Задание 4 Почему при добавлении нескольких капель раствора хлорида алюминия к избытку раствора гидроксида натрия не выпадает осадок гидроксида алюминия? Потому, что образующийся осадок амфотерного гидроксида алюминия будет вступать еще в реакцию с избыточным гидроксидом натрия с образованием растворимой комплексной соли.
Каким должен быть порядок добавления реагентов для получения Al(OH)3 из указанных реагентов?
Щёлочь следует добавлять небольшими порциями, поскольку в избытке реагента образующийся осадок амфотерного гидроксида растворится.
Запишите молекулярные и ионные уравнения химических реакций.
3NaOH (изб.) + AlCl3 = 3NaСl + Al(OH)3↓
3Na + + 3OH — + Al 3+ + 3Cl — = 3Na + + 3Cl — + Al(OH)3↓
Al 3+ + 3OH — = Al(OH)3↓
Задание 5 Простейшим представителем аминокислот является глицин H2N―CH2―COOH (аминоуксусная кислота). Запишите уравнения реакций этой кислоты с хлороводородом и гидроксидом натрия.
H2N―CH2―COOH + HCl ⟶ [H2N―CH2―COOH] + Cl —
H2N―CH2―COOH + NaOH ⟶ H2N―CH2―COONa + H2O
Задание 6 Запишите уравнения реакций получения ди- и трипептидов из глицина.
Задание 7 Синтетическое волокно капрон может быть получено реакцией поликонденсации аминокапроновой кислоты H2N―CH2―(CH2)4―COOH. Запишите уравнение реакции.
nH2N―CH2―(CH2)4―COOH ⟶ (―NH―CH2―(CH2)4―CO―)n + nH2O
Видео:Химия 8 класс (Урок 23 - Амфотерность. Амфотерные оксиды и гидроксиды.)Скачать

Аминоуксусная кислота взаимодействует с
Видео:Это Самый Простой Урок Химии. Химия с нуля — АмфотерностьСкачать

Калькулятор молярной массы, молекулярной массы и строения элементов
| Молярная масса of CH2NH2COOH is 75,0666 g/mol Формула в системе Хилл C2H5NO2Элементный состав CH2NH2COOH: |
СимволЭлементАтомная массаАтомыМассовая доля
| C | Углерод | 12,0107 | 2 | 32,0001 % |
| H | Водород | 1,00794 | 5 | 6,7136 % |
| N | Азот | 14,0067 | 1 | 18,6590 % |
| O | Кислород | 15,9994 | 2 | 42,6272 % |
Прямая ссылка на эту страницу
Расскажите, пожалуйста, об этом бесплатном химическом портале вашим друзьям.
Вычисление молярной массы
Для расчета молярной массы химического соединения введите его формулу и нажмите кнопку ‘Рассчитать!’.
В химической формуле, вы можете использовать:
- Любой химический элемент
- Функциональные группы:D, Ph, Me, Et, Bu, AcAc, For, Ts, Tos, Bz, TMS, tBu, Bzl, Bn, Dmg
- круглые () и квадратные [] скобки.
- Общие составные имена.
Примеры расчета молярной массы: NaCl, Ca(OH)2, K4[Fe(CN)6], CuSO4*5H2O, water, nitric acid, potassium permanganate, ethanol, fructose.
Видео:4. КАК АМФОТЕРНЫЕ СОЕДИНЕНИЯ (ОКСИДЫ/ГИДРОКСИДЫ) РЕАГИРУЮТ С ЩЕЛОЧАМИ/ Нужно знать/ ЕГЭ химия 2020Скачать

Аминоуксусная кислота взаимодействует с
Вычисление молекулярной массы (молекулярная масса)
Для того, чтобы рассчитать молекулярную массу химического соединения, введите её формулу, указав его количество массы изотопа после каждого элемента в квадратных скобках.
Примеры молекулярные вычисления веса: C[14]O[16]2, S[34]O[16]2.
Определение молекулярной массы, молекулярный вес, молекулярная масса и молярная масса
- Молекулярная масса ( молекулярной массой ) это масса одной молекулы вещества, выражающаяся в атомных единицах массы (и).
(1 и равна 1/12 массы одного атома углерода-12)
- Молярная масса ( молекулярной массой ) является масса одного моля вещества и выражается в г / моль.
Массы атомов и изотопов с NIST статью .
Оставьте нам свой отзыв о своем опыте с калькулятором молекулярной массы.
также: молекулярные массы аминокислот
© 2018 webqc.org Все права защищены
Аминокислоты – это гетерофункциональные органические соединения, вступающие в реакции, характерные для карбоксильных групп, аминогрупп, и проявляющие ряд специфических биохимических свойств.
Как амфолиты a-аминокислоты образуют соли при взаимодействии с кислотами и основаниями.
 |

аланин гидрохлорид аланина
2.Реакция декарбоксилирования a-аминокислоты – это ферментативный процесс образования биогенных аминов из соответствующих a-аминокислот.
Декарбоксилирование происходит с участием фермента – декарбоксилазы и кофермента (KoF) – пиридоксальфосфата.
 |

При декарбоксилировании глутаминовой α-аминокислоты образуется ГАМК (γ-аминомасляная кислота), которая является медиатором торможения нервной системы.
3. Реакция дезаминирования – эта реакция является процессом удаления аминогруппы путем окислительного, восстановительного, гидролитического или внутримолекулярного дезаминирования.
В организме преобладает путь окислительного дезаминирования с участием ферментов – дегидрогеназ и кофермента – NAD+.
На первой стадии процесса осуществляется дегидрирование a-звена с образованием a-иминокислоты. На второй стадии происходит неферментативный гидролиз a-аминокислоты, приводящий к образованию a-кетокислоты и сопровождающийся выделением аммиака, включающегося в цикл образования мочевины.
Общая схема процесса окислительного дезаминирования:
 |
Например, реакция окислительного дезаминирования аланина:
С помощью подобных процессов снижается уровень избыточных АК в клетке.
Трансаминированиеили переаминирование a-аминокислоты – это путь синтеза необходимых АК из a-кетокислот. При этом донором аминогруппы является a-аминокислота, находящаяся в избытке, а акцептором аминогруппы – a-кетокислота (ПВК, ЩУК, a-кетомасляная кислота). Процесс происходит с участием фермента – трансаминазы и кофермента – пиридоксальфосфата.
Например, процесс трансаминирования L-аланина и ЩУК:
Процесс переаминирования связывает обмен белков и углеводов в организме, он регулирует содержание a-аминокислот и синтез заменимых a-аминокислот.
Кроме этих реакций a-аминокислоты способны образовывать сложные эфиры, ацильные производные и вступать в реакции, которые не имеют аналогий в химии in vitro.
К таким процессам относятся гидроксилирование фенилаланина в тирозин.
При отсутствии необходимого фермента в организме накапливается фенилаланин, при его дезаминировании образуется токсичная кислота, накопление которой приводит к тяжелому заболеванию – фенилкетонурии.
Контрольные вопросы
1. Строение α-аминокислот, номенклатура, изомерия.
Классификация α-аминокислот по характеру бокового радикала, физико-химические характеристики боковой радикала. Классификация α-аминокислот по способности синтезироваться в организме.
3. Кислотно-основные свойства α-аминокислот.
Общие пути обмена α-аминокислот в организме. Реакции декарбоксилирования, трансаминирования, окислительного дезаминирования.
Видео:КИСЛОТЫ ХИМИЯ // Урок Химии 8 класс: Кислоты, Кислотный Остаток, Классы Неорганических СоединенийСкачать

Аминоуксусная кислота взаимодействует ли с этанолом
Напишите все возможные стереоизомеры треонина в проекционных формулах Фишера. Укажите конфигурацию каждого хирального центра. Какие структуры являются энантиомерами, а какие диастереомерами? Есть ли среди приведенных структур мезоформа?
Решение. Молекула треонина содержит два хиральных центра:
следовательно, число оптических изомеров равно 2n = 22 = 4.
I и II, III и IV — энантиомеры;
I и III, I и IV, II и III, II и IV — σ-диастереомеры.
Среди приведенных структур мезоформы нет, так как каждый стереоизомер имеет свой энантиомер.
Задание 2.
Приведите примеры α-аминокислот, входящих в состав белков, с гидрофобными и гидрофильными боковыми радикалами.
Решение.α-Аминокислоты с гидрофобными радикалами: глицин, аланин, валин, лейцин, изолейцин, метионин, фенилаланин, триптофан и пролин (иминокислота). Радикалы этих аминокислот воду не притягивают, а стремятся друг к другу или к другим гидрофобным молекулам.
α-Аминокислоты с гидрофильными радикалами:серин, треонин, тирозин, аспарагиновая кислота, глутаминовая кислота, цистеин и оксипролин (иминокислота). В состав радикалов этих аминокислот входят полярные функциональные группы, образующие водородные связи с водой.
В свою очередь, эти аминокислоты делят на две группы:
— неионогенные α-аминокислоты, не способные к ионизации.

— ионогенные α-аминокислоты, способные к ионизации в условиях организма.
К α-аминокислотам с отрицательно заряженными радикалами относятся тирозин, цистеин, аспарагиновая и глутаминовая кислоты.
Эти аминокислоты называют кислыми.
Например, при рН 7 фенольная гидроксильная группа тирозина ионизирована на 0,01%; тиольная группа цистеина — на 8%.
Полностью ионизированные формы аспарагиновой и глутаминовой кислот называют аспартатом и глутаматом:
К α-аминокислотам с положительно заряженными радикалами относятся лизин, аргинин и гистидин.
Эти аминокислоты называют оснóвными.
У лизина есть вторая аминогруппа, способная присоединять протон:
У аргинина положительный заряд приобретает гуанидиновая группа:

Задание 3.
Для аланина напишите уравнения реакций, иллюстрирующих его амфотерный характер.
Решение. Напишем формулу аланина – 2-аминопропановой кислоты
Как все аминокислоты, аланин за счет наличия карбоксильной группы обладает кислотными свойствами, а за счет аминогруппы проявляет основные свойства.
Реакция, иллюстрирующая кислотные свойства аланина, – это реакция взаимодействия со щелочью, с образованием натриевой соли аланина.
Реакция, доказывающая основные свойства аланина, – это реакция взаимодействия с соляной кислотой, с образованием соответствующей соли.
Задание 4.
Смесь глицина, аланина, лизина, аргинина, серина и глутаминовой кислоты разделяли методом электрофореза при рН 6.
Видео:ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Аминокислоты, белки
Вариант 1
1. Напишите уравнения реакций взаимодействия аминоуксусной кислоты с этанолом, гидроксидом кальция, соляной кислотой.
2.
Изобразите структурные формулы изомерных аминокислот C₃H₇O₂N и назовите эти вещества.
3. Что подразумевают под первичной, вторичной и третичной структурами белков? Какие связи соответствуют каждой структуре?
Вариант 2
Напишите уравнения реакций, с помощью которых можно из этанола и неорганических веществ получить глицин (аминоэтановую кислоту).
2. Сильнее или слабее проявляются кислотные свойства у аминокислот по сравнению с карбоновыми кислотами (муравьиной, уксусной)? Почему?
Аминокислоты слабее карбоновых кислот проявляют кислотность. Радикал с аминогруппой увеличивает электронную плотность на атоме кислорода сильнее, чем радикал без аминогруппы.
При увеличении электронной плотности связь между кислородом и протоном карбоксильной группы становится прочнее, а следовательно снижается кислотность.
Видео:Химия 9 класс (Урок№14 - Азот: свойства и применение. Аммиак. Физические и химические свойства.)Скачать

Аминоуксусная кислота: получение и применение
Что такое денатурация белков? В чем ее сущность и какие факторы ее вызывают?
Денатурация – это разрушение третичной и вторичной структуры белка с сохранением первичной структуры.
Она происходит под воздействием физических (температура, радиация) или химических (действие кислот, щелочей) факторов.
Вариант 3
1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: метан → А → уксусный альдегид → Б → В → аминоуксусная кислота.
Назовите вещества А, Б, и В.
2. Почему не все аминокислоты имеют нейтральную реакцию на индикатор в отличие от аминоуксусной кислоты? Ответ подтвердите конкретными примерами.
3.
К какому классу веществ принадлежат белки? Из атомов каких элементов состоят молекулы белков?
Белки (протеины, полипептиды) – высокомолекулярные органические вещества, состоящие из соединенных в цепочку пептидной связью аминокислот.
В состав любого белка входят углерод, водород, азот и кислород. Кроме того, часто в состав белков входит сера.
Вариант 4
1. Напишите уравнения реакций между: а) α-аминомасляной кислотой и гидроксидом натрия; б) аминоуксусной и соляной кислотой; в) β-аминопропионовой кислотой и метанолом.
2. Сильнее или слабее проявляются основные свойства у аминокислот по сравнению с метиламином?
Почему?
Метиламин является более сильным основанием, чем аминокислоты. Карбоксильная группа аминокислот обладает акцепторным эффектом и оттягивает на себя электронную плотность с атома азота аминогруппы, тем самым уменьшая ее способность отрывать протон. А метильная группа метиламина обладает донорным эффектом и увеличивает электронную плотность на атоме азота аминогруппы.
3.
Почему необходима белковая пища? Что происходит с белками пищи в организме человека?
Видео:ОКСИДЫ ХИМИЯ — Что такое Оксиды? Химические свойства Оксидов | Реакция ОксидовСкачать

Химические свойства аминокислот.
4NH2CH2COOH + 13O2 → 8CO2 + 10H2O + 2N2
2. Взаимодействие с водой:
NH2CH2COOH + H2O 
NH2CH2COOH + H2O 
(NH2CH2COOH 
Видео:8 класс. Химия. Амфотерные свойства гидроксида алюминия.Скачать

Аминокислоты. Свойства аминокислот.
кислотно-основные превращение можно представить в виде:
Аминокислоты — амфотерные органические вещества. В водных растворах большинства аминокислот среда слабокислотная.
Так как аминокислоты в водных растворах ведут себя как типичные амфотерные соединения, то в живых организмах они играют роль буферных веществ, поддерживающих определенную концентрацию ионов водорода.
Группа −СООН (карбоксильная группа) определяет кислотные свойства этих соединений. Реакции с растворами щелочей:
NH2CH2COOH + NaOH → NH2CH2COO−Na + H2O
4. Реагируют как кислоты со спиртами в присутствие газообразного HCl (реакция этерификация):
NH2CH2COOH + C2H5OH → NH2CH2COOC2H5 + H2O
Аминогруппа —NН2 определяет основные свойства аминокислот, так как способна присоединять к себе катион водорода по донорно-акцепторному механизму за счет наличия свободной электронной пары у атома азота. Реакции с растворами кислот
2NH2CH2COOH + H2SO4 → (NH3CH2COOH)2SO4
NH2−(CH2)5−COOH + H−NH−(CH2)5−COOH →H2N−(CH2)5−CO−NH−(CH2)5−COOH+H2O
аминокапроновая (6-аминогексановая) кислота димер (дипептид)
аминокапроновая кислота капрон
Группа −CO−NH− называется амидной группой (пептидная группа, связь (−C−N−) − пептидной связью, а образующиеся полимеры – полиамидами (полимеры α−аминокислот − полипептидами).
В зависимости от числа остатков аминокислот различают дипептиды, трипептиды, полипептиды.
К полипептидам относятся белки. При гидролизе белков (в кислотной среде или под действием ферментов) образуется смесь α−аминокислот.
Видео:Решение упражнений Амфотерные соединенияСкачать

Свойства аминокислот
Cвойства аминокислот можно разделить на две группы: химические и физические.
Видео:Амфотерные гидроксиды. Химия ОГЭ 2023 | TutorOnlineСкачать

Химические свойства аминокислот
В зависимости от соединений, аминокислоты могут проявлять различные свойства.
Аминокислоты как амфотерные соединения образуют соли и с кислотами, и со щелочами.
Как карбоновыекислоты аминокислоты образуют функциональные производные: соли, сложные эфиры, амиды.
Взаимодействие и свойства аминокислот с основаниями:
Образуются соли:
NH2-CH2-COOH + NaOH 
Натриевая соль + 2-аминоуксусной кислоты 
Взаимодействие со спиртами:
Аминокислоты могут реагировать со спиртами при наличии газообразного хлороводорода, превращаясь в сложный эфир.
Сложные эфиры аминокислот не имеют биполярной структуры и являются летучими соединениями.
NH2-CH2-COOH + CH3OH 
Метиловый эфир / 2-аминоуксусной кислоты /
Взаимодействие с аммиаком:
Образуются амиды:
NH2-CH(R)-COOH + H-NH2 = NH2-CH(R)-CONH2 + H2O
Взаимодействие аминокислот с сильными кислотами:
Получаем соли:
HOOC-CH2-NH2 + HCl → [HOOC-CH2-NH3]Cl (или HOOC-CH2-NH2*HCl↑)
Таковы основные химические свойства аминокислот.
Видео:ВСЕ СВОЙСТВА АМФОТЕРНЫХ ОКСИДОВ ДЛЯ ЕГЭ ПО ХИМИИ 2024! | Химический сериал, 2 выпускСкачать

Физические свойства аминокислот
Перечислим физические свойства аминокислот:
- Бесцветные
- Имеют кристаллическую форму
- Большинство аминокислот со сладким привкусом, но в зависимости от радикала (R) могут быть горькими или безвкусными
- Хорошо растворяются в воде, но плохо растворяются во многих органических растворителях
- Аминокислоты имеют свойство оптической активности
- Плавятся с разложением при температуре выше 200°C
- Нелетучие
- Водные растворы аминокислот в кислой и щелочной среде проводят электрический ток
🔥 Видео
50. Химические свойства амфотерных гидроксидовСкачать

Опыты по химии. Получение и исследование амфотерных свойств гидроксида алюминияСкачать

ОФИЦИАЛЬНЫЙ ПРОБНИК ОТ ФИПИ! РАЗБОР ВАРИАНТА №1 ЕГКР ПО ХИМИИ 2024 | Катя СтрогановаСкачать

Амфотерные свойства гидроксида диксоуранаСкачать

АМФОТЕРНЫЕ ГИДРОКСИДЫ на ЕГЭ - проводим химические опыты | 10 класс УмскулСкачать

Амфотерные оксиды и гидроксиды, химические свойства | ЕГЭ по химии 2024Скачать

8 класс, 22 апреля - Урок онлайн Химия: Амфотерные неорганические соединенияСкачать

ОКСИДЫ основные кислотные амфотерные как отличить | Оксиды химия 8 классСкачать