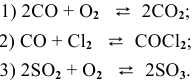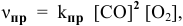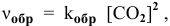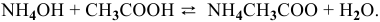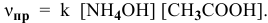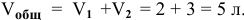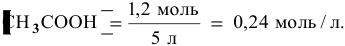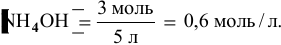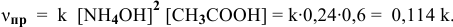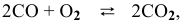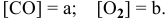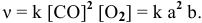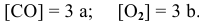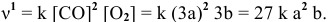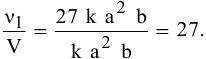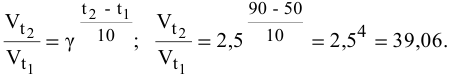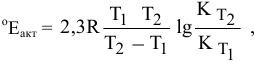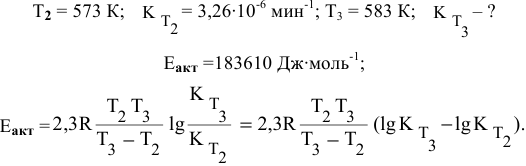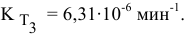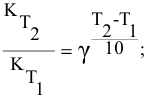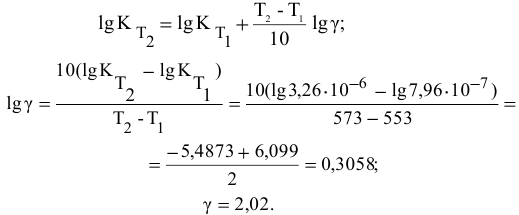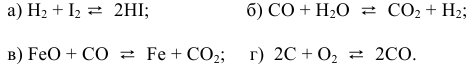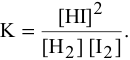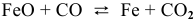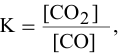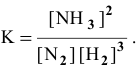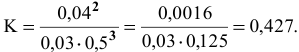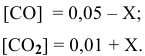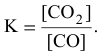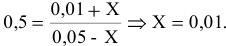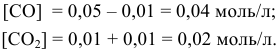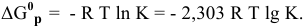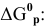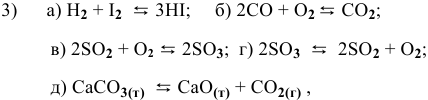- Определение скорости реакции при изменении концентрации вешеств
- Вычисление изменения скорости реакции при повышении температуры в системе
- Вычисление изменения скорости реакции при увеличении объема в газовой смеси
- Вычисление изменения скорости реакции при уменьшении давления в газовой смеси
- Вычисление изменения скорости реакции при увеличении давления
- Задачи с решениями на химическую кинетику и химическое равновесие
- Химическая кинетика и химическое равновесие
- Пример 59
- Задача 43
- Задача 44
- Задача 45
- Задача 46
- Задача 47
- Задача 48
- Задача 49
- Задача 50
- Задача 51
- 1)Напишите выражение для скорости реакции С + О2 = СО2 и определите, во сколько раз увеличится ее скорость при увеличении концентрации кислорода в 3 раза?
- Как будет влиять на состояние равновесия в следующих реакциях 1?
- Для следующей реакции написать уравнение скорости реакции и определить, как изменится скорость, если концентрацию первого вещества увеличить в 2 раза O2 + 2H2 = 2H2O?
- Написать выражение константы равновесия реакции :2H2 + С = CH4 дельтаH = — 74, 9 ДжВ каком направлении произойдет смещение равновесии этой реакцииа) при добавлении H2б) при повышении давленияв) при ох?
- Во сколько раз увеличивается скоростьреакции2CO + О2> 2СО2 при увеличении давления в 2 раза?
- Напишите выражение для константы равновесия гомогенной системы 2SO2 + O2 = 2SO3?
- 8. Решите задачу : Концентрация вещества за 40 секунд изменилась с 0, 6 до 0, 4 моль / л?
- В каком направлении произойдет смещение равновесия системы Н2 + S H2S , если : а) увеличить концентрацию водорода ; б) понизить концентрацию серово — дорода?
- 1. Согласно принципу Ле — Шателье равновесие смещается в сторонуA) каталитической реакции B) экзотермической реакцииC) эндотермической реакции D) увеличение внешнего воздействияE) ослабление внешнего ?
- Как измениться скорость реакции при увеличении давлении в 2 раза 2SO2 + O2 = 2SO3 гомогенная реакция?
- Увеличение концентрации кислорода в 3 раза в реакции окисления алюминия приводит к :А)уменьшению скорости реакции в 9 разВ)уменьшению скорости реакции в 27 разС)увеличению скорости реакции в 6 разD)ув?
- 🌟 Видео
Видео:Скорость химических реакций. 9 класс.Скачать

Определение скорости реакции при изменении концентрации вешеств
Задача 243.
Определите скорость химической реакции, если начальная концентрация вещества составляла 2,4 моль/л. После проведения реакции концентрация стала 1,8 моль/л, реакция прошла за 24 с.
Решение:
Сн = 2,4 моль/л;
Ск = 1,8 моль/л;
t = 24 c
v = ?
Cкорость химической реакции рассчитывается п формуле:
v — скорость химической реакции, моль/(л . с);
∆C — изменение концентрации вещества, моль/л;
∆t — время протекания реакции, с.
v = ∆C/∆t = (Сн — Ск)/t = (2,4 моль/л — 1,8 моль/л)/24 с = 0,025 моль/(л . с).
Ответ: 0,025 моль/(л . с).
Задача 244.
1. Как и во сколько раз изменится скорость ионной реакции Ag + + Cl — = AgCl, если концентрацию этих ионов увеличить от 0,0002 до 0,004 моль/л?
2. В каком электролите — NaCl или AlCl3 — радиус ионной атмосферы катионов будет больше при одинаковой концентрации электролита.
Решение:
1) Выражение для скорости реакции до изменения концентрации (v1) и после ее изменения (v2) можно записать в общем виде:
v1 = k[Ag + ][Cl — ] = k0,0002 . 0,0002; = 4 . 10 -8 ;
v2 = k[Ag + ][Cl — ] = k0,004 . 0,004. = 1,6 . 10 -5 .
Изменение скорости:
v2/v1 = (k . 0,004 . 0,004)/(k . 0,0002 . 0,0002) = 400 раз.
Отает: скорость реакции увеличится в 400 раз.
Вычисление изменения скорости реакции при повышении температуры в системе
Задача 245.
Вычислите, во сколько раз увеличится скорость реакции, протекающей в газовой фазе, если повысить температуру от 21 до 39 °С. Температурный коэффициент скорости реакции равен 4.
Решение:
Т1 = 21 °С;
Т2 = 39 °С;
λ = 4;
v2/v1 = ?
Вычисление изменения скорости реакции произведем формуле:
λ — температурный коэффициент; Т1 — начальная температура; Т2 — конечная температура; v1 и v2 — соответственно начальная и конечная скорости реакци.
Ответ: скорость реакции увеличится (а не уменьшится) приблизительно в 12 раз.
Вычисление изменения скорости реакции при увеличении объема в газовой смеси
Задача 246.
Во сколько раз измениться скорость прямой и обратной реакции в системе: СО2(г) + С(г) = 2СО(г), если объем газовой смеси увеличить в 2 раза.
Решение:
Уравнение реакции имеет вид:
V1прям. – скорость прямой реакции до увеличения объема;
V1обр. — скорость обратной реакции до увеличения обема.
Обозначим [СО2] = а, [С] = b, [СО] = с.
V1прям. = k . аb;
V1обр. = k . с 2 .
При увеличении объёма в 2 раза в системе концентрация каждого из реагирующих веществ уменьшится в 2 раза. Следовательно, теперь скорости прямой и обратной реакций будут равны:
V2прям. = k(1/2а . 1/2b) = 1/4k . ав;
V2обр. = k(1/2с) 2 = 1/4k . с 2 .
Сравнивая выражения V1прям., V1обр. и V2прям., V2обр. находим, что скорости реакций уменьшились в 4 раза:
V2прям./V1прям. = 1/4k . с 2 /k . аb = 1/4 уменьшится в 4 раза;
V2обр./V1обр. = 1/4k . с 2 /k . с 2 = 1/4 уменьшится в 4 раза.
Вычисление изменения скорости реакции при уменьшении давления в газовой смеси
Задача 247.
Во сколько раз уменьшится скорость реакции: 2А + В2 = 2АВ, протекающей непосредственно между молекулами в закрытом сосуде, если уменьшить давление в 3 раза.
Решение:
Уравнение реакции:
V1прям. – скорость прямой реакции до уменьшения давления.
Обозначим [A] = a, [B2] = b.
V1прям. = k . аb.
При уменьшении давления в 3 раза в системе концентрация каждого из реагирующих веществ уменьшится в 3 раза. Следовательно, теперь скорость прямой реакций будет равна:
V2прям. – скорость прямой реакции до уменьшения давления.
V2прям. = k(1/3а . 1/3b) = 1/9k . аb.
Сравнивая выражения V1прям. и V2прям., находим, что скорости реакций уменьшились в 9 раз:
V2прям./V1прям. = 1/9k . аb/k . аb = 1/9 уменьшится в 9 раз.
Ответ: скорость уменьшится в 9 раз.
Вычисление изменения скорости реакции при увеличении давления
Задача 248.
1. Как изменится скорость реакции при увеличении давления в 3 раза?
Уравнение реакции имеет вид:
С(тв) + О2(г) = 2СО(г).
2. Напишите математическое выражение константы равновесия для системы:
2NO2(г) = N2O2(г); ∆H
Видео:Составление ур-й окислительно-восст. реакций методом ионно-электронного баланса. 1ч. 10 класс.Скачать

Задачи с решениями на химическую кинетику и химическое равновесие
Химическая кинетика и химическое равновесие
Задача № 1. Написать математическое выражение скорости прямой и обратной реакций:
Пример 59
Для реакции 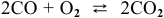
где 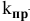
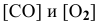
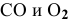
где 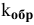
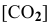
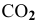
Задача 43
Определить начальную скорость реакции с константой скорости прямой реакции к в растворе, полученном смешением 2 л 0,6 М раствора 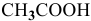
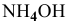
Решение:
Уравнение химической реакции, происходящей в смеси двух растворов, следующее:
Согласно закону действия масс выражение скорости химической реакции
Для определения скорости реакции необходимо знать величину концентраций веществ 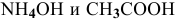
Зная, что в исходном растворе уксусной кислоты содержится 0,6-2 = = 1,2 моль 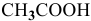
В исходном растворе гидроксида аммония содержится 1-3=3 моль 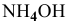
Определяем начальную скорость реакции:
Задача 44
Как изменится скорость прямой реакции
если давление увеличить в 3 раза?
Решение:
Предположим, что в начальный момент до повышения давления концентрации реагирующих веществ следующие:
Скорость реакции, определяемая по закону действия масс, до повышения давления равна:
Согласно уравнению Менделеева-Клапейрона 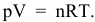
Таким образом, после повышения давления концентрации реагирующих веществ станут равными:
Скорость реакции после повышения давления
Повышение скорости реакции будет следующим:
При повышении давления в 3 раза скорость прямой реакции увеличивается в 27 раз.
Задача 45
Во сколько раз увеличится скорость реакции при увеличении температуры с 50 до 90°С? Температурный коэффициент реакции у равен 2,5.
Решение:
Согласно правилу Вант-Гоффа
Задача 46
Константа скорости реакции разложения HI равна 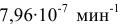
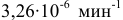
Решение:
Воспользуемся формулой, являющейся производной уравнения Аррениуса:
Теперь, зная энергию активации, можно рассчитать константу скорости реакции при 310 °C:
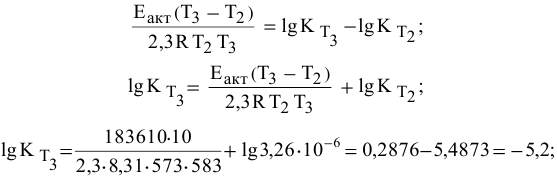
Определяем температурный коэффициент по следующей формуле:
Задача 47
Написать математические выражения констант равновесия следующих реакций:
Решение:
а) Для гомогенной реакции
б) Для гетерогенной реакции
так как концентрации твердых веществ не входят в выражение константы равновесия.
Задача 48
В состоянии равновесия системы 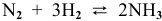
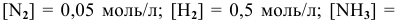
Решение:
Подставим в выражение константы равновесия значения равновесных концентрации:
Задача 49
Константа равновесия реакции 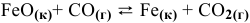

Решение:
Предположим, что в ходе реакции до момента установления состояния химического равновесия концентрация СО уменьшается на X моль/л. Тогда в состоянии химического равновесия концентрации 
Математическое выражение константы равновесия данной реакции:
Отсюда находим значение X:
В состоянии равновесия значения концентрации будут следующими:
Задача 50
Для реакции 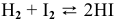
Решение:
Между энергией Гиббса и константой равновесия существует следующая взаимосвязь:
Рассчитываем вначале значение
Находим значение константы равновесия реакции в стандартных условиях 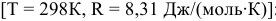
Задача 51
В каком направлении сместится равновесие следующих химических реакций:
если увеличить температуру?
если увеличить концентрацию 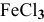
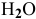
если увеличить давление?
Решение:
Воспользуемся принципом Ле Шателье.
1) Увеличение температуры смещает химическое равновесие в направлении эндотермической реакции, а уменьшение температуры — в направлении экзотермической реакции.
Для реакции 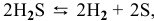
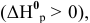
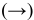
2) Увеличение концентрации одного из участвующих в равновесии веществ смещает химическое равновесие в сторону реакции, уменьшающей концентрацию этого вещества.
Уменьшение концентрации одного из участвующих в равновесии веществ смещает химическое равновесие в сторону реакции, увеличивающей концентрацию этого вещества.
Для реакции 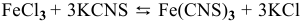
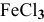
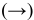
3) Увеличение давления смещает химическое равновесие в направлении реакции, вызывающей уменьшение объема системы, т.е. в сторону реакции с уменьшением числа газообразных молекул.
Для реакции 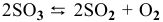


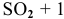
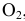
Эти задачи взяты со страницы решения задач по неорганической химии:
Возможно эти страницы вам будут полезны:




















































Образовательный сайт для студентов и школьников
Копирование материалов сайта возможно только с указанием активной ссылки «www.lfirmal.com» в качестве источника.
© Фирмаль Людмила Анатольевна — официальный сайт преподавателя математического факультета Дальневосточного государственного физико-технического института
Видео:Влияние концентрации на скорость химических реакций. 10 класс.Скачать

1)Напишите выражение для скорости реакции С + О2 = СО2 и определите, во сколько раз увеличится ее скорость при увеличении концентрации кислорода в 3 раза?
Химия | 5 — 9 классы
1)Напишите выражение для скорости реакции С + О2 = СО2 и определите, во сколько раз увеличится ее скорость при увеличении концентрации кислорода в 3 раза.
2)Используя справочные данные (табл.
Термодинамических данных), определите, в какую сторону произойдет смещение равновесия гомогенной реакции :
при следующих воздействиях : а) охлаждение системы ; б) увеличение давления.
С(тв) + О₂(г) = СО₂(г) + Q
реакция идет в гетерогенной системе, в формуле скорости учитывается концентрация газообразного кислорода (но, в случае измельчения углерода и увеличения площади реакционной поверхности возрастет и скорость реакции)
v / v₀ = 3 скорость реакции увеличится в три раза
так как реакция экзотермическая, охлаждение системы сместит равновесие в сторону продукта ;
объемы веществ в газовой фазе и продуктов и реагентов одинаковы, увеличение давления не повлияет на равновесие.
Видео:ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

Как будет влиять на состояние равновесия в следующих реакциях 1?
Как будет влиять на состояние равновесия в следующих реакциях 1.
Увеличение температуры 2.
Увеличение концентрации А 3.
Уменьшение давления 4.
Уменьшение концентрации С.
Видео:Химическое равновесие. Константа равновесия. 10 класс.Скачать

Для следующей реакции написать уравнение скорости реакции и определить, как изменится скорость, если концентрацию первого вещества увеличить в 2 раза O2 + 2H2 = 2H2O?
Для следующей реакции написать уравнение скорости реакции и определить, как изменится скорость, если концентрацию первого вещества увеличить в 2 раза O2 + 2H2 = 2H2O.
Видео:Задачи на скорость реакции в зависимости от концентрации реагентовСкачать

Написать выражение константы равновесия реакции :2H2 + С = CH4 дельтаH = — 74, 9 ДжВ каком направлении произойдет смещение равновесии этой реакцииа) при добавлении H2б) при повышении давленияв) при ох?
Написать выражение константы равновесия реакции :
2H2 + С = CH4 дельтаH = — 74, 9 Дж
В каком направлении произойдет смещение равновесии этой реакции
а) при добавлении H2
б) при повышении давления
в) при охлаждении.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Во сколько раз увеличивается скоростьреакции2CO + О2> 2СО2 при увеличении давления в 2 раза?
Во сколько раз увеличивается скорость
2CO + О2> 2СО2 при увеличении давления в 2 раза?
Видео:Скорость химической реакцииСкачать

Напишите выражение для константы равновесия гомогенной системы 2SO2 + O2 = 2SO3?
Напишите выражение для константы равновесия гомогенной системы 2SO2 + O2 = 2SO3.
Как изменится скорость прямой реакции — образования серного ангидрида, если увеличить концентрацию SO2 в 5 раза?
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

8. Решите задачу : Концентрация вещества за 40 секунд изменилась с 0, 6 до 0, 4 моль / л?
8. Решите задачу : Концентрация вещества за 40 секунд изменилась с 0, 6 до 0, 4 моль / л.
Вычислите скорость реакции.
9. Верны ли следующие суждения о смещении химического равновесия в системе
С4Н10(газ) С4Н8(газ) + H2(газ) — Q?
А) При увеличении температуры химическое равновесие в системе смещается в сторону исходного вещества.
Б) При увеличении давления в данной системе смещения химического равновесия не происходит.
1) верно только А
2)верно только Б
3) верны оба суждения
4)Оба суждения не верны.
Видео:8 класс. ОВР. Окислительно-восстановительные реакции.Скачать

В каком направлении произойдет смещение равновесия системы Н2 + S H2S , если : а) увеличить концентрацию водорода ; б) понизить концентрацию серово — дорода?
В каком направлении произойдет смещение равновесия системы Н2 + S H2S , если : а) увеличить концентрацию водорода ; б) понизить концентрацию серово — дорода?
Cоставьте выражения скорости прямой и обратной реакций.
Видео:Как выучить Химию с нуля за 10 минут? Принцип Ле-ШательеСкачать

1. Согласно принципу Ле — Шателье равновесие смещается в сторонуA) каталитической реакции B) экзотермической реакцииC) эндотермической реакции D) увеличение внешнего воздействияE) ослабление внешнего ?
1. Согласно принципу Ле — Шателье равновесие смещается в сторону
A) каталитической реакции B) экзотермической реакции
C) эндотермической реакции D) увеличение внешнего воздействия
E) ослабление внешнего воздействия
В ходе химической реакции катализаторы
A) ускоряют реакцию B) не влияют на скорость реакции
C) замедляют реакцию D) прекращают реакцию
E) расходуется в ходе реакции
Сместит равновесие вправо 2HgO = 2Hg + O2 — Q
A) введение катализатора B) понижение температуры
C) повышение давления D) повышение концентрации кислорода
E) понижение давления
Гетерогенная реакция будет между
A) азот и кислород B) хлор и водород C) оксид азота и кислород
D) фтор и кислород E) углерод и кислород
Единица измерения скорости химический реакции
A) моль / с B) моль / л C) моль / л * с D) г / моль E) кДж / моль
Реакция, идущая с уменьшением объема это.
A) N2 + O2 = 2NO B) 2HI = H2 + I2 C) 2NO + O2 = 2NO D) 2NH3 = N2 + 3H2 E) 2HBr = H2 + Br2
Увеличение концентрации кислорода в 3 раза в реакции 2 CuS + 3O2 = 2CuO + 2 SO2 приводит к….
A) увеличению скорости реакции в 9 раз B) уменьшению скорости реакции в 27 раз
C) увеличению скорости реакции в 3 раза D) уменьшению скорости реакции в 9 раз
E) увеличению скорости реакции в 27 раз
Увеличение концентрации аммиака в 3 раза в реакции 4 NH3 + O2 = 4 NO + 6 H2O приводит к…
A) увеличению скорости реакции в 3 раза B) увеличению скорости реакции в 81 раз
C) увеличению скорости реакции в 12 раз D) увеличению скорости реакции в 60 раз
E) увеличению скорости реакции в 27 раз
Уменьшение концентрации водорода в 2 раза, в реакции N2 + 3H2 = 2 NH3, приводит к…
A) увеличению скорости реакции в 2 раза B) уменьшению скорости реакции в 3 раза
C) уменьшению скорости реакции в 6 раз D) уменьшению скорости реакции в 8 раз
E) увеличению скорости реакции в 6 раз
Увеличение концентрации кислорода в 3 раза в реакции 2 H2S + 3 O2 = 2H2O + 2 SO2 приводит к….
A) увеличению скорости реакции в 9 раз B) увеличению скорости реакции в 3 раз
C) увеличению скорости реакции в 27 раз D) уменьшению скорости реакции в 3 раза
E) уменьшению скорости реакции в 9 раз
Увеличение концентрации продукта реакции в равновесной системе приводит к смещению равновесия в сторону…
A) реакции образования исходных веществ B) реакции расходования исходных веществ
C) эндотермической реакции D) реакции, идущей с уменьшением числа молекул газов
E) реакции, идущей к увеличением числа молекул газов
Уменьшение концентрации кислорода в 2 раза, в реакции
4 NH3 + O2 = 4 NO + 6 H2O приводит к…
A) увеличению скорости реакции в 2 раза B) уменьшению скорости реакции в 2 раза
C) уменьшению скорости реакции в 10 раз D) уменьшению скорости реакции в 32 раза
E) уменьшению скорости реакции в 32 раза
Во сколько раз возрастет скорость химической реакции 2NO + O2 = 2 NO2 при увеличении концентрации азота (II) в два раза?
A) в 2 раза B) в 4 раза C) в 6 раз D) в 8 раз E) в 7 раз
Скорость реакции А + 3В = АВ3 увеличится в 1000 раз при увеличении концентрации вещества В…
A) в 20 раз B) в 10 раз C) в 5 раз D) в 25 раз E) в 15 раз
Для процесса CO + 2H2 = CH3OH + Q сместят равновесие вправо факторы
Повышении концентрации СО
A) 124 B) 234 C) 145 D) 246 E) 135
Для обоих процессов, химическое равновесие сместит влево
N2 + O2 = 2NO — Q 2NH3 + Q = N2 + 3H2
A) увеличение давление B) уменьшение давление
C) уменьшение концентрации N2D) увеличение концентрации N2
E) понижение температуры
Скорость горения сероводорода при увеличении концентрации кислорода в 2 раза
A) не изменится B) увеличивается в 4 раза C) уменьшается в 2 раза
D) увеличивается в 8 раз E) увеличивается в 2 раза
При протекании необратимой реакции концентрация реагирующих веществ
A) не изменяется B) сначала увеличивается, потом уменьшается C) увеличивается
D) сначала уменьшится, потом увеличивается E) уменьшается
Какое условие будет способствовать увеличению выхода аммиака по реакции
N2 + 3H2 = 2 NH3 + Q
A) увеличение давления B) повышение температуры
C) понижение концентрации водорода D) понижение давления
E) понижение концентрации азота
При увеличении концентрации А в 2 раза и снижении концентрации В в 2 раза, скорость снижается в 2 раза в реакции
A) А + 2В = АВ2B) 3А + 3В = 3АВ C) 2А + 2В = 2АВ
D) 2А + В = А2В E) 3А + 2В = А3В2
Если скорость реакции А2 + В2 = С возросла в 25 раз, то давление увеличивается
A) 5 раз B) 25 раз C) 100 раз D) 75 раз E) 125 раз
Чему равен температурный коэффициент реакции, если при повышении температуры на 300С скорость реакции возрастет в 64 раза?
A) 2 B) 3 C) 4 D) 5 E) 6
Скорость реакции увеличится при повышении температуры на 400С, если температурный коэффициент = 2 в… A) 4 раза B) 9 раз C) 16 раз D) 27 раз E) 81 раз
Если температура возросло на 400С и скорость реакции увеличилась в 16 раз, то температурный коэффициент равен A) 4 B) 2 C) 3 D) 5 E) 6.
Видео:Окислительно-восстановительные реакции в кислой среде. Упрощенный подход.Скачать

Как измениться скорость реакции при увеличении давлении в 2 раза 2SO2 + O2 = 2SO3 гомогенная реакция?
Как измениться скорость реакции при увеличении давлении в 2 раза 2SO2 + O2 = 2SO3 гомогенная реакция.
Видео:Порядок реакцииСкачать

Увеличение концентрации кислорода в 3 раза в реакции окисления алюминия приводит к :А)уменьшению скорости реакции в 9 разВ)уменьшению скорости реакции в 27 разС)увеличению скорости реакции в 6 разD)ув?
Увеличение концентрации кислорода в 3 раза в реакции окисления алюминия приводит к :
А)уменьшению скорости реакции в 9 раз
В)уменьшению скорости реакции в 27 раз
С)увеличению скорости реакции в 6 раз
D)увеличению скорости реакции в 27 раз
Е)увеличению скорости реакции в 9 раз?
На этой странице находится вопрос 1)Напишите выражение для скорости реакции С + О2 = СО2 и определите, во сколько раз увеличится ее скорость при увеличении концентрации кислорода в 3 раза?. Здесь же – ответы на него, и похожие вопросы в категории Химия, которые можно найти с помощью простой в использовании поисковой системы. Уровень сложности вопроса соответствует уровню подготовки учащихся 5 — 9 классов. В комментариях, оставленных ниже, ознакомьтесь с вариантами ответов посетителей страницы. С ними можно обсудить тему вопроса в режиме on-line. Если ни один из предложенных ответов не устраивает, сформулируйте новый вопрос в поисковой строке, расположенной вверху, и нажмите кнопку.
N(O) / n(K) = 10 m(K₃PO₄) = mw = n(K₃PO₄)M(K₃PO₄) = n(K)M(K₃PO₄) / 3 = n'(O)M(K₃PO₄) / 4 n(K) = 3mw / M(K₃PO₄) n'(O) = 4mw / M(K₃PO₄) m(H₂O) = m(1 — w) = n(H₂O)M(H₂O) = n»(O)M(H₂O) n»(O) = m(1 — w) / M(H₂O) / <3..
Что именно необходимо сделать с этими уравнениями? Расставить коэффициенты.
Ответ : 25 лДано : V(N₂) = 50 лV(NO) — ? Объяснение : N₂ + O₂ = 2NOИз уравнения реакции видно, что V(N₂) = 0, 5V(NO)V(N₂) = 0, 5 * 50 л = 25 лОтвет : 25 л.
Вот смотри и щас еще кинк.
Амфотерные — АL(OH)3, Zn(OH)2, Fe(OH)3. Основные — Ca(OH)2. Кислоты — H3SO4, HNO3. СТАВЬ СПАСИБО.
[Ca(NH₃)₃(H₂O)]Cl₂ хлорид акватриамминкальция.
Плюсовий, його заряд завжди такий.
Дано m(ppa NaOH) = 200 g W(NaOH) = 2% m(ppa HCL) = 100 g W(HCL) = 4% — — — — — — — — — — — — — — — — — — — — — — — — — — — m(NaCL) — ? M(NaOH) = 200 * 2% / 100% = 4 g m(HCL) = 100 * 4% / 100% = 4g M(NaOH) = 40 g / mol n(NaOH) = m / M = 4 / 40 = 0. ..
Решение находится на фото.
Да, потому что Ca является металлом , а к. О SO4 не металл.
🌟 Видео
Скорость реакции. Химия – ПростоСкачать

Скорость химической реакции. Практическая часть. 10 класс.Скачать

Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Окислительно-восстановительные реакции. 1 часть. 9 класс.Скачать

Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать