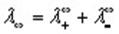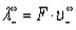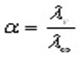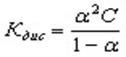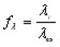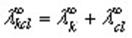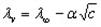В общем случае молярная проводимость уменьшается при возрастании концентрации электролита. Конкретный характер этой зависимости различен для сильных и слабых электролитов.
Сильные электролиты. При низких концентрациях молярная проводимость сильного электролита оказывается пропорциональной квадратному корню из концентрации
Конкретный вид этой зависимости определяется эмпирическим уравнением, которое впервые сформулировал Кольрауш:
где b-постоянная величина, а первый член называется молярной проводимостью (электропроводностью) при бесконечном разбавлении, а иногда -предельной молярной проводимостью (электропроводностью). Таким образом,
Значение предельной проводимости для сильного электролита можно определить, построив график зависимости молярной проводимости и экстраполируя его к точке
На рис. 10.3 показан такой график для раствора хлорида калия. Обратим внимание на то, что в области значений у/с, превышающих приблизительно 0,5, график отклоняется от прямолинейного.
Слабые электролиты.
Молярная проводимость растворов слабых электролитов значительно меньше, чем для растворов сильных электролитов. Дело в том, что
молярная проводимость раствора зависит от количества присутствующих в нем ионов. Слабые электролиты даже при низких концентрациях характеризуются малой степенью диссоциации. Но все же, когда концентрация слабого электролита становится очень Низкой, степень его ионизации резко возрастает. Это приводит к соответственному возрастанию молярной проводимости. На рис. 10.3 показан график зависимости молярной проводимости от квадратного корня из концентрации уксусной кислоты. Этот график имеет нелинейный характер и показывает, что слабые электролиты не подчиняются уравнению Кольрауша.
Ионная подвижность. В 1875 г. Колърауш проводил сопоставление молярных проводимостей при бесконечном разбавлении для пары сильных электролитов, имеющих общие ионы. Он установил, что разность молярных проводимостей между членами каждой пары с общими ионами оказывается постоянной (табл. 10.1). На этом основании Кольрауш сформулировал закон аддитивности (независимости) ионных подвижностей, названный впоследствии его именем. Закон Кольрауша гласит, что молярная проводимость электролита при бесконечном разбавлении представляет собой сумму подвижностей ионов, образующих электролит, и что эти подвижности не зависят от других ионов.
Ионная подвижность связана с молярной проводимостью данного иона при бесконечном разбавлении. Для электролита состава 1:1 (иначе, для 1 :1-электролита) типа KCl закон Кольрауша математически записывается так:
Ионная подвижность является мерой скорости, с которой данный ион перемещается через раствор. Вообще говоря, ионы с малыми ионными радиусами перемещаются медленнее, чем ионы с большими ионными радиусами. Это объясняется тем, что ион меньшего размера имеет более высокую плотность заряда и поэтому сильнее сольватируется растворителем (см. разд. 2.2). Его гидратная оболочка и, следовательно, его эффективный размер оказывается больше, чем у иона с большим ионным радиусом. Большой эффективный заряд такого иона обусловливает его малую подвижность в растворе.
Двухзарядные или трехзарядные ионы, как правило, имеют более высокую ионную подвижность, чем однозарядные ионы. Исключение составляют ионы гидроксония H3O+ и гидроксильные ионы 0Н
, которые имеют самые высокие ионные подвижности из всех ионов. Это объясняется быстрым переносом протонов между ионами в растворе.
Видео:Степень электролитической диссоциации. Сильные и слабые электролиты. 9 класс.Скачать

Эквивалентная электропроводность при бесконечном разведении. Абсолютная скорость движения и подвижности ионов. Закон Кольрауша и независимой подвижности ионов.
Эквивалентная электропроводность при бесконечном разбавлении как для сильных, так и для слабых электролитов может быть вычислена с помощью закона Кольрауша.
Согласно закону Кольрауша эквивалентная электропроводность раствора электролита при бесконечном разбавлении определяется выражением:
где 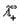
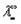
Эквивалентные электропроводности ионов называются также подвижностями. Они равны произведению абсолютной скорости ионов на число Фарадея, т.е.
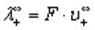
где 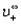
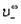
По измеренным сопротивлениям для каждой из концентраций вычисляют удельную электропроводность, эквивалентную электропроводность, а затем вычисляют степень диссоциации по уравнению:
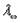
Константу равновесия процесса диссоциации слабого электролита вычисляют по уравнению (закон разбавления Оствальда):
где ? – степень диссоциации,
С – концентрация раствора.
При работе с раствором сильного электролита необходимо вычислить коэффициент электропроводности по уравнению:
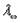
Подвижности ионов К’ и Cl’ взять из приложения ( в конце работы).
Для сильных электролитов зависимость эквивалентной электропроводности от концентрации выражается эмпирическим уравнением Кольрауша
где а – постоянная, зависящая от природы электролита, растворителя и температуры.
Видео:Электропроводность сильных и слабых электролитовСкачать

Электропроводность растворов электролитов
Измерение электропроводности (электрической проводимости) растворов-электролитов, или кондуктометрия, — один из наиболее распространенных методов физико-химического исследования. Измеряя величину электропроводности, можно получить сведения о характере взаимодействия молекул и ионов в растворе, определить концентрации растворенных веществ, растворимость труднорастворимых солей, степень диссоциации, константу ионизации электролита и другие характеристики.
Все проводники электрического тока подразделяются на проводники первого рода, электрическая проводимость которых обусловлена движением электронов, и проводники второго рода, обладающие ионной проводимостью. В электрохимии рассматривается электрическая проводимость растворов электролитов, т.е. предмет электрохимии — проводники второго рода. Электрическая проводимость (электропроводность) G — величина, обратная сопротивлению R:
Известно, что сопротивление однородного проводника R, Ом, зависит от его длины I, м, и площади поперечного сечения S, м 2 :
Здесь р — удельное сопротивление, имеющее размерность Ом-м. Величину, обратную удельному сопротивлению, называют удельной электропроводностью:
Таким образом, удельная электропроводность раствора электролита представляет собой электрическую проводимость 1 м 3 раствора, находящегося между двумя большими плоскими электродами, расположенными на расстоянии 1 м друг от друга. Размерность удельной электропроводности — Ом^-м -1 или См-м -1 , здесь Ом -1 = Сименс (См). При измерениях удельной электропроводности проводников второго рода за длину I в выражении (5.11) принимают расстояние между параллельными электродами, за поперечное сечение S — площадь поверхности электродов. Отсюда следует, что сравнивать между собой сопротивление или электропроводность растворов можно лишь в том случае, если все измерения выполняются в одном и том же сосуде (ячейке), т.е. с одними и теми же электродами.
На рис. 5.4 приведена концентрационная зависимость удельной электропроводности электролитов. Для всех электролитов кривые проходят через максимум. Такая экстремальная зависимость в случае сильных электролитов объясняется тем, что при малых концентрациях взаимное тормозящее влияние ионов, проявляющееся в электрофоретическом и релаксационном эффектах (см. далее), еще незначительно и рост С (т.е. с увеличение концентрации ионов — переносчиков электрического тока) приводит к увеличению у. При больших концентрациях тормозящее влияние ионов становится преобладающим и % с увеличением С уменьшается несмотря на увеличение концентрации ионов.
В случае слабых электролитов уменьшение х П Р И повышенных концентрациях объясняется преобладающим снижением степени диссоциации а с ростом С, т.е. концентрация электролита С растет, а концентрация ионов — переносчиков тока при этом уменьшается.
Электропроводность электролитов зависит от температуры, концентрации, от природы растворителя и от свойств растворенного вещества, выражающихся в способности переносить в единицу времени большее или меньшее количество электричества.
Рис. 5.4. Зависимость удельной электропроводности от концентрации растворов-электролитов
Очевидно, способность различных электролитов проводить ток удобно сравнивать в таких условиях, когда в слое жидкости, заключенном между электродами, находятся химически сравнимые количества различных веществ. Таким химически сравнимым количеством является моль, ему соответствует молярная электропроводность X. Она представляет собой электропроводность слоя раствора-электролита толщиной 1 м, находящегося между плоскими электродами с такой площадью, чтобы объем раствора, заключенного между ними, содержал один моль растворенного вещества. Молярная электропроводность связана с удельной электропроводностью соотношением
где С — концентрация электролита в моль на 1 м 3 ; V — разведение раствора, м 3 /моль. Величина V равна такому объему раствора, в м 3 , в котором растворен один моль вещества. Размерность молярной электропроводности — [Ом -1 -мкмоль -1 ].
Казалось бы, если для измерений электропроводности брать объемы растворов, содержащие одинаковое количество переносчиков тока, то электропроводность не должна зависеть от концентрации.
Однако эксперименты показали, что и для сильных, и для слабых электролитов с увеличением концентрации растворов X уменьшается. Концентрационная зависимость X приведена на рис. 5.5.
Ф. Кольрауш опытным путем установил, что зависимость X = /(С) при малых концентрациях описывается уравнением Кольрауша:
где Х°° — молярная электропроводность при бесконечном разведении (при С —^ 0) ; А. — константа.
Л. Онзагер вывел уравнение, раскрывающее физический смысл этой константы. Для 1,1-зарядного электролита уравнение Онзагера имеет вид
Здесь в — диэлектрическая проницаемость растворителя; р — вязкость растворителя. Первый член в квадратных скобках учитывает так называемое электрофоретическое торможение ионов.
Рис. 5.5. Зависимость молярной электропроводности от концентрации
1 — для слабых электролитов; 2 — для сильных электролитов
Эффект электрофоретического торможения возникает за счет того, что при наложении внешнего электрического поля сольватированная ионная атмосфера (избыток ионов противоположного знака, окружающих любой ион в растворе — центральный ион), обладая зарядом, противоположным по знаку заряду центрального иона, движется в противоположном ему направлении. Таким образом, каждый ион в растворе под действием электрического поля перемещается не в неподвижной среде, а в среде, движущейся ему навстречу, что снижает скорость (подвижность) перемещения ионов.
Второй член в квадратных скобках учитывает релаксационный эффект торможения. Его возникновение объясняется тем, что перемещение иона в электрическом поле сопровождается разрушением ионной атмосферы в одном положении иона и образованием ее в другом. Этот процесс происходит не мгновенно, а в течение некоторого времени, называемого временем релаксации. За это время ион успевает сместиться от центра созданной им ионной атмосферы, и позади него возникает избыток ионов противоположного знака. Возникающие силы электростатического притяжения тормозят движение иона, стремясь втянуть его обратно в центр атмосферы.
Таким образом, уменьшение Я с ростом С в случае сильных электролитов связано с усилением электрофоретического и релаксационного эффектов, тормозящих движение ионов. В случае слабых электролитов снижение молярной электропроводности можно объяснить на основании теории Аррениуса, в согласии с которой увеличение концентрации растворов приводит к уменьшению степени диссоциации а и тем самым к снижению концентрации ионов в растворе, содержащем 1 моль вещества.
Молярную электропроводность можно выразить через молярные электропроводности (ранее их называли подвижностями) Х+ катиона и X- аниона:
Здесь U+ и U_ — подвижности катиона и аниона; U< — это скорость движения иона при напряженности электрического поля 1 В/см; F — число Фарадея. В литературе можно встретить и устаревшее название Ut — абсолютные скорости движения ионов.
Молярные электропроводности ионов и подвижности ионов зависят от концентрации раствора: Я,- или I/, тем меньше, чем концентрированнее раствор; с увеличением концентрации сильнее проявляются тормозящие эффекты, и наоборот.
При бесконечном разведении растворов ионная атмосфера не образуется (ионы не «чувствуют» друг друга), и молярная электропроводность ионов — предельная молярная электропроводность ионов (Я+)°° и (Я_)°° определяется лишь свойствами растворителя и самого иона — размером, зарядом, способностью гидратироваться и др. Предельные молярные электропроводности ионов можно найти в справочниках, при этом (Я,) 00 многозарядных ионов, как правило, делят на величину заряда. Например, для А1 3+ в табл. 5.4 указывают 1/ЗАР+, а для SO^- — 1/2S03-.
Значения предельных молярных электропроводностей ионов в водных растворах при 298 К
📺 Видео
Электрическая проводимость растворов электролитов. Кондуктометрия.Скачать

Зависимость электрического сопротивления металлов от температуры. Сверхпроводимость. 8 класс.Скачать

Электрическая проводимость различных веществ | Физика 10 класс #57 | ИнфоурокСкачать

Урок 184 (осн). Зависимость сопротивления металлов от температурыСкачать

Зависимость электрического сопротивления от температурыСкачать

Опыты по химии. Испытание веществ и их растворов на электропроводностьСкачать

4 1 ЭлектропроводностьСкачать

Сильные и слабые электролиты. Константа диссоциации. Водородный показатель.Скачать

Проводимость электролитаСкачать

Диссоциация. Сильные и слабые электролиты. Проводник второго рода. Химия – ПростоСкачать

4 1 ЭлектропроводностьСкачать

Собственная проводимость полупроводниковСкачать

Теории кислот, оснований и растворов. Теория Аррениуса-Оствальда. 11 класс.Скачать

Успеть за 300 секунд, #7: Электролиты и неэлектролитыСкачать

Испытание веществ на электрическую проводимостьСкачать

Урок 153 (осн). Вычисление сопротивления проводника. Удельное сопротивлениеСкачать

Растворы электролитов - Электропроводность растворовСкачать

Определение электропроводности раствораСкачать