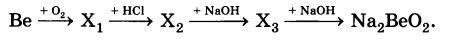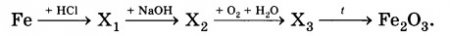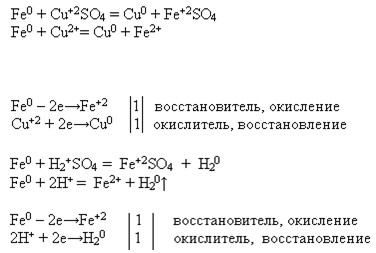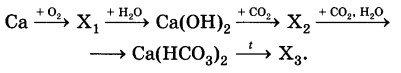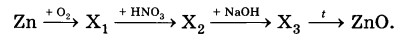Химия | 5 — 9 классы
Составьте возможные уравнения взаимодействия Na, Zn, Hg со следующими веществами : О2, F2, H2O, HCl, FeSO4, AgNO3.
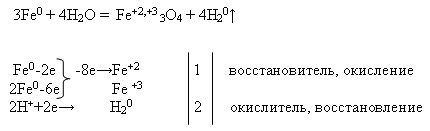
2Nа + 2Н2О = 2NаОН + Н2
2Nа + 2НСl = 2NаСl + Н2
2Nа + Cl2 = 2NаСl
Zn0 — 2e→Zn2 + окисляется, восстановитель
Cl20 + 2e→2Cl — восстанавливается, окислитель
Zn + H2O = ZnO + H2.
Zn + 2HCl = ZnCl2 + H2
Fe + 2HCl = FeCl2 + H2
FeCl2 + 2AgNO3 = 2AgCl + Fe(NO3)2
Fe(NO3)2 + 2NaOH = Fe(OH)2 + 2NaNO3
Fе2 + + 2NO3 — + 2Na + + 2OH — = 2Na + + 2NO3 — + Fе(ОН)2
Fе2 + + 2OH — = Fе(ОН)2
Fе(ОН)2 = FеО + Н2О.
- Составьте уравнения реакций взаимодействия между следующими парами веществ : 1) Na и O2 2) Na и Cl2 3) Al и S?
- ДАЮ МНОГО БАЛЛОВ?
- Na OH + Fe Cl³→HCL + AgNO³→( реакции обмена )³ — индексПомргите пожалуйста))?
- Даны вещества : Н2, О2, Zn, HCl, CuO?
- Даны вещества h2 o2 zn hcl cuo составьте уравнения пяти реакций возможного взаимодействия между собой?
- Даны вещества : Na, Cu, Zn, H2O, S, CuSO4, HCl?
- Какие из них вещества взаимодействуют с Zn : br 02 s p h2 na h2o hcl nacl cucl2?
- Составьте все возможные уравнения реакций между приведёнными ниже веществами :Na, MgOH, Cl2, O2, KOH, CaCo3, HCl, CH3COOH?
- Выберите вещества способные вступать во взаимодействие с соляной кислотой :CaO, H²S, NaCl, Ca³(PO⁴)², N²O5, AgNO³, Mg, FeSO⁴, HNO³Составьте уравнения соответствующих реакций?
- Напишите уравнение реакций между следующими веществами?
- Презентация по химии на тему «Химические свойства металлов»
- Описание презентации по отдельным слайдам:
- Дистанционное обучение как современный формат преподавания
- Педагогическая деятельность в контексте профессионального стандарта педагога и ФГОС
- Химия: теория и методика преподавания в образовательной организации
- Дистанционные курсы для педагогов
- Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
- Другие материалы
- Вам будут интересны эти курсы:
- Оставьте свой комментарий
- Автор материала
- Дистанционные курсы для педагогов
- Подарочные сертификаты
- Ответы на контрольную работу по теме «Металлы»(Габриелян)
- Основные разделы
- Контрольные работы
- Ответы на контрольную работу по теме «Металлы»(Габриелян)
- 🎬 Видео
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Составьте уравнения реакций взаимодействия между следующими парами веществ : 1) Na и O2 2) Na и Cl2 3) Al и S?
Составьте уравнения реакций взаимодействия между следующими парами веществ : 1) Na и O2 2) Na и Cl2 3) Al и S.
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

ДАЮ МНОГО БАЛЛОВ?
ДАЮ МНОГО БАЛЛОВ!
Из данного списка выпишите вещества с которыми взаимодействует аммиак :
HCL, NaOH, O2, N2, H2So4
Составьте уравнения возможных реакций.
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Na OH + Fe Cl³→HCL + AgNO³→( реакции обмена )³ — индексПомргите пожалуйста))?
Видео:ЛУЧШАЯ стратегия использования Таблицы Растворимости (химия с нуля)Скачать

Даны вещества : Н2, О2, Zn, HCl, CuO?
Даны вещества : Н2, О2, Zn, HCl, CuO.
Составьте уровнения 5 реакций возможного взаимодействия этих веществ между собой.
Видео:Химия | Молекулярные и ионные уравненияСкачать

Даны вещества h2 o2 zn hcl cuo составьте уравнения пяти реакций возможного взаимодействия между собой?
Даны вещества h2 o2 zn hcl cuo составьте уравнения пяти реакций возможного взаимодействия между собой.
Видео:Решение цепочек превращений по химииСкачать

Даны вещества : Na, Cu, Zn, H2O, S, CuSO4, HCl?
Даны вещества : Na, Cu, Zn, H2O, S, CuSO4, HCl.
Составить не менее 7 уравнений которые могут происходить между этими веществами.
Видео:Ионные уравнения реакций. Как составлять полные и сокращенные уравненияСкачать

Какие из них вещества взаимодействуют с Zn : br 02 s p h2 na h2o hcl nacl cucl2?
Какие из них вещества взаимодействуют с Zn : br 02 s p h2 na h2o hcl nacl cucl2.
Видео:ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

Составьте все возможные уравнения реакций между приведёнными ниже веществами :Na, MgOH, Cl2, O2, KOH, CaCo3, HCl, CH3COOH?
Составьте все возможные уравнения реакций между приведёнными ниже веществами :
Na, MgOH, Cl2, O2, KOH, CaCo3, HCl, CH3COOH.
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Выберите вещества способные вступать во взаимодействие с соляной кислотой :CaO, H²S, NaCl, Ca³(PO⁴)², N²O5, AgNO³, Mg, FeSO⁴, HNO³Составьте уравнения соответствующих реакций?
Выберите вещества способные вступать во взаимодействие с соляной кислотой :
CaO, H²S, NaCl, Ca³(PO⁴)², N²O5, AgNO³, Mg, FeSO⁴, HNO³
Составьте уравнения соответствующих реакций.
Видео:ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Напишите уравнение реакций между следующими веществами?
Напишите уравнение реакций между следующими веществами.
На этой странице находится вопрос Составьте возможные уравнения взаимодействия Na, Zn, Hg со следующими веществами : О2, F2, H2O, HCl, FeSO4, AgNO3?, относящийся к категории Химия. По уровню сложности данный вопрос соответствует знаниям учащихся 5 — 9 классов. Здесь вы найдете правильный ответ, сможете обсудить и сверить свой вариант ответа с мнениями пользователями сайта. С помощью автоматического поиска на этой же странице можно найти похожие вопросы и ответы на них в категории Химия. Если ответы вызывают сомнение, сформулируйте вопрос иначе. Для этого нажмите кнопку вверху.
8 класс химия решить 2и 3 по примеру 1го Сu(OH).
N = 30 * 10 ^ 23 (молекул) n = N / Na, гдеNa — число Авогадро = 6. 02 * 10 ^ 23 (молекул / моль) n = 30 * 10 ^ 23 / 6. 02 * 10 ^ 23 = 5 (моль) V = Vm * n, гдеVm — объем газа при н. У. = 22. 4 (л / моль) V = 22. 4 * 5 = 112 (л).
CH₄ + 2O₂ = CO₂ + 2H₂O V(CH₄) = 0, 1 м³ = 100 л по уравнению реакции при н. У. V(CO₂) = V(CH₄) V(CH₄) = 0, 1 м³ = 100 л.
H20 + CO2 / Na7 вроде бы так это делается , в химии не очень шарю.
2Zn + O2 — — >2ZnO ZnO + CaCl2 — — >ZnCl2 + CaO ZnO + 2KOH — — >K2ZnO2 + H2O.
N = 2. 2 (моль) M(CO2) = 12 + 2 * 16 = 44 (г / моль) m = n * M = 2. 2 * 44 = 96. 8 (г) V = Vm * n, Vm — объем газа при н. У. = 22, 4 (л / моль) V = 22. 4 * 2. 2 = 49. 28 (л).
Четыре сигма — связи, sp3 — гибридизация.
Магнитом отделяем железо. Оставшееся высыпаем в воду дерево всплывает. Методом выпаривания испоряем воду остаётся соль.
10FeSO4 + 2KMnO4 + 8H2SO4 = 5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8H2O Mn + 7 о — ль, Fe + 2 в — ль.
Я на пишу кратко Na2 O = 23 * 2 + 16 = 62 а. Е. м = 0, 741 = 0, 258 C2H6 = 12 * 2 + 6 = 30 а. Е. м = 0, 8 = 0, 2 Fe2O3 = 55 * 2 + 16 * 3 = 158 a. E. m.
Видео:Решение задач на термохимические уравнения. 8 класс.Скачать

Презентация по химии на тему «Химические свойства металлов»
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
Рабочие листы и материалы для учителей и воспитателей
Более 2 500 дидактических материалов для школьного и домашнего обучения
Описание презентации по отдельным слайдам:
Химические
свойства металлов
10 класс
Бозаджи Н.М.
учитель химии
высшей категории
В результате изучения темы ,вы будете способны:
1. Cистематизировать и углубить знания о химических свойствах металлов, подчеркнув их функцию как восстановителей.
2. Закреплять умения составлять уравнения реакций
3. Развивать познавательный интерес при выполнении теоретических заданий
4.Осуществлять рефлексию своей деятельности
«Свои способности
человек может
узнать только
попытавшись
приложить их»
Сенека (младший)
Взаимодействие металлов:
I.С простыми веществами;
II.Со сложными веществами.
Ряд активности металлов
Увеличение восстановительных свойств
I. Взаимодействие металлов с простыми веществами – неметаллами
с кислородом;
с галогенами;
с водородом.
1.с кислородом
а)щелочные металлы (кроме лития) образуют пероксиды:
2е
В-ль ок-ль
I. Взаимодействие металлов с простыми веществами – неметаллами
1.с кислородом
б) металлы средней активности и литий образуют оксиды:
Составьте уравнение реакции взаимодействия лития с кислородом и рассмотрите его как ОВР.
4е
В-ль ок-ль
I. Взаимодействие металлов с простыми веществами – неметаллами
Взаимодействие железа с кислородом – горение железа
1.с кислородом:
в) железо с кислородом при нагревании образует смешанный оксид (железную окалину):
8е
Смешанный оксид железа II — III
В-ль ок-ль
I. Взаимодействие металлов с простыми веществами – неметаллами
1.с кислородом
г) металлы неактивные – Ag, Au, Pt —
с кислородом не взаимодействуют, т.е. не окисляются
I. Взаимодействие металлов с простыми веществами – неметаллами
I. Взаимодействие металлов с простыми веществами – неметаллами
Взаимодействие железа с хлором – горение железа в хлоре.
Составьте уравнение химической реакции. Рассмотрите его как ОВР.
6е
В-ль ок-ль
I. Взаимодействие металлов с простыми веществами – неметаллами
Взаимодействие меди с хлором – горение меди в хлоре.
* Составьте уравнение химической реакции. Рассмотрите его как ОВР.
2е
В-ль ок-ль
Гидрид натрия
* Составить уравнение реакции для алюминия с водородом.
I. Взаимодействие металлов с простыми веществами – неметаллами
с водой
с растворами кислот
с оксидами металлов
с растворами солей
II. Взаимодействие металлов
со сложными веществами
с водой
Вспомните, при каких условиях металлы взаимодействуют с водой?
II. Взаимодействие металлов со сложными веществами
II. Взаимодействие металлов со сложными веществами
с водой
Взаимодействие натрия с водой
а) щелочные и щелочноземельные металлы в реакции с водой образуют щелочь:
2 е
В-ль ок-ль
с водой
II. Взаимодействие металлов со сложными веществами
б) металлы средней активности в реакции с водой образуют оксид:
2 е
Составьте уравнение реакции между цинком и водой:
В-ль ок-ль
II. Взаимодействие металлов со сложными веществами
с водой
а) металлы неактивные в реакцию с водой не вступают:
При составлении уравнения реакций металла с водой смотри электрохимический ряд напряжения металлов.
с водой
II. Взаимодействие металлов со сложными веществами
2. с растворами кислот
Вспомните, при каких условиях металлы взаимодействуют с растворами кислот, если при этом окислителем является водород?
если металл активней водорода;
если металл не щелочной;
если образуется растворимая соль;
если в реакцию вступает растворимая кислота;
если кислота не азотная и не концентрированная серная.
II. Взаимодействие металлов со сложными веществами
Взаимодействие с растворами кислот:
Взаимодействие цинка с раствором соляной кислоты
2. с растворами кислот
а) не щелочные металлы и металлы средней активности реагируют с растворами кислот:
Составьте уравнение реакции между цинком и соляной кислотой.
2е
в-ль ок-ль
II. Взаимодействие металлов со сложными веществами
Взаимодействие металлов с растворами кислот
2. с растворами кислот
а) не активные металлы не реагируют с растворами кислот:
При составлении уравнения химической реакции между металлом и раствором кислоты смотри электрохимический ряд напряжения металлов и таблицу растворимости.
* Составьте уравнение реакции между кальцием и серной кислотой.
II. Взаимодействие металлов со сложными веществами
3.с оксидами металлов
Но эта реакция
характерна не для всех металлов.
II. Взаимодействие металлов со сложными веществами
3. Магний, кальций и алюминий могут взаимодействовать с оксидами металлов:
6е
* Составьте уравнение реакции между кальцием и оксидом меди (II).
II. Взаимодействие металлов со сложными веществами
если металл активней металла соли;
если металл не щелочной;
если в реакцию вступают и образуются растворимые соли;
4. с растворами солей
Вспомните, при каких условиях металлы взаимодействуют с растворами солей?
II. Взаимодействие металлов со сложными веществами
4. с растворами солей
6 е
В-ль ок-ль
При составлении уравнения химической реакции между металлом и солью смотри электрохимический ряд напряжения металлов и таблицу растворимости.
* Составьте уравнение реакции для меди и нитрата серебра.
II. Взаимодействие металлов со сложными веществами
Самостоятельная работа
Для металлов Na, Zn, Hg – составить возможные уравнения с веществами из списка:
Жизнь человеческая подобна железу.
Если употреблять его в дело, оно истирается;
если же не употреблять, ржавчина его съедает.
Так,
Пусть ваш мозг истирается от работы мысли, а не пожирается ржавчиной от лени.
Катон Старший
1.Разобрать конспект.
2.Выучить § 7.2
3.Выполнить задания:упр.2стр.223(ЦП)
4.Мини конспект «Сплавы. Виды сплавов. Коррозия .Виды коррозии»
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания
- Сейчас обучается 860 человек из 78 регионов
Курс повышения квалификации
Педагогическая деятельность в контексте профессионального стандарта педагога и ФГОС
- Сейчас обучается 47 человек из 21 региона
Курс профессиональной переподготовки
Химия: теория и методика преподавания в образовательной организации
- Сейчас обучается 377 человек из 64 регионов
«Мотивация здорового образа жизни. Организация секций»
Свидетельство и скидка на обучение каждому участнику
- Для всех учеников 1-11 классов
и дошкольников - Интересные задания
по 16 предметам
«Как закрыть гештальт: практики и упражнения»
Свидетельство и скидка на обучение каждому участнику
Видео:Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Дистанционные курсы для педагогов
Самые массовые международные дистанционные
Школьные Инфоконкурсы 2022
33 конкурса для учеников 1–11 классов и дошкольников от проекта «Инфоурок»
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
5 845 393 материала в базе
Ищем педагогов в команду «Инфоурок»
Другие материалы
- 27.04.2017
- 9134
- 22
- 27.04.2017
- 4157
- 0
- 27.04.2017
- 4713
- 8
- 27.04.2017
- 4929
- 42
- 27.04.2017
- 9240
- 15
- 27.04.2017
- 7598
- 634
- 27.04.2017
- 3166
- 0
«Учись, играя: эффективное обучение иностранным языкам дошкольников»
Свидетельство и скидка на обучение
каждому участнику
Вам будут интересны эти курсы:
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
Добавить в избранное
- 27.04.2017 7520
- PPTX 1.3 мбайт
- 325 скачиваний
- Рейтинг: 5 из 5
- Оцените материал:
Настоящий материал опубликован пользователем Бозаджи Надежда Михайловна. Инфоурок является информационным посредником и предоставляет пользователям возможность размещать на сайте методические материалы. Всю ответственность за опубликованные материалы, содержащиеся в них сведения, а также за соблюдение авторских прав несут пользователи, загрузившие материал на сайт
Если Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с сайта, Вы можете оставить жалобу на материал.
Автор материала
- На сайте: 7 лет и 3 месяца
- Подписчики: 2
- Всего просмотров: 184988
- Всего материалов: 97
Московский институт профессиональной
переподготовки и повышения
квалификации педагогов
Видео:Составление уравнений реакций горения. 11 класс.Скачать

Дистанционные курсы
для педагогов
663 курса от 690 рублей
Выбрать курс со скидкой
Выдаём документы
установленного образца!
Учителя о ЕГЭ: секреты успешной подготовки
Время чтения: 11 минут
Эвакуированные в Россию из ДНР и ЛНР дети смогут поступить в вузы по квоте
Время чтения: 1 минута
Минпросвещения рекомендует школьникам сдавать телефоны перед входом в школу
Время чтения: 1 минута
В России выросло число детей с ОВЗ, поступающих в колледжи
Время чтения: 1 минута
Путин объявил 2022-2031 годы Десятилетием науки и технологий
Время чтения: 1 минута
С 1 сентября в российских школах будут исполнять гимн России
Время чтения: 1 минута
Роспотребнадзор сообщил об опасности размещения вышек сотовой связи на территории школ
Время чтения: 1 минута
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
Видео:Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

Ответы на контрольную работу по теме «Металлы»(Габриелян)
Видео:Самый простой способ понять ХИМИЮ — Типы Кристаллических Решеток и Свойства ВеществаСкачать

Основные разделы
Видео:Как составлять ХИМИЧЕСКИЕ УРАВНЕНИЯ | 4 лайфхака - 95 ВСЕХ РЕАКЦИЙ в химии!Скачать

Контрольные работы
Видео:Решение задач по термохимическим уравнениям. Практическое занятие. Видеоурок 40. Химия 9 классСкачать

Ответы на контрольную работу по теме «Металлы»(Габриелян)
- Post category:Контрольные работы по химии 9 класс
- Reading time: 12 минут чтения
ЗАДАНИЕ 1
Напишите уравнения возможных реакций взаимодействия натрия и цинка с веществами: хлором, водой, соляной кислотой.
Рассмотрите одну из записанных реакций в свете ОВР.
2Nа + 2Н2О = 2NаОН + Н2
2Nа + 2НСl = 2NаСl + Н2
2Nа + Cl2 = 2NаСl
Zn + Cl2 = ZnCl2
Zn0 -2e→Zn2+ окисляется, восстановитель
Cl20+2e→2Cl- восстанавливается, окислитель
Zn + H2O = ZnO + H2.
Zn + 2HCl = ZnCl2 + H2
ЗАДАНИЕ 2
Напишите уравнения реакций, с помощью которых можно осуществить превращения по схеме
Fe →FeCl2 →Fe(N03)2 →Fe(OH)2 →FeO.
Превращение 3 рассмотрите в свете ТЭД.
Fe + 2HCl = FeCl2 + H2
FeCl2 + 2AgNO3 = 2AgCl + Fe(NO3)2
Fe(NO3)2 + 2NaOH = Fe(OH)2 + 2NaNO3
Fе2++ 2NO3-+ 2Na++2OH- =2Na++2NO3-+ Fе(ОН)2
Fе2++ 2OH- = Fе(ОН)2
Fе(ОН)2= FеО+ Н2О
ЗАДАНИЕ 3
При взаимодействии 12 г магния с избытком соляной кислоты выделилось 10 л водорода (н. у.). Вычислите объемную долю выхода продукта реакции.
Mg + 2HCl = MgCl2 + H2
n (Mg) = 12/24 = 0,5 моль
V (H2) = 10/22,4 = 0,446 моль
n (Mg) = n (H2) по уравнению (теор.)
выход = 0,446 /0,5 = 0,89 = 89 %
ЗАДАНИЕ 1
Напишите уравнения возможных реакций лития и меди с веществами: хлором, водой, соляной кислотой.
Рассмотрите одну из записанных реакций в свете ОВР.
2Li + Cl2 = 2LiCl
2Li + 2H2O = 2LiOH + H2
2Li + 2HCl = 2LiCl + H2
Cu + Cl2 = CuCl2
Cu + H2O = не реагирует
Cu + HCl = не реагирует
2Li+CL2= 2LiCL
Li- e—> Li+ восстановитель
CL2+2e—-> 2CL- окислитель
ЗАДАНИЕ 2
Напишите уравнения реакций, с помощью которых можно осуществить превращения по схеме
Са →CaO →Са(ОН)2 →Ca(N03)2 → Са3(Р04)2.
Превращение 3 рассмотрите в свете ТЭД.
2Ca+O2=2CaO
CaO+2NaOH=Ca(OH)2+Na2O
2HNO3 + Ca(OH)2 =Ca(NO3)2 + 2H2O
2H+ +2NO3- + Ca(OH)2 =Ca2+ +2NO3- + 2H2O
2H+ + Ca(OH)2 =Ca2+ +2H2O
3Ca(NO3)2 + 2Н3PO4 = Ca3(PO4)2 + 6HNO3
ЗАДАНИЕ 3
При термическом разложении 10 г известняка было получено 1,68 л углекислого газа (н. у.). Вычислите объемную долю выхода продукта реакции.
CaCO3 = CaO+CO2
n (CaCO3) = 10/100 = 0,1 моль
V (CO2) = 1,68/22,4 = 0,075 моль
n (CaCO3) = n (CO2) по уравнению (теор.)
выход = 0,075/0,1 = 0,75 = 75 %
ЗАДАНИЕ 1
Напишите уравнения возможных реакций кальция и железа с веществами: хлором, водой, соляной кислотой.
Рассмотрите одну из записанных реакций в свете ОВР.
Са + Cl2 = CaCl2
Ca + 2HCl = CaCl2 + H2
Ca + 2H2O = Ca(OH)2 + H2
2Fe + 3Cl2 = 2FeCl3
Fe + 2HCl = FeCl2 + H2
ЗАДАНИЕ 2
Напишите уравнения реакций, с помощью которых можно осуществить превращения по схеме:
Аl →Аl203 →АlСl3 →Аl(ОН)3 →Al(N03)3.
Превращение 3 рассмотрите в свете ТЭД.
4Al + 3O2 = 2 Al2O3
Al2O3 + 6HCl = 2AlCl3 + 3H2O
AlCl3 + 3NH3 + 3H2O = Al(OH)3 + 3NH4Cl
Al3+ +3Cl- + 3NH3 + 3H2O = Al(OH)3 + 3NH4+ +Cl-
Al3+ + 3NH3 + 3H2O = Al(OH)3 + 3NH4+
Аl(ОН)3+3НNО3=Аl(NО3)3+3Н2О.
ЗАДАНИЕ 3
При взаимодействии 23 г натрия с водой было получено 8,96 л водорода (н. у.). Найдите объемную долю выхода продукта реакции (в %).
2Na + 2H2O = 2NaOH + H2 ↑
n (Na) = 23/23= 1 моль
V (H2) = 8,96/22,4 = 0,4 моль
n (Na) : n (H2) = 2:1
n (H2) = 1/ 2 = 0,5 моль по уравнению (теор.)
выход = 0,4/0,5 = 0,8 = 80 %
ЗАДАНИЕ 1
Напишите уравнения возможных реакций металлов калия и магния с хлором, водой, соляной кислотой.
Рассмотрите одну из этих реакций в свете ОВР.
2K + 2H2O = 2KOH + H2.
2К + CI2 = 2КCI
2К + 2HCI = 2КCI + H2
Mg + 2HCl = MgCl2 + H2
Mg + Cl2 = MgCl2
Mg 0 -2e→ Mg 2+ окисляется, восстановитель
Cl20+2e→2Cl- восстанавливается, окислитель
Mg+2H2O=Mg(OH)2+H2
ЗАДАНИЕ 2
Напишите уравнения реакций для данных переходов:
Li →Li20 →LiOH →Li2S04.
Превращение 3 рассмотрите в свете ТЭД.
4Li + O2 = 2Li2O
Li2O + H2O = 2LiOH
2LiOH + Н2SO4 = Li2SO4 + 2Н2О
2Li+ +2OH- + 2Н+ +SO42- = 2Li+ +SO42- + 2Н2О
2OH- + 2Н+ — = 2Н2О
ЗАДАНИЕ 3
При взаимодействии 60 г кальция с водой выделилось 30 л водорода (н. у.). Найдите объемную долю выхода продукта реакции.
Са + 2Н2О = Са(ОН)2 + Н2
n (Са) = 60/40= 1,5 моль
V (H2) = 30/22,4 = 1,34 моль
n (Са) = n (H2) = по уравнению (теор.)
выход = 1,34/1,5 = 0,89 = 89 %
ЗАДАНИЕ 1
Напишите уравнения возможных реакций магния и алюминия с веществами: кислородом, бромом, разбавленной серной кислотой.
Рассмотрите две из этих реакций в свете ОВР, а одну — в свете ТЭД.
2 Мg + O2 = 2 МgО
Мg 0 -2e→ Мg 2+ окисляется, восстановитель
О20+4e→2 О 2- восстанавливается, окислитель
Мg + Br 2 = Мg Br2
Мg 0 -2e→ Мg 2+ окисляется, восстановитель
Br 20+2e→2 Br — восстанавливается, окислитель
Мg + Н2SO4 = МgSО4 + Н2
Мg + 2Н+ = Мg2+ + Н2
4Al + 3O2 = 2Al2O3,
2Al + 3H2SO4 = Al2(SO4)3 + 3H2
2Al + 3Br2 = 2AlBr3
ЗАДАНИЕ 2
Определите формулы веществ Х1 и Х2 в цепочке превращений:
Са →Х1 →Са(ОН)2 →Х2 →Са(НС03)2.
Напишите уравнения реакций, с помощью которых можно осуществить превращения по данной схеме.
2Ca+O2=2CaO
CaO+H2O=Ca(OH)2
Ca(OH)2 + CO2 = CaCO3 ↓ + H2O
CaCO3 + CO2 + H2O ↔ Ca(HCO3)2
ЗАДАНИЕ 3
При взаимодействии 12 г магния с избытком соляной кислоты выделилось 10 л водорода (н. у.). Вычислите объемную долю выхода продукта реакции (в %).
Mg + 2НСl = MgCl2 + Н2
n (Mg) = 12/24= 0,5 моль
n (H2) = n (Mg) по уравнению (теор.)
n (H2) = 10/22,4 = 0,44 моль (пр.)
ŋ = V (H2) (пр.)/ V (H2) (теор.) = n (H2) (пр.)/ n (H2) (теор.) = 0,44/0,5 = 0,89 = 89%
ЗАДАНИЕ 1
Напишите уравнения возможных реакций меди и магния с веществами: кислородом, иодом, разбавленной серной кислотой.
Рассмотрите две из этих реакций в свете ОВР, а одну — в свете ТЭД.
2Cu + O2 = 2CuO
2Cu + I2 = 2CuI
Cu + H2SO4 = не идет
2 Мg + O2 = 2 МgО
Мg 0 -2e→ Мg 2+ окисляется, восстановитель
О20+4e→2 О 2- восстанавливается, окислитель
Мg + Н2SO4 = МgSО4 + Н2
Мg + 2Н+ = Мg2+ + Н2
Мg + I 2 = Мg I 2
Мg 0 -2e→ Мg 2+ окисляется, восстановитель
I 20+2e→2 I — восстанавливается, окислитель
ЗАДАНИЕ 2
Определите формулы веществ X1 и Х2 в цепочке превращений:
Zn →Х1→ ZnS04 →Х2 →ZnO.
Напишите уравнения реакций, с помощью которых можно осуществить превращения по данной схеме.
2Zn + O2 = 2ZnO
ZnO+H2SO4 —>ZnSO4 + H2O
ZnSO4 + 2NaOH (разб.) = Zn(OH)2↓ + Na2SO4
Zn(OH)2= ZnO + H2O
ЗАДАНИЕ 3
При термическом разложении 10 г карбоната кальция было получено 1,68 л углекислого газа (н. у.). Вычислите объемную долю выхода продукта реакции.
CaCO3 → CaO + CO2
n (CaCO3) = 10/100= 0,1 моль
n (CO2) = n (CaCO3) по уравнению (теор.)
n (CO2) = 1,68/22,4 = 0,075 моль (пр.)
ŋ = V (CO2) (пр.)/ V (CO2) (теор.) = n (CO2) (пр.)/ n (CO2) (теор.) = 0,075/0,1 = 0,75 = 75%
ЗАДАНИЕ 1
Напишите уравнения возможных реакций железа и цинка с веществами: кислородом, хлором, разбавленной серной кислотой.
Рассмотрите две из этих реакций в свете ОВР, а одну — в свете ТЭД.
3Fe + 2O2 = Fe2O3 • FeO
Fe + Н2SO4 = FeSO4 + Н2
2Fe + 3Cl2 = 2FeCl3
2Zn + O2 = 2ZnO
Zn 0 -2e→ Zn 2+ окисляется, восстановитель
О20+4e→2 О 2- восстанавливается, окислитель
Zn + Cl2 = ZnCl2
Zn0 -2e→Zn2+ окисляется, восстановитель
Cl20+2e→2Cl- восстанавливается, окислитель
Zn + H2SO4 = ZnSO4 + H2
Zn + 2Н+ = Zn 2+ + Н2
ЗАДАНИЕ 2
Определите формулы веществ Х1 и Х2 в цепочке превращений:
Fe →Х1 →Fe(OH)2 →Х2 →Fe.
Напишите уравнения реакций, с помощью которых можно осуществить превращения по данной схеме.
Fe — 1 —> FeCl2 — 2 —> Fe (OH)2 — 3 —> FeO -4-> Fe
1. Fe + 2HCl —> FeCl2 + H2
2. FeCl2 + 2NaOH —> Fe(OH)2 + 2NaCl
Fe2+ + 2OH- —> Fe (OH)2
3. Fe (OH)2 — t —> FeO + H2O
4. FeO + C = Fe + CO
ЗАДАНИЕ 3
При взаимодействии 23 г натрия с водой было получено 8,96 л водорода (н. у.). Найдите объемную долю выхода продукта реакции.
2Na + 2H2O = 2NaOH + H2 ↑
n (Na) = 23/23= 1 моль
2n (H2) = n (Na) по уравнению (теор.)
n (H2) = 0,5 моль теор.
n (H2) = 8,96/22,4 = 0,4 моль (пр.)
ŋ = V (H2) (пр.)/ V (H2) (теор.) = n (H2) (пр.)/ n (H2) (теор.) = 0,4/0,5 = 0,8 = 80%
ЗАДАНИЕ 1
Напишите уравнения возможных химических реакций бериллия и железа с веществами: кислородом, бромом, разбавленной серной кислотой.
Рассмотрите две из этих реакций в свете ОВР, а одну — в свете ТЭД.
3Fe + 2O2 = Fe2O3 • FeO
Fe + Н2SO4 = FeSO4 + Н2
2Fe + 3Br 2 = 2Fe Br3
2 Ве + O2 = 2 ВеО
Ве0 -2e→ Ве 2+ окисляется, восстановитель
О20+4e→2 О 2- восстанавливается, окислитель
Ве + Br 2 = Ве Br2
Ве 0 -2e→ Ве 2+ окисляется, восстановитель
Br 20+2e→2 Br — восстанавливается, окислитель
Ве + Н2SO4 = Ве SО4 + Н2
Ве + 2Н+ = Ве 2+ + Н2
ЗАДАНИЕ 2
Определите формулы веществ Х1 и Х2 в цепочке превращений:
Fe → Х1 →Fe(OH)3 →Х2 →Fe.
Напишите уравнения реакций, с помощью которых можно осуществить превращения по данной схеме.
Fe 1→FeCl3 2→Fe(OH)3 3→Fe2O3 4→ Fe
1. 2Fe + 3Cl2 t →2FeCl3
2. FeCl3+ 3NaOH → Fe(OH)3 ↓ + 3NaCl
3. 2Fe(OH)3 t → Fe2O3 + H2O
4. 2Fe2O3 + 3C t → 4 Fe + 3CO2
ЗАДАНИЕ 3
При взаимодействии 60 г кальция с водой выделилось 30 л водорода (н. у.). Найдите объемную долю выхода продукта реакции (в %).
Ca + 2H2О = Ca(OH)2 + Н2
n (Ca) = 60/40= 1,5 моль
n (H2) = n (Ca) по уравнению (теор.)
n (H2) = 30/22,4 = 1,34 моль (пр.)
ŋ = V (H2) (пр.)/ V (H2) (теор.) = n (H2) (пр.)/ n (H2) (теор.) = 1,34/1,5 = 0,89 = 89%
ЗАДАНИЕ 1
Напишите уравнения возможных реакций магния, алюминия и серебра с неметаллом, водой, кислотой, раствором соли.
Реакции металлов с растворами кислоты и соли рассмотрите с точки зрения ОВР и ТЭД.
1. Mg + 2HCl = MgCl2 + H2
Mg + 2H+ = Mg2+ + H2
Mg0 — 2e = Mg2+ восстановитель
2H+ + 2e= H2 окислитель
Mg + Cl2 = MgCl2
Mg+2H2O=Mg(OH)2+H2
Mg + CuCl2 = MgCl2 + Cu
Mg0 + Cu2+ = Mg2+ + Cu0
Mg0 — 2e = Mg2+ восстановитель
Cu2+ + 2e= Cu0 окислитель
2. 2Al + 6HCl = 2AlCl3 + 3H2
2Al + 6H+ = 2Al3+ + 3H02
Al 0 — 3e = Al3+ восстановитель
2H+ + 2e= H2 окислитель
2Al + 3Cl2 = 2AlCl3
2Al + 6H2O = 2Al(OH)3 + 3H2
3HgCI2 + 2Al = 2AICI3 + 3Hg
3Hg2+ + 2Al0 = 2AI3+ + 3Hg0
Hg2+ + 2е = Hg0 восстановитель
Al0 – 3е= AI3+ окислитель
3. Ag + 2HCl = не реагирует
2Ag + S = Ag2S
Ag+ H2O = не реагирует
Ag + FeCl3 = AgCl + FeCl2
Ag0 + Fe3+= Ag++ Fe2+
Ag0 — 1е= Ag+ восстановитель
Fe3++1е= Fe2+окислитель
ЗАДАНИЕ 2
Определите формулы веществ Х1, Х2 и Х3 в цепочке превращений:
Напишите уравнения реакций, с помощью которых можно осуществить превращения по данной схеме.
2Ве + О2 = 2ВеО
ВеО +2HCl = BeCl2 + H2O
BeCl2 + 2NaOH = Be(OH)2 + 2NaCl
Be(OH)2 + 2NaOH= Na2BeO2 + 2H2O
ЗАДАНИЕ 3
При взаимодействии 12 г технического магния, содержащего 5% примесей, с избытком соляной кислоты, выделилось 10 л водорода (н. у.). Вычислите объемную долю выхода продукта реакции.
Mg + 2HCl = MgCl2 + H2
n(Mg) = 12-12*0,05/24 = 11,4 /24= 0,475 моль
n (H2) (теор.) = n(Mg) =0,475 моль
n (H2) = 10/22,4 = 0,44 моль (пр.)
ŋ = V (H2) (пр.)/ V (H2) (теор.) = n (H2) (пр.)/ n (H2) (теор.) = 0,44/0,475 = 0,92 = 92%
ЗАДАНИЕ 1
Напишите уравнения возможных реакций лития, меди, бария, алюминия с веществами: неметаллом, водой, кислотой, раствором соли.
Реакции металлов с растворами кислоты и соли рассмотрите с точки зрения ОВР и ТЭД.
1. 2Li + Сl2 = 2LiСl
2Li + 2H2O = 2LiOH + H2
2Li + 2НСl = 2LiСl + Н2
2Li0 + 2Н+ = 2Li+ + Н02
Li0 – 1e = Li+ восстановитель
2Н+ + 2e= Н02 окислитель
2Li + CuСl 2= 2LiС1 + Cu
2Li0 + Cu2+ = 2Li+ + Cu0
Li0 – 1e = Li+ восстановитель
Cu2+ + 2e= Cu0 окислитель
2. 2Al + 6HCl = 2AlCl3 + 3H2
2Al + 6H+ = 2Al3+ + 3H02
Al 0 — 3e = Al3+ восстановитель
2H+ + 2e= H2 окислитель
2Al + 3Cl2 = 2AlCl3
2Al + 6H2O = 2Al(OH)3 + 3H2
3HgCI2 + 2Al = 2AICI3 + 3Hg
3Hg2+ + 2Al0 = 2AI3+ + 3Hg0
Hg2+ + 2е = Hg0 восстановитель
Al0 – 3е= AI3+ окислитель
3. Ва + 2HCl = ВаCl2 + H2
Ва + 2H+ = Ва 2+ + H2
Ва 0 — 2e = Ва 2+ восстановитель
2H+ + 2e= H2 окислитель
Ва + Cl2 = ВаCl2
Ва +2H2O= Ва(OH)2+H2
Ва + CuCl2 = ВаCl2 + Cu
Ва + Cu2+ = Ва 2+ + Cu0
Ва 0 — 2e = Ва 2+ восстановитель
Cu2+ + 2e= Cu0 окислитель
4. Cu + Cl2 = CuCl2
Cu + H2O = не реагирует
Cu + HCl = не реагирует
Cu + 2FeCl3 = CuCl2 + 2FeCl2.
Cu 0 + Fe3+= Cu2 ++ Fe2+
Cu 0 — 2е= Cu + восстановитель
Fe3++1е= Fe2+окислитель
ЗАДАНИЕ 2
Определите формулы веществ Х1, Х2 и Х3 в цепочке превращений:
Напишите уравнения реакций, с помощью которых можно осуществить превращения по данной схеме.
Fe + 2HСl → FeCl2 + H2↑
FeCl2+ 2NaOH → Fe(OH)2 + 2NaCl
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3↓
2Fe(OH)3 = Fe2O3 + 3H2O
ЗАДАНИЕ 3
При термическом разложении 20 г известняка, содержащего 10% некарбонатных примесей, было получено 3,23 л углекислого газа (н. у.).
Вычислите объемную долю выхода продукта реакции (в %).
CaCO3 = CaO+CO2
n (CaCO3) = 20-20*0,1/100= 18/100=0,18 моль
V (CO2) = 3,23/22,4 = 0,145 моль (практ.)
n (CaCO3) = n (CO2) по уравнению (теор.)= 0,18 моль
выход = 0,145/0,18 = 0,801 = 80,1 %
ЗАДАНИЕ 1
Напишите уравнения возможных реакций кальция, железа и цинка с неметаллом, водой, кислотой, раствором соли.
Реакции металлов с растворами кислоты и соли рассмотрите с точки зрения ОВР и ТЭД.
1. Са + 2HCl = СаCl2 + H2
Са0 + 2H+ = Са 2+ + H2
Са 0 — 2e = Са 2+ восстановитель
2H+ + 2e= H2 окислитель
Са + Cl2 = СаCl2
Са +2H2O= Са(OH)2+H2
Са + CuCl2 = СаCl2 + Cu
Са + Cu2+ = Са 2+ + Cu0
Са 0 — 2e = Са 2+ восстановитель
Cu2+ + 2e= Cu0 окислитель
2.
2Fe + 3Cl2 t →2FeCl3
3. 2Zn + O2 = 2ZnO
Zn + H2O = ZnO + H2
Zn + H2SO4 = ZnSO4 + H2
Zn + 2Н+ = Zn 2+ + Н2
Zn 0 + 2H+ = Zn 2+ + H02
Zn 0 — 2e = Zn 2+ восстановитель
2H+ + 2e= H2 окислитель
Zn + CuSO4 = Cu + ZnSO4
Zn 0 + Cu2+ = Zn 2+ + Cu0
Zn 0 — 2e = Zn 2+ восстановитель
Cu2+ + 2e= Cu0 окислитель
ЗАДАНИЕ 2
Определите формулы веществ Х1, Х2 и Х3 в цепочке превращений:
Напишите уравнения реакций, с помощью которых можно осуществить превращения по данной схеме.
2Ca+O2=2CaO
CaО+H2O=Ca(OH)2
Ca(OH)2+H2CO3=CaCO3+2H2O
CaCO3 + CO2 + H2O ↔ Ca(HCO3)2
Ca(HCO3)2 t →CaCO3↓ + CO2 + H2O
ЗАДАНИЕ 3
Прй взаимодействии 24,15 г технического натрия, содержащего 5% примесей, было получено 8,96 л водорода (н. у.).
Вычислите объемную долю выхода продукта реакции (в %).
2Na + 2H2O = 2NaOH + H2
n(Na) = 24,15-24,15*0,05/23 =23 /23= 1 моль
n (H2) (теор.) = 0,5 n(Mg) =0,5 моль
n (H2) = 8,96/22,4 = 0,4 моль (пр.)
ŋ = V (H2) (пр.)/ V (H2) (теор.) = n (H2) (пр.)/ n (H2) (теор.) = 0,4/0,5 = 0,8 = 80%
ЗАДАНИЕ 1
Напишите уравнения возможных реакций бериллия, железа и меди с веществами: неметаллом, водой, кислотой, раствором соли.
Реакции металлов с растворами кислоты и соли рассмотрите с точки зрения ОВР и ТЭД.
1. 2 Ве + O2 = 2 ВеО
Ве + Н2SO4 = ВеSО4 + Н2
Ве + 2Н+ = Ве 2+ + Н2
2. Cu + Cl2 = CuCl2
Cu + H2O = не реагирует
Cu + HCl = не реагирует
Cu + 2FeCl3 = CuCl2 + 2FeCl2.
Cu 0 + Fe3+= Cu2 ++ Fe2+
Cu 0 — 2е= Cu + восстановитель
Fe3++1е= Fe2+окислитель
3. 2Fe + 3Cl2 t →2FeCl3
ЗАДАНИЕ 2
Определите формулы веществ Х1, Х2 и Х3 в цепочке превращений:
Напишите уравнения реакций, с помощью которых можно осуществить превращения по данной схеме.
2Zn + O2 = 2ZnO
ZnO + 2HNO3 = Zn(NO3)2 + H2O
Zn(NO3)2 + 2NaOH = 2NaNO3 + Zn(OH)2
Zn(OH)2= ZnO + H2O
ЗАДАНИЕ 3
При взаимодействии 60 г технического кальция, содержащего 2% примесей, с водой было получено 30 л водорода (н. у.). Вычислите объемную долю выхода продукта реакции.
Ca + 2H2О = Ca(OH)2 + Н2
n(Ca) = 60-60*0,02/40 =58,8 /40= 1,47 моль
n (H2) (теор.) = n(Ca) =1,47 моль
n (H2) = 30/22,4 = 1.34 моль (пр.)
ŋ = V (H2) (пр.)/ V (H2) (теор.) = n (H2) (пр.)/ n (H2) (теор.) = 1,34/1,47 = 0,91 = 91%
🎬 Видео
Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Химия 9 класс — Как определять Степень Окисления?Скачать

9 класс. Реакции ионного обмена. Ионные уравнения.Скачать