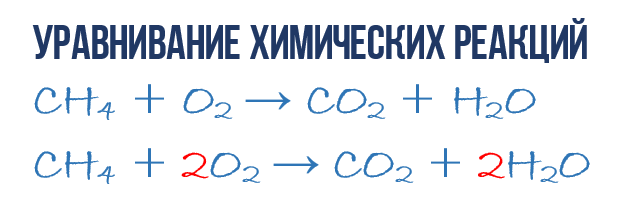В уроке 13 «Составление химических уравнений» из курса «Химия для чайников» рассмотрим для чего нужны химические уравнения; научимся уравнивать химические реакции, путем правильной расстановки коэффициентов. Данный урок потребует от вас знания химических основ из прошлых уроков. Обязательно прочитайте об элементном анализе, где подробно рассмотрены эмпирические формулы и анализ химических веществ.
- Химическое уравнение
- Уравнивание химических реакций
- Коэффициенты в уравнениях химических реакций
- Химические уравнения Цели. Познакомить учащихся с понятием «химическое уравнение», научить составлять уравнения реакций, закрепить навыки составления формул по валентности элементов, стимулировать познавательную деятельность учащихся через дидактические игры, настроить их на использование имеющихся знаний для изучения нового материала. Мотивация. Что такое химические уравнения и зачем они нужны? Оборудование и реактивы (на столе учителя). Спиртовка, держатель; железо, сера. Ориентация. Ау! Где мы находимся? (Учащиеся знают химические формулы веществ, понятие «химическая реакция», но пока не умеют записывать уравнения реакций.) Целеполагание (чем конкретно займемся на уроке). Мотивация (зачем нужны химические уравнения). Ау! Где мы находимся? Вы – исследователи, которым необходимо ответить на один-единственный вопрос: что такое химическое уравнение? В нашу исследовательскую лабораторию пришел заказ изучить и создать общее представление о химическом уравнении. Разминка для эрудитов 1. Что изучает химия? 2. Что такое вещество? (Это определенный вид материи, то, из чего состоит тело. Примеры веществ – сера, железо, вода.) 3. Как мы выражаем состав вещества? (С помощью химических формул.) 4. Как составить химическую формулу? Что для этого необходимо знать? (Химические знаки элементов, валентность.) 5. Что такое валентность? (Это свойство атома присоединять определенное число других атомов.) Повторим валентности некоторых элементов (игра в мяч). Один ученик бросает мяч другому и называет химический элемент из ряда: H, O, S, Fe, Cu, Al, Na, Cl. Ученик, который ловит мяч, называет валентность данного элемента. К нам пришла телеграмма, но запись на ней частично исчезла, необходимо ее восстановить: В этом задании требуется определить валентности элементов, а затем расставить индексы в химических формулах. Работаем по восстановлению записи. Ученик, который справится с заданием быстрее всех, записывает на доске ответ: При этом он вслух проговаривает алгоритм составлений формул по валентности: что он делает сначала, откуда берет значения валентности элементов, как составляет формулу по валентности. А что вам известно об уравнении вообще? На каких предметах вы встречались с уравнениями? (Учащиеся говорят, что используют уравнения на математике и физике.) Уравнение – это математическое равенство с одной или несколькими неизвестными величинами. Что такое, по-вашему, химическое уравнение? (Версии учащихся.) Демонстрационный опыт. Взаимодействие железа с серой Возьмем железо и серу в соотношении по массе 7:4. В семи частях железа находится столько же атомов, сколько в четырех частях серы. Нагреем смесь. Что произошло? (Протекает химическая реакция.) По каким признакам мы судим, что произошла реакция? Какие условия необходимы для проведения опыта? (Нагревание, тесное соприкосновение исходных веществ.) Чем отличаются химические реакции от физических явлений? Как можно выразить (записать) химическую реакцию? (В виде химического уравнения.) Составим уравнение реакции на доске: Где мы сегодня уже встречали формулу FeS? (В телеграмме.) Какой закон необходимо применять при составлении химических уравнений? О чем он гласит? (Масса веществ, вступивших в химическую реакцию, равна массе образующихся веществ.) Лабораторный опыт. Прокаливание медной проволоки Обозначим медную проволоку знаком Cu, кислород воздуха – О2. Что нужно для составления химического уравнения? Порядок действий следующий: а) записать формулы исходных веществ; б) составить формулу продукта реакции справа от знака равенства; в) уравнять число атомов в правой и левой частях уравнения по закону сохранения массы веществ: Сформулируем определение химического уравнения. Химическое уравнение – это условная запись хода химической реакции с помощью формул и коэффициентов. К нам пришло письмо. Ученик провел опыт, описал его, но не смог составить уравнение реакции и обратился к нам за помощью. Вот текст письма: «Нагретый железный порошок внесли в колбу с газом желто-зеленого цвета – хлором, молекулы которого двухатомны. Порошок воспламенился, в результате появился коричневый дым, образованный частичками хлорида железа(III)». Давайте поможем ученику. Запишите уравнение реакции: Итак, сегодня мы узнали, что такое химическое уравнение. На трех примерах рассмотрели, что нужно для составления химического уравнения. Пока остается неясным, зачем нужны уравнения реакций. Вот мы и обозначили задачу, над которой будем работать на последующих уроках. Самоконтроль и самооценка Учитель подводит итоги: чему научились на уроке, какие моменты требуют дальнейшей отработки. Выслушивает мнения учащихся по этим вопросам, благодарит их за работу на уроке. Химические уравнения: как решать максимально эффективно Химическим уравнением можно назвать визуализацию химической реакции с помощью знаков математики и химических формул. Такое действие является отображением какой-либо реакции, в процессе которой появляются новые вещества. Химические задания: виды Химическое уравнение – это последовательность химических реакций. Они основываются на законе сохранения массы каких-либо веществ. Существует всего два вида реакций: Соединения – к ним относятся реакции замещения (происходит замена атомов сложных элементов атомами простых реагентов), обмена (замещение составными частями двух сложных веществ), нейтрализации (реакция кислот с основаниями, образование соли и воды). Разложения – образование двух и более сложных или простых веществ из одного сложного, но состав их более простой. Химические реакции также можно разделить на типы: экзотермические (происходят с выделением теплоты) и эндотермические (поглощение теплоты). Как решать уравнения химических реакций Этот вопрос волнует многих учащихся. Мы предлегаем несколько простых советов, которые подскажут, как научиться решать химические уравнения: Желание понять и освоить. Нельзя отступать от своей цели. Теоретические знания. Без них невозможно составить даже элементарную формулу соединения. Правильность записи химической задачи – даже малейшая ошибка в условии сведет к нулю все ваши усилия в ее решении. Желательно, чтобы сам процесс решения химических уравнений был для вас увлекательным. Тогда химические уравнения (как решать их и какие моменты нужно запомнить, мы разберем в этой статье) перестанут быть для вас проблемными. Задачи, которые решаются с использованием уравнений химических реакций К таким задачам относятся: Нахождение массы компонента по данной массе другого реагента. Задания по комбинации «масса-моль». Расчеты по комбинации «объем-моль». Примеры с применением термина «избыток». Расчеты с использованием реагентов, один из которых не лишен примесей. Задачи на распад результата реакции и на производственные потери. Задачи на поиск формулы. Задачи, в которых реагенты предоставлены в виде растворов. Задачи, содержащие смеси. Каждый из этих видов задач включает в себя несколько подтипов, которые обычно подробно рассматриваются еще на первых школьных уроках химии. Химические уравнения: как решать Существует алгоритм, который помогает справиться с практически любым заданием из этой непростой науки. Чтобы понять, как правильно решать химические уравнения, нужно придерживаться определенной закономерности: При записи уравнения реакции не забывать расставлять коэффициенты. Определение способа, с помощью которого можно найти неизвестные данные. Правильность применения в выбранной формуле пропорций или использование понятия «количество вещества». Обратить внимание на единицы измерений. В конце важно обязательно проверить задачу. В процессе решения вы могли допустить элементарную ошибку, которая повлияла на результат решения. Основные правила составления химических уравнений Если придерживаться правильной последовательности, то вопрос о том, что такое химические уравнения, как решать их, не будет вас волновать: Формулы веществ, которые вступают в реакцию (реагенты), записываются в левой части уравнения. Формулы веществ, которые образуются в результате реакции, записываются уже в правой части уравнения. Составление уравнения реакции основывается на законе сохранения массы веществ. Следовательно, обе части уравнения должны быть равны, т. е. с одинаковым числом атомов. Достичь этого можно при условии правильной расстановки коэффициентов перед формулами веществ. Расстановка коэффициентов в химическом уравнении Алгоритм расстановки коэффициентов таков: Подсчет в левой и правой части уравнения атомов каждого элемента. Определение меняющегося количества атомов у элемента. Также нужно найти Н.О.К. Получение коэффициентов достигается путем деления Н.О.К. на индексы. Обязательно проставить данные цифры перед формулами. Следующим шагом является пересчет количества атомов. Иногда возникает необходимость в повторении действия. Уравнивание частей химической реакции происходит с помощью коэффициентов. Расчет индексов производится через валентность. Для успешного составления и решения химических уравнений необходимо учитывать физические свойства вещества, такие как объем, плотность, масса. Также нужно знать состояние реагирующей системы (концентрация, температура, давление), разбираться в единицах измерения данных величин. Для понимания вопроса о том, что такое химические уравнения, как решать их, необходимо использование основных законов и понятий этой науки. Чтобы успешно вычислять подобные задачи, необходимо также вспомнить или освоить навыки математических операций, уметь совершать действия с числами. Надеемся, с нашими советами вам будет легче справляться с химическими уравнениями.
- Химические уравнения: как решать максимально эффективно
- Химические задания: виды
- Как решать уравнения химических реакций
- Задачи, которые решаются с использованием уравнений химических реакций
- Химические уравнения: как решать
- Основные правила составления химических уравнений
- Расстановка коэффициентов в химическом уравнении
- 📽️ Видео
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Химическое уравнение
В результате реакции горения метана CH4 в кислороде O2 образуются диоксид углерода CO2 и вода H2O. Эта реакция может быть описана химическим уравнением:
Попробуем извлечь из химического уравнения больше сведений, чем просто указание продуктов и реагентов реакции. Химичекое уравнение (1) является НЕполным и потому не дает никаких сведений о том, сколько молекул O2 расходуется в расчете на 1 молекулу CH4 и сколько молекул CO2 и H 2 O получается в результате. Но если записать перед соответствующими молекулярными формулами численные коэффициенты, которые укажут сколько молекул каждого сорта принимает участие в реакции, то мы получим полное химическое уравнение реакции.
Для того, чтобы завершить составление химического уравнения (1), нужно помнить одно простое правило: в левой и правой частях уравнения должно присутствовать одинаковое число атомов каждого сорта, поскольку в ходе химической реакции не возникает новых атомов и не происходит уничтожение имевшихся. Данное правило основывается на законе сохранения массы, который мы рассмотрели в начале главы.
Видео:Уравнения химический реакций на ОГЭ: как составлять без ошибок?Скачать

Уравнивание химических реакций
Уравнивание химических реакций нужно для того, чтобы из простого химического уравнения получить полное. Итак, перейдем к непосредственному уравниванию реакции (1): еще раз взгляните на химическое уравнение, в точности на атомы и молекулы в правой и левой части. Нетрудно заметить, что в реакции участвуют атомы трех сортов: углерод C, водород H и кислород O. Давайте подсчитаем и сравним количество атомов каждого сорта в правой и левой части химического уравнения.
Начнем с углерода. В левой части один атом С входит в состав молекулы CH4, а в правой части один атом С входит в состав CO2. Таким образом в левой и в правой части количество атомов углерода совпадает, поэтому его мы оставляем в покое. Но для наглядности поставим коэффициент 1 перед молекулами с углеродом, хоть это и не обязательно:
Затем переходим к подсчету атомов водорода H. В левой части присутствуют 4 атома H (в количественном смысле H4 = 4H) в составе молекулы CH4, а в правой – всего 2 атома H в составе молекулы H2O, что в два раза меньше чем в левой части химического уравнения (2). Будем уравнивать! Для этого поставим коэффициент 2 перед молекулой H2O. Вот теперь у нас и в реагентах и в продуктах будет по 4 молекулы водорода H:
Обратите свое внимание, что коэффициент 2, который мы записали перед молекулой воды H2O для уравнивания водорода H, увеличивает в 2 раза все атомы, входящие в ее состав, т.е 2H2O означает 4H и 2O. Ладно, с этим вроде бы разобрались, осталось подсчитать и сравнить количество атомов кислорода O в химическом уравнении (3). Сразу бросается в глаза, что в левой части атомов O ровно в 2 раза меньше чем в правой. Теперь-то вы уже и сами умеете уравнивать химические уравнения, поэтому сразу запишу финальный результат:
Как видите, уравнивание химических реакций не такая уж и мудреная штука, и важна здесь не химия, а математика. Уравнение (4) называется полным уравнением химической реакции, потому что в нем соблюдается закон сохранения массы, т.е. число атомов каждого сорта, вступающих в реакцию, точно совпадает с числом атомов данного сорта по завершении реакции. В каждой части этого полного химического уравнения содержится по 1 атому углерода, по 4 атома водорода и по 4 атома кислорода. Однако стоит понимать пару важных моментов: химическая реакция — это сложная последовательность отдельных промежуточных стадий, и потому нельзя к примеру истолковывать уравнение (4) в том смысле, что 1 молекула метана должна одновременно столкнуться с 2 молекулами кислорода. Процессы происходящие при образовании продуктов реакции гораздо сложнее. Второй момент: полное уравнение реакции ничего не говорит нам о ее молекулярном механизме, т.е о последовательности событий, которые происходят на молекулярном уровне при ее протекании.
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Коэффициенты в уравнениях химических реакций
Еще один наглядный пример того, как правильно расставить коэффициенты в уравнениях химических реакций: Тринитротолуол (ТНТ) C7H5N3O6 энергично соединяется с кислородом, образуя H2O, CO2 и N2. Запишем уравнение реакции, которое будем уравнивать:
Проще составлять полное уравнение, исходя из двух молекул ТНТ, так как в левой части содержится нечетное число атомов водорода и азота, а в правой — четное:
- 2C7H5N3O6 + O2 → CO2 + H2O + N2 (6)
Тогда ясно, что 14 атомов углерода, 10 атомов водорода и 6 атомов азота должны превратиться в 14 молекул диоксида углерода, 5 молекул воды и 3 молекулы азота:
Теперь в обеих частях содержится одинаковое число всех атомов, кроме кислорода. Из 33 атомов кислорода, имеющихся в правой части уравнения, 12 поставляются двумя исходными молекулами ТНТ, а остальные 21 должны быть поставлены 10,5 молекулами O2. Таким образом полное химическое уравнение будет иметь вид:
Можно умножить обе части на 2 и избавиться от нецелочисленного коэффициента 10,5:
Но этого можно и не делать, поскольку все коэффициенты уравнения не обязательно должны быть целочисленными. Правильнее даже составить уравнение, исходя из одной молекулы ТНТ:
Полное химическое уравнение (9) несет в себе много информации. Прежде всего оно указывает исходные вещества — реагенты, а также продукты реакции. Кроме того, оно показывает, что в ходе реакции индивидуально сохраняются все атомы каждого сорта. Если умножить обе части уравнения (9) на число Авогадро NA=6,022·10 23 , мы сможем утверждать, что 4 моля ТНТ реагируют с 21 молями O2 с образованием 28 молей CO2, 10 молей H2O и 6 молей N2.
Есть еще одна фишка. При помощи таблицы Менделеева определяем молекулярные массы всех этих веществ:
- C 7 H 5 N 3 O 6 = 227,13 г/моль
- O 2 = 31,999 г/моль
- CO 2 = 44,010 г/моль
- H 2 O = 18,015 г/моль
- N 2 = 28,013 г/моль
Теперь уравнение 9 укажет еще, что 4·227,13 г = 908,52 г ТНТ требуют для осуществления полной реакции 21·31,999 г = 671,98 г кислорода и в результате образуется 28·44,010 г = 1232,3 г CO2, 10·18,015 г = 180,15 г H2O и 6·28,013 г = 168,08 г N2. Проверим, выполняется ли в этой реакции закон сохранения массы:
| Реагенты | Продукты | |
| 908,52 г ТНТ | 1232,3 г CO 2 | |
| 671,98 г CO 2 | 180,15 г H 2 O | |
| 168,08 г N 2 | ||
| Итого | 1580,5 г | 1580,5 г |
Но необязательно в химической реакции должны участвовать индивидуальные молекулы. Например, реакция известняка CaCO 3 и соляной кислоты HCl, с образованием водного раствора хлорида кальция CaCl 2 и диоксида углерода CO 2 :
Химическое уравнение (11) описывает реакцию карбоната кальция CaCO3 (известняка) и хлористоводородной кислоты HCl с образованием водного раствора хлорида кальция CaCl2 и диоксида углерода CO2. Это уравнение полное, так как число атомов каждого сорта в его левой и правой частях одинаково.
Смысл этого уравнения на макроскопическом (молярном) уровне таков: 1 моль или 100,09 г CaCO3 требует для осуществления полной реакции 2 моля или 72,92 г HCl, в результате чего получается по 1 молю CaCl2 (110,99 г/моль), CO2 (44,01 г/моль) и H2O (18,02 г/моль). По этим численным данным нетрудно убедиться, что в данной реакции выполняется закон сохранения массы.
Интерпретация уравнения (11) на микроскопическом (молекулярном) уровне не столь очевидна, поскольку карбонат кальция представляет собой соль, а не молекулярное соединение, а потому нельзя понимать химическое уравнение (11) в том смысле, что 1 молекула карбоната кальция CaCO3 реагирует с 2 молекулами HCl. Тем более молекула HCl в растворе вообще диссоциирует (распадается) на ионы H + и Cl — . Таким образом более правильным описанием того, что происходит в этой реакции на молекулярном уровне, дает уравнение:
Здесь в скобках сокращенно указано физическое состояние каждого сорта частиц (тв. — твердое, водн. — гидратированный ион в водном растворе, г. — газ, ж. — жидкость).
Уравнение (12) показывает, что твердый CaCO3 реагирует с двумя гидратированными ионами H + , образуя при этом положительный ион Ca 2+ , CO2 и H2O. Уравнение (12) как и другие полные химические уравнения не дает представления о молекулярном механизме реакции и менее удобно для подсчета количества веществ, однако, оно дает лучшее описание происходящего на микроскопическом уровне.
Закрепите полученные знания о составлении химических уравнений, самостоятельно разобрав пример с решением:
Надеюсь из урока 13 «Составление химических уравнений» вы узнали для себя что-то новое. Если у вас возникли вопросы, пишите их в комментарии.
Видео:8 класс. Составление уравнений химических реакций.Скачать

Химические уравнения
Цели. Познакомить учащихся с понятием «химическое уравнение», научить составлять уравнения реакций, закрепить навыки составления формул по валентности элементов, стимулировать познавательную деятельность учащихся через дидактические игры, настроить их на использование имеющихся знаний для изучения нового материала.
Мотивация. Что такое химические уравнения и зачем они нужны?
Оборудование и реактивы (на столе учителя). Спиртовка, держатель; железо, сера.
Ориентация. Ау! Где мы находимся? (Учащиеся знают химические формулы веществ, понятие «химическая реакция», но пока не умеют записывать уравнения реакций.)
Целеполагание (чем конкретно займемся на уроке).
Мотивация (зачем нужны химические уравнения).
 |