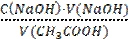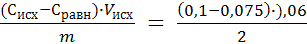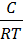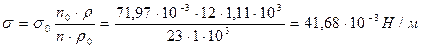В этой лабораторной работе исследуют адсорбцию из раствора уксусной кислоты на активированном угле. Перед началом работы споласкивают дистиллированной водой рабочие колбы, пипетки и колбу для задачи. В колбу для задачи в лаборантской получают исходный раствор уксусной кислоты. Из него следующим образом приготовляют растворы различной концентрации посредством разбавления вдвое.
В 5 колб (№№ 2-6) на 100 мл пипеткой наливают по 50 мл дистиллированной воды. В оставшуюся колбу (№ 1) наливают 50 мл исходного раствора. Затем снова отбирают 50 мл исходного раствора из колбы с задачей и добавляют его в колбу с водой (№ 2). Хорошо взбалтывают и споласкивают полученным раствором пипетку, набирая полученный раствор в пипетку и выливая его обратно в колбу.
Затем отбирают 50 мл полученного раствора (№ 2) этой же пипеткой и добавляют в следующую колбу с водой (№ 3). Хорошо перемешивают и моют полученным раствором пипетку как в случае предыдущего раствора. Отбирают 50 мл полученного раствора (№ 3) и так далее до тех пор, пока не получают 6 растворов, включая исходный. Объем приготовленных растворов во всех колбах должен быть 50 мл, поэтому из последней колбы (№ 6) 50 мл раствора отбирают пипеткой и выливают в раковину. Затем в каждую из шести колб добавляют по 1 г адсорбента – активированного угля; при этом необходимое количество угля отмеряют пробиркой, насыпая уголь до метки.
Колбы с углем встряхивают, перемешивая содержимое, и оставляют на 40 минут. В это время определяют концентрацию исходного раствора уксусной кислоты посредством титрования трех аликвот по 10 мл раствором NaOH в присутствии индикатора фенолфталеина. Добавлять щелочь, находящуюся в бюретках, необходимо до неисчезающего светло — розового цвета раствора (концентрация щелочи различается для двух рабочих столов и указана на бутылях). Результаты титрования записывают в таблицу 20.1.
| № пробы |  , мл , мл |  , мл , мл |  , М , М |  , М , М |
| 28.7 | 0.3157 | |||
| 28.8 | 0.3168 | 0.3168 | ||
| 28.9 | 0.3179 |
По уравнению 

По истечении 40 минут отфильтровывают раствор, отбрасывая первые порции фильтрата (около 10 мл), и отбирают аликвоты (по три порции каждого раствора) из оставшегося фильтрата. Можно поступить и другим способом: поочередно, начиная с самого разбавленного раствора, из колбочек с углем, не фильтруя, отбирают аликвоту 10 мл, погружая кончик пипетки вглубь раствора, но не касаясь при этом угля. Следует отметить, что для всех шести исследуемых растворов необходимо применять один и тот же способ взятия аликвот.
Для каждой из шести колб посредством титрования следует определить равновесную концентрацию уксусной кислоты после адсорбции (С). Начинать титрование лучше всего с самого разбавленного раствора (№ 6), предварительно сполоснув дистиллированной водой пипетку на 10 мл и колбы для титрования.
Закончив измерения, необходимо вылить остатки рабочих растворов вместе с углем в соответствующую емкость, сполоснуть колбы и пипетки дистиллированной водой.
Полученные при титровании данные, так же как при титровании исходного раствора, записывают в протокол опыта. Затем вычисляют количество вещества (в ммоль), находящегося в 50 мл до ( 

Полученные данные записывают в таблицу 20.2.
| № опыта | Количество вещества в исходном растворе (до адсорбции) | Количество вещества в фильтрате (после адсорбции) | Сорбированное количество кислоты на 1 г угля, ммоль/г  | |
| С0, М | в 50 мл, А, ммоль | С, М | в 50 мл, F, ммоль | |
| 0.3168 | 15.84 | 0.3028 | 15.14 | 0.7 |
| 0.1584 | 7.92 | 0.1463 | 7.315 | 0.605 |
| 0.0792 | 3.96 | 0.0715 | 3.575 | 0.385 |
| 0.0396 | 1.98 | 0.0352 | 1.76 | 0.22 |
| 0.0198 | 0.99 | 0.0187 | 0.935 | 0.055 |
| 0.0099 | 0.495 | 0.0093 | 0.45 | 0.045 |
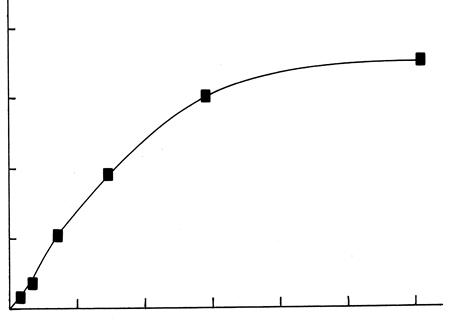
Эти данные используют для построения изотермы адсорбции (рис. 20.1), откладывая по оси абсцисс значения равновесной концентрации С (М), а по оси ординат – количество вещества, адсорбированное одним граммом угля 
 |
Рис. 20.1. Изотерма адсорбции.
Для нахождения констант K и 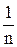
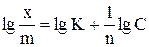


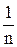
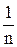
| № опыта | —  | — lg C |
| 0.15 | 0.527 | |
| 0.2182 | 0.835 | |
| 0.4145 | 1.146 | |
| 0.658 | 1.453 | |
| 1.259 | 1.744 | |
| 1.34 | 2.05 |
Рис.20.2. Определение констант уравнения Фрейндлиха.
В нашем случае 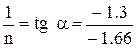

Видео:5.1. Адсорбция. Классификация адсорбцииСкачать

Уравнения изотермы адсорбции
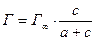
где Г¥ – предельная адсорбция; с – равновесная концентрация адсорбата; а – величина, обратная константе адсорбционного равновесия.
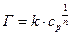
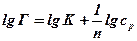
где k и n – эмпирические константы Фрейндлиха.
Г¥ и константы (K и 1/n), характеризующие процесс адсорбции находятся с помощью построения изотерм по Ленгмюру и Фрейндлиху.
Пример 26. К 60 мл раствора уксусной кислоты с концентрацией раствора 0,1 моль/л добавили 2 г адсорбента и взболтали. После достижения равновесия пробу раствора объёмом 10 мл оттитровали раствором гидроксида натрия с концентрацией 0,05 моль/л. На титрование затрачено 15 мл титранта. Рассчитайте величину адсорбции уксусной кислоты.
Решение. 1. Найдём равновесную концентрация раствора уксусной кислоты по результатам титрования:
Сравн(СН3СООН) =
Сравн(СН3СООН) = 0,05 × 15 / 10 = 0,075 моль/л
2. Рассчитываем величину адсорбции уксусной кислоты по формуле:
Г(СН3СООН) = 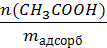
Г(СН3СООН) = 7,5 ∙ 10 -4 моль/г = 0,75 ммоль/ г
Пример 27. Определите величину адсорбции кислоты С8Н17СООН на поверхности водного раствора при 10 0 С, если массовая доля кислоты в растворе 0,005%. Поверхностное натяжение чистой воды и раствора при этой температуре равны соответственно 74,22 ∙ 10 -3 и 57,0 ∙ 10 -3 Дж/м 2 .
Решение.
1. Для расчёта адсорбции Г на поверхности раствора воспользуемся уравнением Гиббса:
Г = — 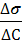
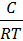
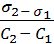
В уравнении Гиббса величина С2 означает молярную концентрацию кислоты, С1 = 0 (чистая вода).
2. Считая, что плотность разбавленного раствора кислоты около 1 г/мл (т.е. такая же, как и воды), используя ω% кислоты, находим, что в 100 мл раствора содержится 0,005 г кислоты. Молярная масса кислоты равна 158 г/моль, поэтому молярная концентрация раствора будет:
СМ = 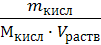
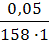
3. В уравнение Гиббса подставляем необходимые данные:
Г = — 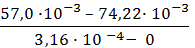
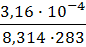
Ответ: 7,3 ∙ 10 -6 моль/м 2
Пример 28. Экспериментально установлено, что максимальная величина адсорбции ПАВ (М = 60 гмоль) некоторым адсорбентом составляет 5,0 ∙ 10 3 мольг. Величина аравна 0,06 моль/л. Какая масса (в граммах) вещества адсорбировалась двумя граммами данного адсорбента из раствора, если равновесная концентрация ПАВ стала равна 0,1 моль/л?
Решение. 1. Рассчитываем величину адсорбции ПАВ по уравнению Лэнгмюра:
Г = 5,0 ∙ 10 -3 × 0,1 / (0,06 + 0,1) = 3,125 ∙ 10 -3 (моль/г)
2. Количество адсорбированного вещества на адсорбенте массой 2 г будет в 2 раза больше:
nПАВ = 3,125 ∙ 10 -3 моль/г ∙ 2г = 6,25 ∙ 10 -3 моль
3. Масса адсорбированного вещества будет равна:
mПАВ = т∙М = 6,25 ∙ 10 -3 ∙ 60 = 0,375 г
Ответ: m адсорбированного ПАВравна 0,375 г.
Пример 29. Найдите поверхностное натяжение водного раствора валериановой кислоты, если сталагмометрическим методом получено: число капель раствора валериановой кислоты 23, воды 12. Плотность раствора и воды соответственно равны: 1,11× 10 3 кг/м 3 и 1 × 10 3 кг/м 3 ; поверхностное натяжение воды при 25°С равно 71,97 × 10 -3 Н/м.
Решение: расчет поверхностного натяжения проводим по формуле:
Типовые задачи.
33. Чему равно поверхностное натяжение водного раствора амилового спирта, если число капель этого раствора, вытекающего из сталагмометра, равно 72, а число капель воды – 60? Поверхностное натяжение воды при 293 К равно72,8 ∙ 10 -3 Дж/м 2 (плотность раствора принять равной 1 г/см 3 ).
34. При 20 0 С поверхностное натяжение 0,2 М водного раствора ПАВ равно 55 ∙ 10 -3 Дж/м 2 . Вычислите величину адсорбции ПАВ (поверхностное натяжение воды при 20 0 С равно 75,75 ∙ 10 -3 Дж/м 2 ).
35. При концентрации 0,125 моль/л поверхностное натяжение метилпропанола равно 52,8 мН/м, а метилбутанола 47,6 мН/м. При концентрации 0,250 моль/л поверхностное натяжение метилпропанола равно 44,1 мН/м, а метилбутанола 23,7 мН/м. Сравните поверхностную активность метилпропанола и метилбутанола в водных растворах в данном интервале концентраций. Выполняется ли правило Дюкло-Траубе?
Видео:Лабораторная работа №16. Свойства уксусной кислоты. 9 класс.Скачать

Изучение адсорбции уксусной кислоты углем и определение констант равновесия Ленгмюра
«Изучение адсорбции уксусной кислоты углем и определение констант равновесия Ленгмюра»
Построить изотерму адсорбции уксусной кислоты углём и определить константы уравнения Ленгмюра.
Из одномолярного раствора уксусной кислоты путём последовательного двухкратного разбавления дистиллированной водой приготовили в пронумерованных колбах на 200 см3 по 50 см3 растворов следующих концентраций: 0,5 M; 0,25 М; 0,125 М; 0,0625 М; 0,03125 M (100 см3).
В каждую колбу с раствором добавили указанные преподавателем количества (обычно 13 г ) активированного угля. Колбы закрыли пробками и на 20 мин оставили стоять, взбалтывая по очереди содержимое каждой колбы.
За это время определили концентрацию исходного раствора кислоты. Титровали 10 см3 раствора уксусной кислоты 0,1N раствором NаОН в присутствии фенолфталеина.
После встряхивания растворы отфильтровывали в чистые и сухие колбы, отбросив первые порции фильтрата в количестве 5-10 см3. Равновесную концентрацию раствора кислоты (СP) нашли путем титрования щелочью проб фильтратов, взятых в следующих количествах (см3): 1) 10; 2) 10; 3) 25; 4) 25; 5) 50.
Обработка экспериментальных данных
1 Концентрацию исходного раствора кислоты СK (г-моль/дм3) вычисляют по формуле
где VЩ — объём щелочи, пошедшей на титрование, VК — объём взятого для титрования раствора кислоты.
2 Начальные концентрации растворов кислоты (СН), полученных разбавлением раствора с концентрацией (СО), находят расчетным путём по формуле:
где n — кратность разбавления (т.е. 2, 4, 8, 16, 32).



3 Рассчитывают величину удельной адсорбции Г (ммоль/г) по формуле:
где V — объем раствора, взятого для адсорбции, см3; m — масса адсорбента, г; СP — равновесная концентрация раствора кислоты (определяется так же, как по уравнению 1 ).



Экспериментальные и расчетные данные заносят в таблицу 1.
кислота уксусный адсорбция
Таблица 1 — Экспериментальные и расчетные данные
🔍 Видео
Изучение адсорбции уксусной кислоты из водного раствора на активированном углеСкачать

Уравнение ЛенгмюраСкачать

лекция 4 Протолитическая теория Буферные системы Решение задачСкачать

Химия 41. Состав уксуса. Уксусная кислота — Академия занимательных наукСкачать

Адсорбция на твёрдой поверхностиСкачать

АдсорбцияСкачать

Коллоидная химия. Лекция 1. Физико-химия поверхностных явленийСкачать

Адсорбция на поверхностях растворовСкачать

Поверхностные явления: адгезия, смачивание, адсорбция | Коллоидная химияСкачать

Получение уксусной кислоты из ацетата натрия (Synthesis of acetic acid from sodium acetate)Скачать

Практическое занятие 5. Уравнение БЭТ. Удельная поверхностьСкачать

5.3. Адсорбция на границе жидкость-газ. Поверхностно активные вещества ПАВСкачать

Адсорбция. Как очистить воду при помощи активированного угля.Скачать

Адсорбция на твердой поверхности Консультация к тестамСкачать

Шеховцова Т.Н. - Аналитическая химия - Кислотно-основное титрованиеСкачать

Практическое занятие 4. Адсорбция на границе твердое тело – газСкачать

Поверхностные явленияСкачать

Адсорбция, 1981Скачать