Химические свойства карбоновых кислот определяются свойствами карбоксильной группы и связанного с ней углеводородного радикала, а также их взаимным влиянием. Мы рассмотрим реакции кислот: а) обусловленные подвижностью атома водорода в карбоксиле; б) основанные на способности гидроксильной группы карбоксила замещаться различными атомами или группами и в) реакции за счет связанного с карбоксилом углеводородного остатка.
А) Подвижность водорода карбоксильной группы
(диссоциация карбоновых кислот)
Подобно неорганическим кислотам карбоновые кислоты в водных растворах диссоциируют, образуя катионы водорода и анионы кислот (карбоксилатанионы):
R—COOH ® R—COO — + H +
карбоновая к-та анион кислоты
Поэтому растворимые в воде карбоновые кислоты окрашивают лакмус в красный цвет, проводят электрический ток, имеют кислый вкус, т.е. являются электролитами и проявляют кислотные свойства.
Склонность карбоновых кислот к диссоциации обусловлена подвижностью водорода гидроксильной группы карбоксила. Мы уже знаем, что водород гидроксильной группы спиртов тоже подвижен и спирты в некоторой степени проявляют кислотные свойства. Однако в спиртах гидроксильная группа связана с насыщенным углеводородным остатком, и под его влиянием подвижность водорода в гидроксиле столь мала, что спирты являются более слабыми кислотами, чем вода (константы диссоциации спиртов ниже 10 -16 ), и практически нейтральны. В кислотах же гидроксил непосредственно связан не с углеводородным остатком, а с карбонильной группой, под влиянием этой группы подвижность водорода в гидроксиле настолько увеличивается, что он способен к отщеплению в виде протона. Константы диссоциации карбоновых кислот значительно больше констант диссоциации спиртов и достигают порядка 10 -4 -10 5 .
Влияние карбонильной группы на кислотные свойства гидроксила в карбоксиле объясняется смещением p-электронов ее двойной связи к карбонильному кислороду (I):
















Частичный положительный заряд (б+) карбонильного углерода компенсируется сдвигом электронов в связи С—О, что вызывает резкое смещения пары электронов в связи О—Н. Это и обуславливает значительно большую подвижность гидроксильного водорода в кислотах, чем в спиртах, возможность его ионизации. С отрывом иона Н + образуется карбоксилатанион, отрицательный заряд которого в результате электронных смещений, показанных схемой (II), равномерно распределяется между обоими атомами кислорода. Таким образом, связи между атомом углерода и двумя атомами кислорода выровнены, т.е. являются промежуточными между простой и двойной связями; это представлено схемой (III). Поэтому в уравнениях ионных реакций карбоксилатанион правильнее изображать неразвернутой формулой R-COO — (минус относится ко всему аниону).
Способность карбоновых кислот к диссоциации зависит и от влияния связанного с карбоксилом углеводородного радикала. В таблице приведены константы диссоциации карбоновых кислот; самой сильной одноосновной карбоновой кислотой является муравьиная, в которой карбоксил не связан с радикалом. Кислоты, содержащие в соединении с карбоксилом предельные углеводородные остатки, значительно слабее муравьиной кислоты. Это объясняется электродонорными свойствами алкильных остатков; они вызывают смещение электронов связи R-C, как показано выше в схеме (I). А это в свою очередь в некоторой степени компенсирует положительный заряд карбонильного углерода и, следовательно, уменьшает его влияние на гидроксильную группу.
По сравнению с большинством неорганических кислот насыщенные карбоновые кислоты являются слабыми кислотами. Как мы увидим дальше, введение в радикал кислоты некоторых атомов или групп атомов может значительно повысить способность органических кислот к диссоциации.
- «Карбоновые кислоты» (стр. 2 )
- Карбоновые кислоты
- Насыщенные монокарбоновые кислоты
- Номенклатура и изомерия
- Физические свойства
- Химические свойства
- Особенности строения и свойств муравьиной кислоты
- Способы получения предельных монокарбоновых кислот
- НСООН
- СН3СООН
- Применение важнейших насыщенных монокарбоновых кислот
- Ненасыщенные (непредельные) монокарбоновые кислоты
- Важнейшие представители
- Изомерия
- Химические свойства
- Скачать:
- 🎥 Видео
Видео:ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ кислот оснований и солей | Как писать УРАВНЕНИЯ ДИССОЦИАЦИЙСкачать

«Карбоновые кислоты» (стр. 2 )
 | Из за большого объема этот материал размещен на нескольких страницах: 1 2 3 4 |
49*.Каков механизм реакции этерификации? Какому из исходных веществ принадлежал атом кислорода, вошедший в молекулу воды?
50. Проявляют ли непредельные карбоновые кислоты свойства алкенов? Какие качественные реакции на двойную углеродуглеродную связь вы знаете? Напишите уравнения этих реакций с непредельными кислотами.
51. Какое вещество получается при каталитическом гидрировании олеиновой кислоты?
52. Какие вещества получаются при последовательном галогенировании пропионовой кислоты хлором в присутствии фосфора?
53*.Какие функциональные производные карбоновых кислот вы знаете? Приведите их формулы на примере производных уксусной кислоты.
54**.С помощью, каких реакций можно осуществить превращения:
нитрил → амид → кислота → хлорангидрид → ангидрид → сложный эфир?
55**.С помощью, каких реакций можно осуществить превращения:
хлорангидрид → сложный эфир → кислота → аммонийная соль → амид → нитрил?
Работа 41. Химические свойства карбоновых кислот
56. Диссоциация карбоновых кислот — обратимый процесс, протекающий по уравнению
R—СООН ↔ R—СОО– + Н+ — Q.
1) увеличение температуры,
2) добавление соляной кислоты,
3) добавление гидроксида натрия,
4) увеличение давления;
направление смещения равновесия диссоциации:
а) сместится вправо,
б) сместится влево,
57. Какое из веществ проявляет наиболее сильные кислотные свойства?
а) СН2С1—СООН, б) СС13—СООН,
в) СН3—СООН, г) СНС12—СООН.
58. Какой из металлов реагирует с уксусной кислотой с максимальной скоростью?
а) Железо, б) олово, в) цинк, г) кальций.
Напишите уравнение реакции.
59. Суммы коэффициентов в молекулярном, полном и сокращенном ионных уравнениях реакций муравьиной кислоты с карбонатом натрия равны соответственно:
а) 7, 11,7, б)7,13,7, в) 5, 9, 5, г) 7, 11, 5.
60. Взаимодействие пропионовой кислоты с этиловым спиртом называется реакцией:
а) гидратации, б) этерификации,
в) гидрирования, г) нейтрализации.

61. Дана цепочка превращений:
Укажите формулы веществ 1—4:
Напишите уравнения реакций.
62. С помощью какого реагента можно различить следующие вещества: этанол, этаналь, этиленгликоль, уксусную кислоту?
а) СuО, б) Сu(ОН)2, в) Сu, г) CuSO4.
Напишите уравнения возможных реакций или укажите визуальный эффект.
63. Навеску предельной одноосновной кислоты массой 0,37 г растворили в воде. На полную нейтрализацию кислоты израсходовали 4,8 мл раствора гидроксида натрия с массовой долей NaOH 4% (плотность 1,04 г/мл). Формула исходной кислоты:
а) НСООН, б) СН3—СООН, в) С2Н5—СООН, г) С3Н7—СООН.
64. Для нейтрализации смеси уксусной кислоты и фенола потребовалось 57,7 мл раствора гидроксида калия с массовой долей КОН 13% (плотность 1,12 г/мл). При действии на такое же количество смеси бромной водой выпал осадок массой 33,1 г. Массовые доли уксусной кислоты и фенола в смеси равны соответственно:
а) 24,2 и 75,8%, б) 46,3 и 53,7%,
в) 61,1 и 38,9%, г) 75,8 и 24,2%.
65. Некоторая карбоновая кислота взаимодействует с карбонатом кальция с выделением газа, вступает в реакцию нитрования, не обесцвечивает бромную воду. Она содержится во многих ягодах, применяется в пищевой промышленности в качестве консерванта. Эта ислота имеет формулу:
а) СН3—СООН, б) СН2=СН—СООН,
в) С6Н5—СООН, г) НООС—СООН.

66.Диссоциация карбоновой кислоты протекает по уравнению:
1) увеличение температуры,
2) увеличение давления,
3) добавление сильной кислоты,
4) добавление щелочи;
направление смещения равновесия диссоциации:
а) сместится вправо,
б) сместится влево,
67.Какое из веществ проявляет наиболее сильные кислотные свойства?
а) НСООН, б) СН3—СООН,
в) СН3—СН2—СООН, г) СН3—СН2—СН2—СООН.
68.С каким из веществ муравьиная кислота вступает в реакцию замещения?
a) Mg, 6) CaO, в) Ва(ОН)2, г) Na2SiO3.
Напишите уравнение реакции.
69. Суммы коэффициентов в молекулярном, полном и сокращенном ионных уравнениях реакции уксусной кислоты с гидроксидом меди (II) равны соответственно:
а) 6, 8, 8, 6) 4, 10, 4, в) 6, 9, 7, г) 6, 8, 4.
70.Реакцией этерификации называется взаимодействие кислоты:
а) со щелочью, б) со спиртом,
в) с галогенами, г) с металлами.

Напишите уравнения реакций.
Укажите формулы веществ 1—4:
72. С помощью какого реагента можно различить растворы трех веществ: фенола, пропанола-2 и пропеновой кислоты?
а) Сu(ОН)2, б) FeCl3,
в) Вг2 (водн.), г) Ag20 (аммиачный р-р).
Напишите уравнения возможных реакций и укажите их визуальный эффект
73. Навеску двухосновной карбоновой кислоты массой 0,45 г растворили в воде. На полную нейтрализацию кислоты израсходовали 9,6 мл раствора гидроксида натрия с массовой долей NaOH 4% (плотность 1,04 г/мл). Исходная кислота имеет формулу:
а) НООС—СООН, б) НООС—СН2—СН2—СООН,
в) НООС—СН2—СООН, г) НООС—С6Н4—СООН.
74. Некоторый спирт подвергли окислению, при этом образовалась одноосновная карбоновая кислота. При сжигании 13,2 г этой кислоты получили оксид углерода (IV), для полной нейтрализации, которого потребовалось 192 мл раствора гидроксида калия с массовой долей КОН 28% (плотность 1,25 г/мл). Молекулярная формула исходного спирта:
а) СН3ОН, б) С2Н5ОН, в) С3Н7ОН, г) С4Н9ОН.
75. Основность некоторой карбоновой кислоты в два раза меньше числа атомов водорода в ее молекуле. При взаимодействии с концентрированной серной кислотой она выделяет оксид углерода (II), а также дает реакцию «серебряного зеркала». Формула этой кислоты:
а) НООС—СООН, б) НООС—СН2—СООН,
в) НСООН, г) СН3—СООН.
76*. Уксусная кислота в водном растворе диссоциирует по уравнению:
направление смещения равновесия диссоциации:
а) сместится вправо,
6) сместится влево,
77*. Расположите в порядке усиления кислотных свойств, следующие вещества:
2) СН3—СООН, 3) С6Н5ОН, 4) Н2О, 5) НС1.
78*. Ацетат кальция можно получить взаимодействием уксусной кислоты с:
а) кальцием, б) оксидом кальция,
в) гидроксидом кальция, г) карбонатом кальция,
д) все предыдущие ответы верны.
Напишите уравнения реакций.
1) муравьиная кислота и метиловый спирт,
2) хлорангидрид уксусной кислоты и фенол,
3) ангидрид пропионовой кислоты и 2-метилпропанол-1,
4) ацетат серебра и 2-бромпропан;
а) изобутиловый эфир пропионовой кислоты,
б) изопропиловый эфир уксусной кислоты,
в) метиловый эфир муравьиной кислоты,
г) фениловый эфир уксусной кислоты.
Напишите уравнения реакций. Какая из них является обратимой?
80*. С помощью какого реагента можно различить масляную и кретоновую (бутен-2-овую) кислоты? а) Вг2 (водн.), б) NaOH,
в) Сu(ОН)2, г) FеС13.
81*.Жаропонижающее средство аспирин получают по следующей схеме:
Укажите формулу аспирина
82*. Дана схема взаимопревращений между уксусной кислотой и ее функциональными прозводными:

83*.Смешали 10мл 3%-ного раствора СН3—СООН (плотность 1,00 г/мл) и 10 мл 3% — ного раствора NaOH (плотность 1,03 г/мл). Найдите ответы на следующие вопросы.
Какую окраску будет иметь индикатор метиловый оранжевый в полученном растворе?
I) Красную, II) оранжевую, III) желтую, IV) зеленую.
Какова масса образовавшейся соли?
1)0,63 г, 2) 0,41 г, 3)0,33 г, 4) 0,20 г.
Какова массовая доля соли в образовавшемся растворе?
а) 2,02%, 6)3,10%, в) 4,10%, г) 6,30%.
84*.При сплавлении натриевой соли одноосновной карбоновой кислоты с гидроксидом натрия выделилось 5,6 л газа, имеющего плотность 1,965 г/л. Масса соли, вступившей в реакцию, равна:
а) 27,5 г, б) 36,8 г, в) 55,5 г, г) 67,9 г.
85*. Некоторая двухосновная карбоновая кислота образует нерастворимую в воде кальциевую соль, легко окисляется раствором КМnО4 до углекислого газа и воды, содержится во многих растениях. Формула этой кислоты:
а) НООС—СООН б) НООС—СН2—СН2—СООН

86**. Дана цепочка превращений
Конечный продукт цепочки
превращений называется молочной

Напишите уравнения реакций.
87**. Молярная масса этилового эфира некоторой кислоты на 31,8% больше, чем молярная масса самой кислоты. Во сколько раз число атомов углерода в эфире больше, чем в кислоте?
Видео:ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Карбоновые кислоты
Неспелые фрукты, щавель, барбарис, клюква, лимон… Что общего между ними? даже дошкольник, не задумываясь, ответит: они кислые. А вот обусловлен кислый вкус плодов и листьев многих растений различными карбоновыми кислотами — веществами, в состав которых входит одна или несколько карбоксильных групп —СООН.
У древних греков представление о кислом вкусе связывалось, прежде всего, с уксусом — раствором уксусной кислоты, образующейся при скисании вина. Само слово «уксус», или, как говорили жители Эллады, «оксис», означало «кислый». Получение уксуса при сухой перегонке — нагревании без доступа воздуха — древесины описано в сочинениях Иоганна Глаубера и Роберта Бойля. Однако природа этого вещества вплоть до XIX в. оставалась неизвестной. Алхимики считали, что при брожении вина винный спирт превращается в уксус, принимая на себя частицы соли — винного камня (гидротартрата калия С4H5О6K). Ещё в ХVIII в. брожение объясняли соединением кислых и горючих начал вина. Лишь в 1814 г. Якоб Берцелиус определил состав уксусной кислоты — С2Н4О2 , а в 1845 г. немецкий химик Адольф Вильгельм Герман Кольбе ( 1818— 1884) осуществил полный её синтез из угля.

Уксусная кислота относится к гомологическому ряду одноосновных карбоновых кислот. Низшие члены ряда при комнатной температуре представляют собой бесцветные жидкости с резким запахом. Простейшую из них — муравьиную кислоту НСООН, впервые получил в 1670 г. английский естествоиспытатель Джон Рей, нагревая муравьев в перегонной колбе. В природе широко распространены и более сложные по составу кислоты. Такова, например, масляная кислота СН3(СН2)2СООН, которая образуется при прогоркании сливочного масла — это из-за нее испорченное масло так неприятно пахнет и горчит. Она обусловливает и запах пота. Родственная ей капроновая кислота СН3(СН2)4СООН входит в состав козьего масла. В корнях растения валерианы содержится некоторое количество изовалериановой кислоты(СН3)2СН – СН2СООН— ее можно выделить, обработав высушенные корни растения перегретым водяным паром.
Высшие кислоты, например стеариновая СН3(СН2)16СООН и пальмитиновая CН3(CH2)14COOH, впервые выделенная из пальмового масла, представляют собой бесцветные твёрдые вещества, не растворимые в воде. Долгое время основным их источником были природные жиры, например свиное сало или говяжий жир. Сейчас эти кислоты получают и синтетически — каталитическим окислением углеводородов нефти. Практическое значение имеют главным образом натриевые соли этих кислот — стеарат натрия C17H35COONa и пальмитат натрия C15H31COONa: они являются основными компонентами мыла.
В щавеле, а также в ревене, кислице, шпинате содержится щавелевая кислота НООС—СООН. Эта простейшая двухосновная кислота продукт распада некоторых аминокислот, например глицина. При нарушениях обмена веществ (в частности, при недостатке витамина В12) в организме человека откладывается её малорастворимая кальциевая соль — оксалат кальция, это и есть так называемое оксалатное отложение солей. Янтарная кислота НООС—СН2СН2 – СООН впервые была выделена алхимиками. Ещё Агрикола наблюдал при прокаливании янтаря образование похожего на соль белого налета янтарной кислоты (лат sal succini volatile — «летучая янтарная соль»).
Многие карбоновые кислоты — например, яблочная, винная, лимонная, хинная — образуются в вакуолях клеток плодов при частичном окислении глюкозы и в результате некоторых других биохимических процессов. Плоды цитрусовых богаты лимонной кислотой: в мякоти апельсина её около 2%, в грейпфруте — до 3%, а в лимоне — 6%. Поэтому неудивительно, что впервые она была выделена Шееле в 1784 г. именно из лимонов. Подобный эксперимент можно проделать и в школьной лаборатории: нужно лимонный сок обработать известью, а продукт этой реакции — кальциевую соль отфильтровать и разложить серной кислотой. Образующаяся в результате лимонная кислота переходит в раствор, который упаривают до начала кристаллизации. В зелёных яблоках, крыжовнике, плодах рябины содержатся не только яблочная, хинная, но и другие органические кислоты.
В 1769 г. Шееле при действии серной кислотой на винный камень впервые получил винную кислоту НООС – СН(ОН)СН(ОН) – СООН.
Впоследствии выяснилось, что винная кислота существует в виде трёх стереоизомеров. Два из них обладают одинаковыми физическими свойствами, а их молекулы представляют собой зеркальные отражения друг друга (оптические антиподы, или энантиомеры). Это так называемые D- и L-винные кислоты, а винный камень — соль D-формы.
Интересно, что энантиомерные винные кислоты образуют кристаллы, которые также являются зеркальными отражениями друг друга. Смесь равных количеств D- и L-винных кислот (рацемат) называется виноградной кислотой. А вот третья из винных кислот – мезовинная не относится к числу оптически активных веществ.
Гомологом щавелевой кислоты является адипиновая кислота НООС(СН2)4СООН, которая получается окислением некоторых циклических соединений. Она входит в состав чистящих средств для удаления ржавчины, а также служит исходным веществом для производства полиамидных волокон.
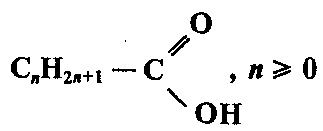
Карбоновые кислоты — это производные УВ, содержащие функциональную карбоксильную группу —СООН.
Карбоксильная группа (карбоксил) — сложная функциональная группа, состоящая из карбонильной и гидроксильной групп:
Общая формула карбоновых кислот:
где m — число карбоксильных групп, он определяющее основностъ кислоты.
По основности кислоты делятся на:
— одноосновные (монокарбоновые), m = 1;
— двухосновные (дикарбоновые), m = 2;
— трехосновные (трикарбоновые), m = 3 и т. д.
Примерами дикарбоновых кислот являются:
В зависимости от строения углеводородного радикала R карбоновые кислоты делятся на:
— предельные (насыщенные), R = алкил;
— непредельные (ненасыщенные) — производные непредельных УВ;
— ароматические — производные ароматических УВ.
Насыщенные монокарбоновые кислоты
Наибольшее значение имеют насыщенные монокарбоновые кислоты, их общая формула:
Важнейшие представители гомологического ряда этих кислот представлены в таблице. В этой таблице приведены названия кислот RCOOH и кислотных остатков RCOO-.
В структуре карбоновых кислот часто выделяют также кислотные радикалы, или ацилы. Названия некоторых ацилов:
Номенклатура и изомерия
По международной заместительной номенклатуре название кислоты производят от названия соответствующего (с тем же числом атомов углерода) углеводорода с добавлением окончания -овая и слова кислота. Нумерацию цепи всегда начинают с атома углерода карбоксильной группы, поэтому в названиях положение группы —СООН не указывают. Например:
При составлении названий кислот, имеющих сложное строение, иногда также используют тривиальные названия кислот, соответствующие наиболее длинной прямой цепи. В этом случае атомы углерода в прямой цепи обозначают греческими буквами, начиная с атома углерода, соседнего с карбоксильной группой: α (альфа),β (бета), γ (гамма), δ (дельта) и т. д., например:
Внутри класса предельных монокарбоновых кислот возможна только изомерия углеродной цепи. Первые три члена гомологического ряда (НСООН, СН3СООН, С2Н5СООН) изомеров не имеют. Четвертый член ряда существует в виде двух изомеров:
Пятый член ряда существует в виде четырех изомеров:
Монокарбоновые кислоты изомерны сложным эфирам карбоновых кислот:
Физические свойства 
В твердом и жидком состояниях молекулы насыщенных монокарбоновых кислот димеризуются в результате образования между ними водородных связей:
Водородная связь в кислотах сильнее, чем в спиртах, поэтому температуры кипения кислот больше температур кипения соответствующих спиртов.
В водных растворах кислоты образуют линейные димеры:
Химические свойства
Для насыщенных монокарбоновых кислот характерна высокая реакционная способность. Это определяется главным образом реакциями карбоксильной группы (разрыв связей О—Н и С—О), а также реакциями замещения атомов «Н» у α-углеродного атома:
Реакции с разрывом связи О—Н (кислотные свойства, обусловленные подвижностью атома водорода карбоксильной группы)
Предельные монокарбоновые кислоты обладают всеми свойствами обычных кислот.
1.Диссоциация
В водных растворах монокарбоновые кислоты ведут себя как одноосновные кислоты: происходит их ионизация с образованием иона водорода и карбоксилат-иона:
Карбоксилат-ион построен симметрично, отрицательный заряд делокализован между атомами кислорода карбоксильной группы:
Делокализация стабилизирует карбоксилат-ион.
Карбоновые кислоты являются слабыми кислотами. Наиболее сильной в гомологическом ряду насыщенных кислот является муравьиная кислота, в которой группа —СООН связана с атомом водорода. Алкильные радикалы в молекулах следующих членов гомологического ряда обладают положительным индукционным эффектом (+1) и уменьшают положительный заряд на атоме углерода карбоксильной группы. Это в свою очередь ослабляет полярность связи О—Н и тем в большей степени, чем больше УВ радикал. Поэтому в гомологическом ряду кислот их сила уменьшается с ростом числа атомов углерода в молекуле:
2.Образование солей:
а) взаимодействие с активными металлами:
в) взаимодействие со щелочами (реакция нейтрализации):
д) взаимодействие с солями более слабых кислот (карбонатами и гидрокарбонатами):
II. Реакции с разрывом связи С—О (замещение ОН-группы)
1.Взаимодействие со спиртами с образованием сложных эфиров (реакция этерификации):
2.Взаимодействие с аммиаком с образованием амидов кислот:
Амиды получают из карбоновых кислот и аммиака через стадию образования аммониевой соли, которую затем нагревают:
3.Взаимодействие с галогенидами фосфора (РСl5, РСl3) или тионилхлоридом SOCl2 с образованием галогенангидридов карбоновых кислот:
4.Межмолекулярная дегидратация карбоновых кислот с образованием ангидридов:
Ангидриды представляют собой производные кислот, состоящие из двух соединенных через кислород кислотных радикалов (ацилов).
Ангидриды получают при пропускании паров кислот над водоотнимающим средством (Р2О5):
Смешанные ангидриды карбоновых кислот можно получить при взаимодействии хлорангидрида одной кислоты и соли другой кислоты:
Аналогично можно получать ангидриды, содержащие остатки одной кислоты.
III. Реакции с разрывом связей С—Н у α-углеродного атома (реакции с участием радикала)
Атомы водорода у α-углеродного атома более подвижны, чем другие атомы водорода в радикале кислоты, и могут замещаться на атомы галогена с образованием α-галогенкарбоновых кислот:
Особенности строения и свойств муравьиной кислоты
Муравьиная (метановая) кислота НСООН по своему строению и свойствам отличается от остальных членов гомологического ряда предельных монокарбоновых кислот.
1.В отличие от других карбоновых кислот в молекуле муравьиной кислоты функциональная карбоксильная группа связана не с углеводородным радикалом, а с атомом водорода. По этой причине, как уже было отмечено выше, муравьиная кислота является наиболее сильной кислотой по сравнению с другими членами своего гомологического ряда.
2.В молекуле муравьиной кислоты наряду с карбоксильной группой можно выделить также альдегидную группу:
Поэтому муравьиная кислота вступает в реакции, характерные как для кислот (см. свойства предельных монокарбоновых кислот), так и для альдегидов. В частности, как и альдегиды, НСООН проявляет восстановительные свойства. Муравьиная кислота легко окисляется до угольной кислоты:
В роли окислителей молт выступать аммиачный раствор оксида серебра (I) Аg2О и гидроксид меди (II) Cu(OH)2. Таким образом, особенностью муравьиной кислоты является то, что для нее характерны качественные реакции на альдегиды:
а) реакция «серебряного зеркала»:
б) реакция с гидроксидом меди (II):
Специфическим свойством муравьиной кислоты является также ее способность разлагаться на оксид углерода (II) и воду под действием концентрированной серной кислоты (эта реакция — еще одно доказательство того, что H2SО4 является хорошим водоотнимающим агентом):
Способы получения предельных монокарбоновых кислот
I. Общие способы получения
1.Окисление первичных спиртов и альдегидов под действием различных окислителей:
2.Окисление алканов кислородом воздуха (в присутствии катализаторов — солей марганца или при нагревании под давлением).
Обычно образуется смесь кислот. При окислении бутана единственным продуктом является уксусная кислота:
3. Омыление сложных эфиров (т. е. их щелочной гидролиз):
4.Гидролиз галогенангидридов кислот:
II. Способы получения важнейших кислот
НСООН
Муравьиную кислоту получают нагреванием под давлением гидроксида натрия и оксида углерода (II) и подкислением образующегося формиата натрия серной кислотой:
Муравьиная кислота образуется также при нагревании щавелевой кислоты:
Разложение карбоновых кислот, при котором они с выделением СО2 теряют карбоксильную группу, называется реакцией декарбоксилирования .
СН3СООН
1.Уксусную кислоту для пищевых целей получают уксуснокислым брожением жидкостей, содержащих спирт (вино, пиво):
2.Синтетическую уксусную кислоту для химической промышленности получают различными методами:
а) окислением бутана (см. выше);
б) окислением ацетальдегида:
в) синтезом из метанола и оксида углерода (II):
Применение важнейших насыщенных монокарбоновых кислот 
Ненасыщенные (непредельные) монокарбоновые кислоты
Непредельные монокарбоновые кислоты – это производные алкенов, алкинов, алкадиенов и других ненасыщенных УВ. Наибольшее значение имеют непредельные кислоты с двойными связями.
Важнейшие представители
Для ненасыщенных монокарбоновых кислот чаще всего используют тривиальные названия:
Важнейшими высшими непредельными карбоновыми кислотами являются:
Олеиновая кислота С17Н33СООН
Линолевая кислота С17Н31СООН
Линоленовая кислота С17Н29СООН
Изомерия
Для ненасыщенных кислот характерны такие же типы изомерии, как для непредельных УВ: изомерия цепи, изомерия положения двойных связей, цис-транс-изомерия:
Химические свойства
Химические свойства ненасыщенных монокарбоновых кислот обусловлены наличием в их молекулах карбоксильной группы и двойной связи. Реакции с участием карбоксильной группы — это реакции, характерные для всех карбоновых кислот: замещение атомов водорода в ОН-группе (кислотные свойства), замещение ОН-группы (этерификация, образование галогенангидридов и др.).
Реакции с участием двойных связей — это реакции углеводородного радикала.
Для УВ радикала ненасыщенных карбоновых кислот характерны реакции присоединения, окисления, полимеризации. Наиболее важными из реакций присоединения являются гидрирование и присоединение галогенов:
Скачать:
Скачать бесплатно реферат на тему: «Ангидриды карбоновых кислот» [download >
Скачать бесплатно реферат на тему: «Уксусная кислота» [download >
Скачать рефераты по другим темам можно здесь
🎥 Видео
Электролитическая диссоциация кислот, оснований и солей. 9 класс.Скачать

Свойства карбоновых кислот. 1 часть. 11 класс.Скачать
Диссоциация кислот.Скачать

Электролитическая диссоциация | Химия ЕГЭ, ЦТСкачать

Вся теория по карбоновым кислотам для ЕГЭ | Химия ЕГЭ для 10 класса | УмскулСкачать

11.3. Карбоновые кислоты и их соли: Химические свойства. ЕГЭ по химииСкачать

Механизм электролитической диссоциации. 9 класс.Скачать

Тестируем корнеобразователи на виноградной лозе -Ч-2 (2024)Скачать

Свойства кислот с точки зрения теории электролитической диссоциации. 9 класс.Скачать

Химия 9 класс — Как определять Степень Окисления?Скачать

КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать

Кислотные свойства карбоновых кислот | ХимияСкачать

Электролитическая диссоциация. Видеоурок по химии 9 классСкачать

В цеху серной кислоты. И всё о кислотахСкачать

9 класс. Электролитическая диссоциация. Образование ионов.Скачать

Электролитическая диссоциация | Химия 8 класс #40 | ИнфоурокСкачать

Кислотные свойства карбоновых кислот. Химический опытСкачать