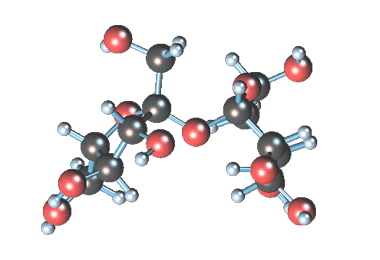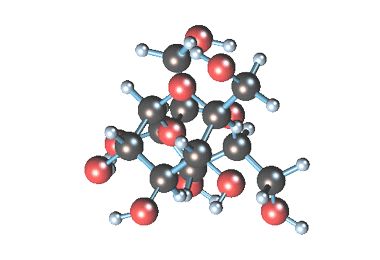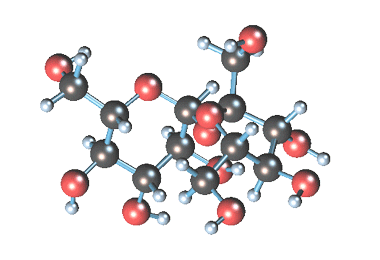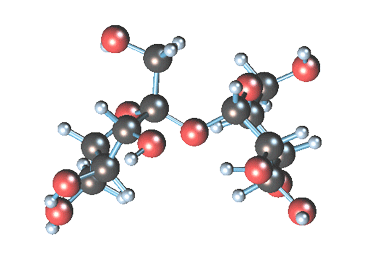
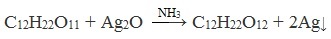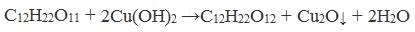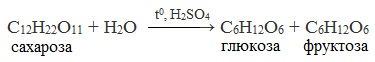Примером наиболее распространенных в природе дисахаридов (олигосахаридом) является сахароза (свекловичный или тростниковый сахар).
- Биологическая роль сахарозы
- Строение сахарозы
- Физические свойства сахарозы и нахождение в природе
- Химические свойства
- Получение сахарозы
- Применение сахарозы
- Опыты по химии. Углеводы
- Гидролиз сахарозы — уравнение реакции, формула и свойства
- Общие свойства
- Получение сахарозы
- Сферы применения
- Химические свойства
- 💡 Видео
Биологическая роль сахарозы
Наибольшее значение в питании человека имеет сахароза, которая в значительном количестве поступает в организм с пищей. Подобно глюкозе и фруктозе сахароза после расщепления ее в кишечнике быстро всасывается из желудочно-кишечного тракта в кровь и легко используется как источник энергии.
Важнейший пищевой источник сахарозы — сахар.
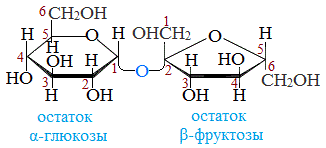
Строение сахарозы
Молекулярная формула сахарозы С12Н22О11 .
Сахароза имеет более сложное строение, чем глюкоза. Молекула сахарозы состоит из остатков молекул глюкозы и фруктозы в их циклической форме. Они соединены друг с другом за счет взаимодействия полуацетальных гидроксилов (1→2) -гликозидной связью, то есть свободный полуацетальный (гликозидный) гидроксил отсутствует:
Физические свойства сахарозы и нахождение в природе
Сахароза (обыкновенный сахар) – белое кристаллическое вещество, более сладкое, чем глюкоза, хорошо растворимое в воде.
Температура плавления сахарозы 160°C. При застывании расплавленной сахарозы образуется аморфная прозрачная масса – карамель.
Сахароза является весьма распространённым в природе дисахаридом, она встречается во многих фруктах, плодах и ягодах. Особенно много ее содержится в сахарной свёкле (16-21%) и сахарном тростнике (до 20%), которые и используются для промышленного производства пищевого сахара.
Содержание сахарозы в сахаре 99,5%. Сахар часто называют «носителем пустых калорий», так как сахар – это чистый углевод и не содержит других питательных веществ, таких, как, например, витамины, минеральные соли.
Химические свойства
Для сахарозы характерны реакции по гидроксильным группам.
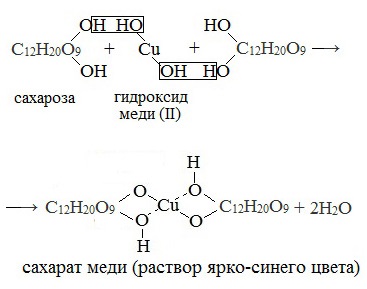
1. Качественная реакция с гидроксидом меди (II)
Наличие гидроксильных групп в молекуле сахарозы легко подтверждается реакцией с гидроксидами металлов.
Видеоопыт «Доказательство наличия гидроксильных групп в сахарозе»
Если раствор сахарозы прилить к гидроксиду меди (II), образуется ярко-синий раствор сахарата меди (качественная реакция многоатомных спиртов):
2. Реакция окисления
Восстанавливающие дисахариды
Дисахариды, в молекулах которых сохраняется полуацетальный (гликозидный) гидроксил (мальтоза, лактозы), в растворах частично превращаются из циклических форм в открытые альдегидные формы и вступают в реакции, характерные для альдегидов: реагируют с аммиачным раствором оксида серебра и восстанавливают гидроксид меди (II) до оксида меди (I). Такие дисахариды называются восстанавливающими (восстанавливают Cu (OH)2 и Ag2O).
Реакция «серебряного зеркала»
Реакция с гидроксидом меди (II)
Невосстанавливающий дисахарид
Дисахариды, в молекулах которых нет полуацетального (гликозидного) гидроксила (сахароза) и которые не могут переходить в открытые карбонильные формы, называются невосстанавливающими (не восстанавливают Cu (OH)2 и Ag2O).
Сахароза, в отличие от глюкозы, не является альдегидом. Сахароза, находясь в растворе, не вступает в реакцию «серебряного зеркала» и при нагревании с гидроксидом меди (II) не образует красного оксида меди (I), так как не способна превращаться в открытую форму, содержащую альдегидную группу.
Видеоопыт «Отсутствие восстанавливающей способности сахарозы»
3. Реакция гидролиза
Для дисахаридов характерна реакция гидролиза (в кислой среде или под действием ферментов), в результате которой образуются моносахариды.
Сахароза способна подвергаться гидролизу (при нагревании в присутствии ионов водорода). При этом из одной молекулы сахарозы образуется молекула глюкозы и молекула фруктозы:
Видеоопыт «Кислотный гидролиз сахарозы»
Мальтоза и лактоза при гидролизе расщепляются на составляющие их моносахариды за счёт разрыва связей между ними (гликозидных связей):
Таким образом, реакция гидролиза дисахаридов является обратной процессу их образования из моносахаридов.
В живых организмах гидролиз дисахаридов происходит при участии ферментов.
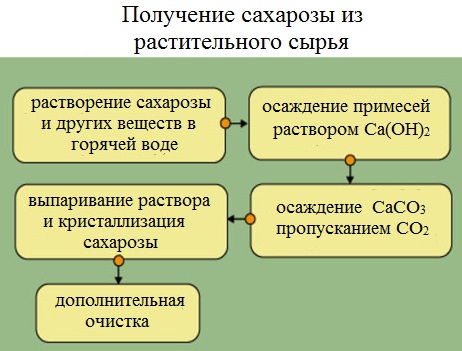
Получение сахарозы
Сахарную свеклу или сахарный тростник превращают в тонкую стружку и помещают в диффузоры (огромные котлы), в которых горячая вода вымывает сахарозу (сахар).
Вместе с сахарозой в водный раствор переходят и другие компоненты (различные органические кислоты, белки, красящие вещества и др.). чтобы отделить эти продукты от сахарозы, раствор обрабатывают известковым молоком (гидроксидом кальция). В результате этого образуются малорастворимые соли, которые выпадают в осадок. Сахароза образует с гидроксидом кальция растворимый сахарат кальция С12Н22О11·CaO·2Н2О.
Для разложения сахарата кальция и нейтрализации избытка гидроксида кальция через раствор пропускают оксид углерода ( IV).
Выпавший в осадок карбонат кальция отфильтровывают, а раствор упаривают в вакуумных аппаратах. По мере образования кристалликов сахара отделяют с помощью центрифуги. Оставшийся раствор – меласса – содержит до 50% сахарозы. Его используют для производства лимонной кислоты.
Выделенную сахарозу очищают и обесцвечивают. Для этого ее растворяют в воде и полученный раствор фильтруют через активированный уголь. Затем раствор снова упаривают и кристаллизуют.
Применение сахарозы
Сахароза в основном используется как самостоятельный продукт питания (сахар), а также при изготовлении кондитерских изделий, алкогольных напитков, соусов. Ее используют в высоких концентрациях в качестве консерванта. Путем гидролиза из нее получают искусственный мёд.
Сахароза находит применение в химической промышленности. С помощью ферментации из нее получают этанол, бутанол, глицерин, левулиновую и лимонную кислоты, декстран.
В медицине сахарозу используют при изготовлении порошков, микстур, сиропов, в том числе для новорожденных детей (для придания сладкого вкуса или консервации).
Видео:Опыты по химии. Взаимодействие сахарозы с гидроксидом меди (II)Скачать

Опыты по химии. Углеводы
Доказательство наличия гидроксильных групп в сахарозе
Докажем, что в состав молекулы сахарозы входят гидроксильные группы.
Прильем к раствору сахарозы несколько капель раствора сульфата меди (II) и раствор щелочи. Осадка гидроксида меди не образуется. Раствор окрашивается в ярко-синий цвет. В данном случае сахароза растворяет гидроксид меди (II) и ведет себя как многоатомный спирт. Продукт реакции – сахарат меди (II).
Оборудование: штатив для пробирок, пробирки.
Техника безопасности. Соблюдать правила работы с растворами щелочей.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Качественная реакция глюкозы с аммиачным раствором оксида серебра (I)
Доказать наличие альдегидной группы в глюкозе можно с помощью аммиачного раствора оксида серебра. К аммиачному раствору оксида серебра добавим раствор глюкозы и подогреем смесь на водяной бане. Вскоре на стенках колбы начинает осаждаться металлическое серебро. Эта реакция называется реакцией серебряного зеркала. Ее используют как качественную для открытия альдегидов. Альдегидная группа глюкозы окисляется до карбоксильной группы. Глюкоза превращается в глюконовую кислоту.
СН2ОН – (СНОН)4 – СОН + Ag2O = СН2ОН – (СНОН)4 – СООН + 2Ag↓
Реакцию серебряного зеркала используют в промышленности для серебрения зеркал, изготовления колб для термосов, елочных украшений.
Оборудование: колба круглодонная, горелка, стакан, штатив, прокладка огнезащитная.
Техника безопасности. Аммиачный раствор оксида серебра нельзя хранить. После опыта неиспользованный раствор нейтрализуют соляной кислотой.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Качественная реакция глюкозы с гидроксидом меди (II)
Глюкоза содержит в своем составе пять гидроксильных групп и одну альдегидную группу. Поэтому она относиться к альдегидоспиртам. Ее химические свойства похожи на свойства многоатомных спиртов и альдегидов. Реакция с гидроксидом меди (II) демонстрирует восстановительные свойства глюкозы. Прильем к раствору глюкозы несколько капель раствора сульфата меди (II) и раствор щелочи. Осадка гидроксида меди не образуется. Раствор окрашивается в ярко-синий цвет. В данном случае глюкоза растворяет гидроксид меди (II) и ведет себя как многоатомный спирт. Нагреем раствор. Цвет раствора начинает изменяться. Сначала образуется желтый осадок Cu2O, который с течением времени образует более крупные кристаллы CuO красного цвета. Глюкоза при этом окисляется до глюконовой кислоты.
СН2ОН – (СНОН)4 – СОН + Сu(ОН)2 = СН2ОН – (СНОН)4 – СООН + Сu2О↓+ Н2О
Оборудование: штатив для пробирок, пробирки, горелка, зажим для пробирок.
Техника безопасности. Соблюдать правила работы с растворами щелочей.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Кислотный гидролиз крахмала
В присутствии кислот крахмал гидролизуется. При гидролизе крахмала образуется глюкоза. Экспериментально проверим это. Прокипятим смесь крахмального клейстера и серной кислоты. Полноту гидролиза будем проверять с реакцией с йодом. Гидролиз проводится до тех пор, пока реакция с йодом не станет отрицательной, т. е. проба раствора не будет давать с йодом синего окрашивания. Проверим наличие глюкозы в полученном растворе. Прильем к раствору щелочь и несколько капель раствора сульфата меди (II). Осадка гидроксида меди не образуется. Раствор окрашивается в ярко-синий цвет. Нагреем раствор. Выпадает красный осадок оксида меди (I).
(С6Н10О5)n + n Н2О = n С6 Н12О6
Мы доказали, что при гидролизе крахмала образовалась глюкоза.
Оборудование: штатив для пробирок, пробирки, горелка, зажим для пробирок, штатив, стакан, прокладка огнезащитная.
Техника безопасности. Соблюдать правила работы с растворами кислот.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Кислотный гидролиз сахарозы
В присутствии кислот дисахариды гидролизуются. При гидролизе сахарозы образуется глюкоза и фруктоза. Экспериментально проверим это. Прокипятим смесь растворов сахарозы и серной кислоты. Через несколько минут проверим наличие глюкозы в полученном растворе.
Прильем к раствору щелочь и несколько капель раствора сульфата меди (II). Осадка гидроксида меди не образуется. Раствор окрашивается в ярко-синий цвет. Нагреем раствор. Выпадает красный осадок оксида меди (I). Мы доказали, что при гидролизе сахарозы образовалась глюкоза.
Оборудование: штатив для пробирок, пробирки, горелка, зажим для пробирок, штатив, стакан, прокладка огнезащитная.
Техника безопасности. Соблюдать правила работы с растворами кислот.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Кислотный гидролиз целлюлозы
При кислотном гидролизе целлюлозы образуется глюкоза. Проведем гидролиз в присутствии серной кислоты. В фарфоровой ступке разотрем вату с концентрированной серной кислотой. Полученную смесь разбавим водой и перенесем в стакан. Прокипятим смесь. Через несколько минут проверим наличие глюкозы в полученном растворе. Прильем к раствору щелочь и несколько капель раствора сульфата меди (II). Нагреем раствор. Выпадает красный осадок оксида меди (I). Мы доказали, что при гидролизе целлюлозы образовалась глюкоза. Кислотный гидролиз целлюлозы имеет важное промышленное значение. Брожением полученной глюкозы получают этиловый спирт.
Оборудование: штатив для пробирок, пробирки, горелка, зажим для пробирок, фарфоровая ступка с пестиком.
Техника безопасности. Соблюдать правила работы с концентрированными кислотами.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Окисление глюкозы кислородом воздуха в присутствии метиленового голубого
Окисление глюкозы до глюконовой кислоты особенно легко протекает в щелочной среде в присутствии индикатора метиленового голубого. В колбе с водой растворим гидроксид натрия. Добавим туда глюкозу и затем немного раствора метиленового голубого. Через некоторое время раствор становится бесцветным. Перемешаем раствор. Он вновь окрашивается в голубой цвет.такие изменения окраски можно наблюдать много раз подряд. Под действием щелочи в водной среде глюкоза дегидрируется, превращаясь в глюконовую кислоту.
В отсутствии метиленового голубого отщепляющийся при дегидрировании водород окисляется кислородом воздуха очень медленно и реакция практически не идет. Метиленовый голубой присоединяет водород, превращаясь в бесцветное соединение. Это бесцветное соединение окисляется кислородом воздуха в метиленовый голубой, и вновь появляется голубая окраска. В процессе реакции индикатор практически не расходуется. Он является типичным катализатором окисления глюкозы до глюконовой кислоты.
Оборудование: шпатель, плоскодонная колба с пробкой.
Техника безопасности.
Соблюдать правила работы со щелочами и их растворами.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Определение глюкозы в виноградном соке
Многие фрукты и ягоды содержат глюкозу. Определить наличие глюкозы можно с помощью гидроксида меди (II). Из ягоды винограда выжмем сок. Прильем к соку несколько капель раствора сульфата меди (II) и раствор щелочи. Нагреем раствор. Цвет раствора начинает изменяться. При кипячении раствора образуется желтый осадок Cu2O, который постепенно превращается в красный осадок CuO. Это доказывает наличие глюкозы в виноградном соке.
СН2ОН – (СНОН)4 – СОН + Сu(ОН)2 = СН2ОН – (СНОН)4 – СООН + Сu2О↓+ Н2О
Оборудование: штатив для пробирок, пробирки, горелка, зажим для пробирок.
Техника безопасности. Соблюдать правила работы с растворами щелочей.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Отсутствие восстанавливающей способности сахарозы
Экспериментально проверим отсутствие альдегидной группы у сахарозы. Приготовим сахарат меди (II). В пробирку с раствором сахарозы добавим раствор сульфата меди (II), воду и раствор щелочи. Образуется ярко синий сахарат меди (II). Раствор сахарата меди (II) нагреваем до кипения. Красного осадка оксида меди (I) не образуется. Следовательно, сахароза не имеет в своем составе свободную альдегидную группу и не обладает восстанавливающими свойствами.
Оборудование: штатив для пробирок, пробирки, горелка, зажим для пробирок.
Техника безопасности. Соблюдать правила работы с растворами щелочей.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Получение и свойства нитроцеллюлозы
Целлюлоза с азотной кислотой образует азотнокислые эфиры. Эфиры получают действием на целлюлозу смесью безводной азотной кислоты и концентрированной серной кислоты. Целлюлоза в нашем опыте — хлопковая вата.
Приготовим такую смесь и опустим в нее кусочек ваты. Через 15 минут процесс нитрования целлюлозы заканчивается. Промоем полученную нитроцеллюлозу водой. Высушим. Нитроцеллюлоза при поджигании быстро сгорает. Нитроцеллюлоза используется для приготовления бездымного пороха.
Оборудование: стакан, палочка, фильтровальная бумага, мерная пробирка.
Техника безопасности. Опыт необходимо проводить под тягой. Соблюдать правила работы с концентрированными кислотами.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Растворение целлюлозы в аммиачном растворе гидроксида меди (II)
Целлюлоза нерастворима в воде и в большинстве растворителей. Однако в аммиачном растворе гидроксида меди (II) целлюлоза растворяется хорошо. Продемонстрируем это. В концентрированный аммиачный раствор опускаем небольшие порции ваты. Вата хорошо растворяется в данном растворе. Получается густой вязкий раствор целлюлозы в аммиачном растворе гидроксида меди (II). Раствор целлюлозы используют в промышленности для получения медноаммиачного шелка.
Оборудование: пробирка или стакан, стеклянная палочка.
Техника безопасности. Соблюдать правила работы с концентрированным раствором аммиака.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Реакция крахмала с иодом
Крахмал дает с иодом характерное синее окрашивание. С помощью иода можно открыть самые незначительные количества крахмала. К разбавленному раствору крахмала добавляем немного раствора иода (используем раствор Люголя: 1 часть иода, 2 части иодида калия, 17 частей дистиллированной воды). Появляется синее окрашивание. Нагреваем синий раствор. Окраска постепенно исчезает, так как образующееся соединение неустойчиво. При охлаждении раствора окраска вновь появляется. Данная реакция иллюстрирует обратимость химических процессов и их зависимость от температуры.
Оборудование: штатив для пробирок, пробирки.
Техника безопасности. Опыт безопасен.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Видео:Качественная реакция глюкозы с гидроксидом меди (II)Скачать

Гидролиз сахарозы — уравнение реакции, формула и свойства
Сахароза — природный углевод, являющийся химическим органическим соединением. Его относят к дисахаридам, так как в его структуре содержится два моносахаридных звена: остатки молекул глюкозы и фруктозы, соединенных через гидроксильную группу. В быту сахарозу называют тростниковым (иногда свекловичным) сахаром.
Видео:Реакция глюкозы с гидроксидом меди (II)Скачать

Общие свойства
Внешне сахароза выглядит как бесцветные мелкие кристаллы. Ее физические свойства:
- в воде, этаноле растворима, однако практически не растворяется в метаноле и диэтиловом эфире;
- температура плавления равна 186 градусов по Цельсию. При застывании расплавленной массы получается аморфное прозрачное вещество, называемое карамелью;
- в природе находится в овощах, фруктах и ягодах.
Видео:Качественные реакции на глицерин, глюкозу и сахарозуСкачать

Получение сахарозы
Получение — довольно сложный и тонкий процесс. Для этого сахарный тростник или свеклу измельчают до мелких опилок и переносят в громадные диффузоры.
В них происходит процесс вымывания сахарозы под действием горячей воды.
Так как совместно с С12Н22О11 в раствор попадают примеси, для отделения данных продуктов через раствор пропускают гидроксид кальция Ca (OH2). После такой процедуры происходит образование почти нерастворимых солей, выпадающих в осадок (CaCO3), и растворимого сахарата кальция С12Н22О11*СаО*2Н2О.
Следующим шагом углекислый газ (СО2) добавляют к получившемуся раствору с целью разделения сахарата кальция.
В результате в осадок выпадает карбонат кальция, который отфильтровывается, а оставшийся раствор выпаривают в специальных вакуумных аппаратах. Далее образующиеся кристаллики разделяются при помощи центрифуги. Оставшийся раствор называется меласса. Он широко применяется для получения лимонной кислоты.
Полученная сахароза подвергается дополнительным очисткам, кристаллизации и упариванию.
Видео:Опыты по химии. Реакция глицерина с гидроксидом меди (II)Скачать

Сферы применения
Сахароза применяется во многих областях:
Видео:Качественная реакция на альдегиды с гидроксидом медиСкачать

Химические свойства
Формула — C12H22O11. Она не проявляет восстановительных свойств, а реакции идут обычно по гидроксильным группам:
Гидролиз дисахаридов — химическая реакция, при которой вода вступает в реакцию с другими веществами.
Для дисахаридов характерна данная реакция (среда должна быть кислой либо необходимо присутствие фермента) с образованием моносахаридов, то есть происходит диссоциация. Чтобы гидролизоваться, нужна кислота.
Гидролизация происходит при высокой температуре и в присутствии ионов водорода. В результате она расщепляется до молекулы глюкозы и молекулы фруктозы.
Уравнение реакции гидролиза сахарозы можно написать следующим образом: C12H22O11+H2O=C6H12O6 (глюкоза)+C6H12O6 (фруктоза).
Из моносахаридов можно получить дисахариды обратной реакцией. А также в живых существах данная реакция происходит при участии различных ферментов. Скорость протекания реакции зависит от количества С12Н22О11 в растворе.
💡 Видео
Качественная реакция на альдегиды с гидроксидом меди IIСкачать

получение оксида и гидроксида медиСкачать

Опыты по химии. Гидролиз сахарозыСкачать

Разложение гидроксида меди (II) при нагревании I ЕГЭ по химииСкачать

Получение гидроксида меди (II) и растворение его в кислотахСкачать

получение гидроксида меди IIСкачать

Опыты по химии. Получение гидроксида меди (II) и изучение его свойствСкачать

Опыты по химии. Окисление муравьиного альдегида гидроксидом меди (II)Скачать

Образование гидроксида меди (II)Скачать

Отсутствие восстановительных свойств у сахарозыСкачать

Реакция сульфата меди II ( медный купорос) с гидроксидом натрия ( щелочами)Скачать

Отсутствие восстанавливающей способности сахарозыСкачать

Доказательство наличия гидроксильных групп в сахарозеСкачать

качественная реакция глюкозы с гидроксидом меди.wmvСкачать