Читайте также:
|
Задание 1
Дайте определения кислот, оснований и солей с позиций теории электролитической диссоциации.
Кислота ― это электролит, при диссоциации которого образуются катионы водорода и анионы кислотного остатка.
Основание — это электролит, диссоциирующий на катионы металла и гидроксид-анионы.
Соль — это электролит, диссоциирующий на катионы металла и анионы кислотного остатка.
Задание 2
Вспомните понятие электроотрицательности (8 класс, §48). Объясните, почему ион водорода, образующийся при диссоциации кислот, имеет положительный заряд. Способность атома притягивать валентные электроны других атомов называют электроотрицательностью (ЭО). Ионы водорода, имея наименьший радиус, сильнее других ионов взаимодействует с молекулами воды по донорно-акцепторному механизму, образуя ион гидроксония H3O + .
Задание 3
При диссоциации молекулы кислоты образовался ион, который имеет заряд -3. Сколько ионов водорода при этом образовалось? Поскольку заряд аниона определяется числом ионов водорода, образовавшихся при диссоциации молекул кислоты, следовательно, образовалось 3 иона водорода.
Задание 4
Напишите уравнения электролитической диссоциации кислот и назовите образующиеся анионы:
а) азотной, серной;
HNO3 ⟶ H + + NO3 − нитрат-анионы
H2SO4 ⟶ 2H + + SO4 2− сульфат-анионы
б) бромоводородной HBr, азотистой HNO2.
HBr ⟶ H + + Br − бромид-анионы
HNO2 ⟶ H + + NO2 − нитрит-анионы
Задание 5
Составьте формулы следующих солей: нитрата бария, хлорида алюминия, карбоната натрия, фосфата калия. Напишите уравнения диссоциации этих солей.
Ba(NO3)2 ⟶ Ba 2+ + 2NO3 —
AlCl3 ⟶ Al 3+ + 3Cl —
Na2CO3 ⟶ 2Na + + CO3 2-
K3PO4 ⟶ 3K + + PO4 3-
Задание 6
Приведите по одному примеру солей при диссоциации одного моля которых образуются (напишите уравнения диссоциации):
а) два;
NaCl ⟶ Na + + Cl —
б) три;
BaCl2 ⟶ Ba 2+ + 2Cl —
в) четыре;
AlCl3 ⟶ Al 3+ + 3Cl —
г) пять молей ионов.
Fe2(SO4)3 ⟶ 2Fe 3+ + 3SO4 2-
Задание 7
Расставьте заряды ионов в формулах следующих веществ и назовите эти вещества:
а) Na2S, Na2SO4, MgSO4, Na3PO4, AlPO4;
Na2 + S 2- ― сульфид натрия
Na2 + SO4 2- ― сульфат натрия
Mg 2+ SO4 2- ― сульфат магния
Na3 + PO4 3- ― фосфат натрия
Al 3+ PO4 3- ― фосфат алюминия
б) NaHSO4, Mg(HSO4)2, CaHPO4, NaOH, Ba(OH)2.
Na + HSO4 — − гидросульфат натрия
Mg 2+ (HSO4)2 — − гидросульфат магния
Ca 2+ HPO4 2- − гидрофосфат кальция
Na + OH — − гидроксид натрия
Ba 2+ (OH)2 — − гидроксид бария
Задание 8
При диссоциации нитрата металла образовался 1 моль катионов, которые имеют заряд +2. Сколько молей нитрат-ионов при этом образовалось?
Me(NO3)2 ⟶ Me 2+ + 2NO3 —
Нитрат-ионы имеют заряд -1, значит образовалось 2 моль нитрат-ионов.
Задание 9
Составьте формулы и напишите уравнения диссоциации сульфата железа (II) и сульфата железа (III).
FeSO4 ⟶ Fe 2+ + SO4 2-
Fe2(SO4)3 ⟶ 2Fe 3+ + 3SO4 2-
Чем отличаются эти соли? Зарядом иона железа.
Задание 10
Пусть M обозначает металл, X – кислотный остаток. Приведите по одному примеру соли каждого типа. Ниже приведены четыре типа уравнений диссоциации солей:
а) MX ⟶ M 2+ + X 2- ;
CaSO4 ⟶ Ca 2+ + SO4 2-
б) MX3 ⟶ M 3+ + 3X — ;
Al(NO3)3 ⟶ Al 3+ + 3NO3—
в) M3X ⟶ 3M+ + X3-;
Na3PO4 ⟶ 3Na + + PO4 3-
г) M2X3 ⟶ 2M 3+ + 3X 2- .
Al2(SO4)3 ⟶ 2Al 3+ + 3SO4 2-
Задание 11
Напишите уравнения электролитической диссоциации следующих веществ: гидроксида натрия, серной кислоты, нитрата калия, хлорида магния, сульфата алюминия.
NaOH ⟶ Na + + OH —
H2SO4 ⟶ 2H + + SO4 2-
KNO3 ⟶ K + + NO3 —
MgCl2 ⟶ Mg 2+ + 2Cl —
Al2(SO4)3 ⟶ 2Al 3+ + 3SO4 2-
Задание 12
Напишите формулу вещества, при диссоциации которого образуются ионы кальция и гидроксид-ионы. Ca(OH) 2
Ca(OH)2 ⟶ Ca 2+ + 2OH —
Задание 13
Определите валентность и степень окисления кислорода в ионе гидроксония H3O + . В ионе гидроксония валентность кислорода равна III, а его степень окисления равна -2.
Задание 14
Напишите уравнения электролитической диссоциации, в результате которой образуются следующие пары ионов:
а) H + и NO3 — ;
HNO3 ⟶ H + + NO3 —
б) Al 3+ и SO4 2- ;
Al2(SO4)3 ⟶ 2Al 3+ + 3SO4 2-
в) Ca 2+ и H2PO4 — .
Ca(H2PO4)2 ⟶ Ca 2+ + 2H2PO4 —
Задание 15
Даны правые части уравнений диссоциации. Расставьте коэффициенты и завершите эти уравнения. Назовите исходные вещества:
а) … ⟶ H + + SO4 2- ;
Серная кислота H2SO4 ⟶ 2H + + SO4 2−
б) … ⟶ Na + + SO3 2- ;
Сульфит натрия Na2SO3 ⟶ 2Na + + SO3 2−
в) … ⟶ Ca 2+ + NO3 — ;
Нитрат кальция Ca(NO3)2 ⟶ Ca 2+ + 2NO3 −
г) … ⟶ Cu 2+ + Cl — ;
Хлорид меди (II) CuCl2 ⟶ Cu 2+ + 2Cl −
д) … ⟶ Fe 3+ + NO3 — ;
Нитрат железа (III) Fe(NO3)3 ⟶ Fe 3+ + 3NO3 −
е) … ⟶ Ba 2+ + OH — .
Гидроксид бария Ba(OH)2 ⟶ Ba 2+ + 2OH −
Задание 16
В растворе присутствуют ионы K + , Mg 2+ , NO3 — , SO4 2- . Какие вещества были растворены? Предложите два варианта ответа.
1) KNO3 и MgSO4
2) Mg(NO3)2 и K2SO4
Задание 17
Водный раствор содержит 0,8 моль ионов K + , 0,5 моль ионов Mg 2+ . Чему равно количество ионов NO3 — ? 1,8 моль
1) KNO3 ⟶ K + + NO3 —
[NO3 — ]1 = [K + ]=0,8 моль
2) Mg(NO3)2 ⟶ Mg 2+ + 2NO3 —
[NO3 — ]2 = 2 • [Mg 2+ ]=2•0,5 моль=1 моль
[NO3 — ]общ.= [NO3 — ]1 + [NO3 — ]2=0,8 моль + 1 моль=1,8 моль
Видео:Степень электролитической диссоциации. Сильные и слабые электролиты. 9 класс.Скачать

Школе NET
Register
Do you already have an account? Login
Login
Don’t you have an account yet? Register
Newsletter
Submit to our newsletter to receive exclusive stories delivered to you inbox!
- Главная
- Вопросы & Ответы
- Вопрос 2005807
Васян Коваль
Видео:Диссоциация. Сильные и слабые электролиты. Проводник второго рода. Химия – ПростоСкачать

Напишите уравнения процессов диссоциации следующих соединений: K2SO3, Na2S, NaCl, NaHSO3, NaHCO3, Fe(OH)2Cl, (FeOH)Cl2, AlCl3, Ba(OH)2, LiOH, Al(OH)3 Напишите пожалуйста если есть в несколько ступней!
Видео:Электролиты и неэлектролитыСкачать

Лучший ответ:
Таня Масян
K2SO3 = 2K[ ] SO3[2-]
Na2S = 2Na[ ] S[2-]
NaCl = Na[ ] Cl[-]
NaHCO3 = Na[ ] HCO3[-]
NaHSO3 = Na[ ] HSO3[-]
Fe(OH)Cl2 = Fe[3 ] OH[-] 2Cl[-]
иногда сложные катионы частично диссоциирует дальше. Можешь ограничится в данном случае только общим уравнением.
Fe(OH)Cl2 = Fe(OH)[2 ] 2Cl[-]
Fe(OH)[2 ] = Fe[3 ] OH[-]
общее: Fe(OH)2Cl = Fe[3 ] 2OH[-] Cl[-]
иногда сложные катионы частично диссоциирует дальше. Можешь ограничится в данном случае только общим уравнением.
Fe(OH)2Cl = Fe(OH)2[ ] Cl[-]
Fe(OH)2[ ] = Fe(OH)[2 ] OH[-]
Fe(OH)[2 ] = Fe [3 ] OH[-]
AlCl3 = Al[3 ] 2Cl[-]
1 ступень:Ba(OH)2 = Ba(OH)[ ] OH[-] (в две ступени)
2 ступень:Ba(OH)[ ] = Ba[2 ] OH[-]
общее:Ba(OH)2 = Ba[2 ] 2OH[-]
LiOH = Li[ ] OH[-]
Al(OH)3 = — практически нерастворим в воде, поэтому диссоциирует очень слабо, главным образом, по 1 ступени; т.к. основание 3-кислотное, то диссоциация ступенчатая:
1 ступень: Al(OH)3 = Al(OH)2[ ] OH[-]
2 ступень: Al(OH)2[ ] = Al(OH)[2 ] OH[-]
3 ступень: Al(OH)[2 ] = Al[3 ] OH[-]
🔥 Видео
Взаимодействие сульфата алюминия с раствором гидроксида натрия Al2(SO4)3 + NaOHСкачать

ХИМИЯ 11 класс : Электролиты и неэлектролитыСкачать

Успеть за 300 секунд, #7: Электролиты и неэлектролитыСкачать

ЭЛЕКТРОЛИТЫ И НЕЭЛЕКТРОЛИТЫСкачать

Электролитическая диссоциация. Тема 6. Электролиты и неэлектролиты.Скачать

Взаимодействие хлорида железа (III) с гидроксидом натрия FeCl3 + 3NaOH = Fe(OH)3 + 3NaClСкачать

NaOH+H2O+Al=Na(Al(OH)4)+H2+Q Гидроксид натрия реагирует с алюминием выделяется водородСкачать

Электролитическая диссоциация.Скачать

Электролитическая диссоциация. Тема 7. Сильные и слабые электролиты.Скачать

Как отличить слабый электролит от сильного?Скачать

Электролиз. Решение задач. 2 часть. 10 класс.Скачать

Авто.Как определить плотность электролита АКБ математическим способом, по напряжению на клеммах.Скачать

72. Электролитическая диссоциацияСкачать

Химия-9. Параграф 4. Электролитическая диссоциация.Скачать

Физические свойства элементов 2 (IIA) группы. 10 класс.Скачать

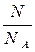 =
= 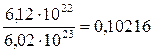 моль.
моль. . Пусть продиссоциировало х моль молекул HNO2. В соответствии с уравнением электролитической диссоциации:
. Пусть продиссоциировало х моль молекул HNO2. В соответствии с уравнением электролитической диссоциации: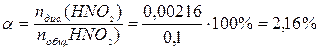 .
. , SO3; в) Na, Na + ?
, SO3; в) Na, Na + ?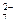 ; в) Ва 2+ и ОН — ; г) Са 2+ и NO
; в) Ва 2+ и ОН — ; г) Са 2+ и NO 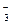 ; е) Mn 2+ и Br — ; ж) Na + и НСО
; е) Mn 2+ и Br — ; ж) Na + и НСО 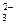 ;
;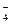 ; к) Са 2+ и НСО
; к) Са 2+ и НСО 
![Al(OH)3 + NaOH → Na[Al(OH)4] | Получение гидроксида алюминия и растворение его в избытке щёлочи](https://i.ytimg.com/vi/_u6eAdWg96A/0.jpg)

