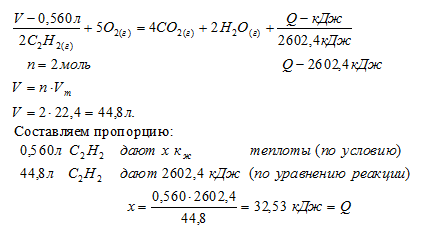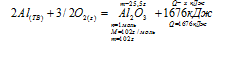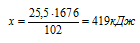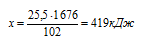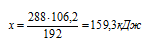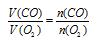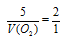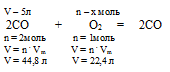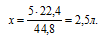Дано термохимическое уравнение реакции синтеза мочевины:
В результате реакции выделилось 25 кДж теплоты. Сколько граммов мочевины образовалось? Ответ округлите до ближайшего целого числа.
Решение . Составим пропорцию:
Из пропорции получаем:
Ответ просят округлить до ближайшего целого числа.
Видео:25. Схема реакции и химическое уравнениеСкачать

Качественные задачи на расчеты по термохимическому уравнению
Задача 1.
При сгорании 560 мл (н.у.) ацетилена согласно термохимическому уравнению:
2С2Н2(Г) + 5О2(г) = 4СО2(Г) + 2Н2О(Г) + 2602,4 кДж
выделилось:
1) 16,256 кДж; 2) 32,53кДж; 3) 32530 кДж; 4) 16265кДж
Дано:
объем ацетилена: V(С2Н2) = 560 мл.
Найти: количество выделившейся теплоты.
Решение:
Для выбора верного ответа удобнее всего провести расчет искомой в задаче величины и сравнить ее с предлагаемыми вариантами. Расчет по термохимическому уравнению ничем не отличается от расчета по обычному уравнению реакции. Над реакцией мы указываем данные в условии и искомые величины, под реакцией — их соотношения согласно коэффициентам. Теплота представляет собой один из продуктов, поэтому ее числовое значение мы рассматриваем как коэффициент.
Сравнивая полученный ответ с предложенными вариантами, видим, что подходит ответ № 2.
Небольшая хитрость, приводящая невнимательных учеников к неверному ответу № 3, заключалась в единицах измерения объема ацетилена. Объем, указанный в условии в миллилитрах, обязательно нужно было перевести в литры, так как молярный объем измеряется в (л/моль).
Изредка встречаются задачи, в которых термохимическое уравнение необходимо составить самостоятельно по значению теплоты образования сложного вещества.
Задача 1.2.
Теплота образования оксида алюминия равна 1676 кДж/моль. Определите тепловой эффект реакции, в которой при взаимодействии алюминия с кислородом получено
25,5г А12О3.
1) 140кДж; 2) 209,5кДж; 3) 419кДж; 4) 838кДж.
Дано:
теплота образования оксида алюминия: Qобр (А12О3) = = 1676 кДж/моль;
масса полученного оксида алюминия: m(А12О3) = 25,5 г.
Найти: тепловой эффект.
Решение:
Данный тип задач можно решить двумя способами:
I способ
Согласно определению теплота образования сложного вещества — это тепловой эффект химической реакции образования 1 моль этого сложного вещества из простых веществ.
Записываем реакцию образования оксида алюминия из А1 и О2. При расстановке коэффициентов в полученном уравнении учитываем, что перед А12О3 должен быть коэффициент «1», который соответствует количеству вещества в 1 моль. В этом случае мы можем использовать теплоту образования, указанную в условии:
2А1(ТВ) + 3/2О2(г) → А12О3(ТВ) + 1676 кДж
Получили термохимическое уравнение.
Для того чтобы коэффициент перед А12О3 остался равен «1», коэффициент перед кислородом должен быть дробным.
При записи термохимических уравнений допускаются дробные коэффициенты.
Рассчитываем количество теплоты, которое выделится при образовании 25,5 г А12О3:
при получении 25,5 г А12О3 выделяется х кДж (по условию)
при получении 102 г А12О3 выделяется 1676 кДж (по уравнению)
Подходит ответ № 3.
При решении последней задачи в условиях ЕГЭ можно было не составлять термохимическое уравнение. Рассмотрим этот способ.
II способ
Согласно определению теплоты образования 1676 кДж выделяется при образовании 1 моль А12О3. Масса 1 моль А12О3 составляет 102 г, следовательно, можно составить пропорцию:
1676 кДж выделяется при образовании 102 г А12О3
х кДж выделяется при образовании 25,5 г А12О3
Подходит ответ № 3.
Ответ: Q = 419кДж.
Задача 1.3.
При образовании 2 моль СuS из простых веществ выделяется 106,2 кДж теплоты. При образовании 288г СuS выделяется теплота количеством:
1) 53,1кДж; 2) 159,З кДж; 3) 212,4 кДж; 4) 26,6кДж
Решение:
Находим массу 2 моль СuS:
m(СuS) = n(СuS) . М(СuS) = 2 . 96 = 192 г.
В текст условия вместо значения количества вещества СuS подставляем массу 2 моль этого вещества и получаем готовую пропорцию:
при образовании 192 г СuS выделяется 106,2 кДж теплоты
при образовании 288 г СuS выделяется теплота количеством х кДж.
Подходит ответ № 2.
Второй вид задач можно решать как по закону объемных отношений, так и без его использования. Рассмотрим оба варианта решения на примере.
Задачи на применение закона объемных отношений:
Задача 1.4.
Определите объем кислорода (н.у.), который потребуется для сжигания 5 литров угарного газа (н.у.).
1) 5 л; 2) 10 л; 3) 2,5 л; 4) 1,5 л.
Дано:
объем угарного газа (н.у.): VСО) = 5 л.
Найти: объем кислорода (н.у.): V(О2) = ?
Решение :
В первую очередь необходимо составить уравнение реакции:
2СО + О2 = 2СО
n = 2 моль n =1 моль
Применяем закон объемных отношений:
Отношение 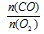
V(CO) возьмем из условия. Подставив все эти значения в закон объемных отношений, получим:
Отсюда: V(O2) = 5/2 = 2,5л.
Подходит ответ № 3.
Без использования закона объемных отношений задача решается с помощью расчета по уравнению:
Составляем пропорцию:
5 л С02 взаимодействуют с х л О2 (по условию) 44,8 л СО2 взаимодействуют с 22,4 л О2(по уравнению):
Получили тот же вариант ответа № 3.
Источник:
ЕГЭ. Химия. Расчетные задачи в тестах ЕГЭ. Части А, В, С / Д.Н. Турчен. — М.: Издательство «Экзамен», 2009. — 399 [1]с. (Серия «ЕГЭ. 100 баллов»). I8ВN 978-5-377-02482-8.
Видео:Решение задач на термохимические уравнения. 8 класс.Скачать

Тренажер задания 27 ЕГЭ по химии
Тренировочные упражнения по теме «Расчёты теплового эффекта (по термохимическим уравнениям)» в формате ЕГЭ по химии (тренажер задания 27 ЕГЭ по химии).
Теория по теме «Термохимические задачи» (теория для решения задания 27 ЕГЭ по химии):
Расчёты теплового эффекта (по термохимическим уравнениям).
Тренажер по теме «Термохимические задачи» — 10 вопросов, при каждом прохождении новые.
Тренировочный тест по теме «Термохимические задачи» — полный тест из всех вопросов.
Задание 1. Определите количество теплоты, которая выделится при взаимодействии 40 л азота (при н.у.) и 40 л водорода (при н.у.) по реакции, протекающей в соответствии c термохимическим уравнением:
Ответ выразите в кДж и запишите с точностью до десятых.
Задание 2. Рассчитайте количество теплоты (в кДж), которую нужно затратить для получения 56 л (н.у.) углекислого газа по реакции, протекающей в соответствии c термохимическим уравнением:
(Запишите число с точностью до десятых.)
Задание 3. Какой объём (в л.) кислорода потребуется для окисления 250 л оксида азота(II) до оксида азота(IV)? Объёмы газов измерены при одинаковых условиях. (Запишите число с точностью до целых.)
Задание 4. При образовании аммиака согласно уравнению реакции
выделилось 230 кДж теплоты. Определите объём (н.у.) вступившего в реакцию водорода. Ответ выразите в л и запишите с точностью до целых.
Задание 5. Определите количество теплоты, которая выделится при сгорании 44,8 л этена (н.у.) в 200 л (н.у.) кислорода в соответствии с термохимическим уравнением:
Выразите ответ в кДж и запишите с точностью до целых.
Задание 6. Определите количество теплоты, которое поглощается при разложении 2525 г технического нитрата калия, в котором массовая доля инертных примесей составляет 20%, в соответствии с термохимическим уравнением реакции.
Ответ выразите в кДж и запишите с точностью до целых.
Задание 7. Определите количество теплоты, которое поглощается при получении 100,8 л (н.у.) углекислого газа в соответствии с термохимическим уравнением реакции
Ответ выразите в кДж и запишите с точностью до десятых.
Задание 8. При образовании 340 г аммиака согласно уравнению реакции
выделилось 920 кДж теплоты. Определите объём (н.у.) водорода, который потребуется израсходовать, чтобы выделилось 230 кДж теплоты. Ответ выразите в л и запишите с точностью до целых.
Задание 9. В реакцию, термохимическое уравнение которой
вступило 8,51 г технического оксида магния, в котором массовая доля примесей составляет 6%. Определите количество выделившейся при этом теплоты. Ответ выразите в кДж и запишите с точностью до десятых.
Задание 10. При образовании 170 г аммиака согласно уравнению реакции
выделилось 460 кДж теплоты. Определите, какое количество теплоты выделится, если в реакцию вступит 20 л (при н.у.) водорода. Ответ выразите в кДж и запишите с точностью до десятых.
Задание 11. Согласно уравнению реакции
при сжигании 44,8 л оксида углерода(II) выделилось 566 кДж теплоты. Вычислите массу израсходованного кислорода, если в реакции выделилось 141,5 кДж теплоты. Ответ выразите в г и запишите с точностью до целых.
Задание 12. Какой объём углекислого газа образуется при сжигании 5 л угарного газа? (Выход продукта считать равным 100 %.) Объёмы газов измерены в одинаковых условиях. (Выразите ответ в литрах и запишите число с точностью до целых.)
Задание 13. В соответствии с термохимическим уравнением реакции
определите количество теплоты, необходимое для разложения 3,4 г нитрата серебра (Ответ выразите в кДж и запишите число с точностью до сотых.)
Задание 14. Какой объём кислорода потребуется для каталитического окисления 100 л аммиака до оксида азота(II)? Объёмы газов измерены при одинаковых условиях. (Ответ выразите в литрах и запишите число с точностью до целых.)
Задание 15. В соответствии с термохимическим уравнением
определите какое количество теплоты нужно затратить для получения 10,8 г серебра. (Ответ выразите в кДж и запишите число с точностью до сотых.)
Задание 16. Какой объём водорода потребуется для полного гидрирования 5,6 л пропена? Объёмы газов измерены при одинаковых условиях. (Ответ выразите в литрах и запишите число с точностью до десятых.)
Задание 17. В ходе реакции
выделилось 395 кДж тепла. Чему равна масса оксида серы(VI), полученного при этом? (Ответ выразите в граммах и запишите число с точностью до целых.)
Задание 18. Найдите объём азота, который образуется при горении 15 л аммиака. Объёмы газов измерены при одинаковых условиях. (Ответ выразите в литрах и запишите число с точностью до десятых.)
Задание 19. Какой объём кислорода потребуется для полного сгорания 10 л ацетилена? Объёмы газов измерены в одинаковых условиях. (Ответ выразите в литрах и запишите число с точностью до целых.)
Задание 20. Согласно термохимическому уравнению реакции
определите количество выделившейся теплоты при получении 31,36 л (н.у.) оксида азота(II). (Ответ выразите в кДж и запишите число с точностью до десятых.)
Задание 21. Какой объём кислорода необходим для окисления 40 л оксида азота(II)? Объёмы газов измерены в одинаковых условиях. (Ответ выразите в литрах и запишите число с точностью до целых.)
Задание 22. Согласно термохимическому уравнению реакции
Определите количество выделившейся теплоты при получении 15,68 л (н. у.) оксида азота(II) (Ответ выразите в кДж и запишите число с точностью до десятых.)
Задание 23. Определите объём газообразного продукта, который получится при взаимодействии 1,5 л водорода с избытком хлора. Объёмы газов измерены при одинаковых условиях. (Ответ выразите в литрах и запишите число с точностью до целых.)
Задание 24. Cогласно уравнению
определите сколько выделится теплоты при получении 25 г железа. (Ответ выразите в кДж и запишите число с точностью до целых.)
Задание 25. В результате реакции, термохимическое уравнение которой
выделилось 123 кДж теплоты. Определите объём (н.у.) получившегося при этом кислорода. (Ответ выразите в литрах и запишите число с точностью до десятых.)
Задание 26. Какой объём кислорода потребуется для полного сжигания 26 л угарного газа? Объёмы газов измерены при одинаковых условиях. (Ответ выразите в литрах и запишите число с точностью до целых.)
Задание 27. Найдите объём оксида углерода(VI), который образуется при сжигании 20 л угарного газа в избытке кислорода. Объёмы газов измерены при одинаковых условиях. (Ответ выразите в литрах и запишите число с точностью до целых.)
Задание 28. Согласно уравнению
определите сколько выделится теплоты при окислении 4,8 г угля до оксида углерода(II). (Ответ выразите в кДж и запишите число с точностью до целых.)
Задание 29. Найдите объём оксида серы(IV), который образуется при сжигании 32 л сероводорода в избытке кислорода. Объёмы газов измерены при одинаковых условиях. (Ответ выразите в литрах и запишите число с точностью до целых.)
Задание 30. В соответствии с термохимическим уравнением
определите массу угля которая при горении выделяет 98,5 кДж теплоты. (Ответ выразите в граммах и запишите число с точностью до целых.)
Задание 31. Какой объём кислорода потребуется для полного сгорания 6 л ацетилена? Объёмы газов измерены в одинаковых условиях. (Ответ выразите в литрах и запишите число с точностью до целых.)
💥 Видео
Орнитиновый цикл БИОХИМИЯ: цикл мочевины, обезвреживание аммиакаСкачать
Аммиак БИОХИМИЯ: обезвреживание аммиака биохимия, цикл мочевины, орнитиновый циклСкачать

Органика. Решение задачи на определение состава вещества по продуктам его сгорания.Скачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Установление эмпирической и молек. формул по массовым долям элем., входящих в состав в-ва. 10 класс.Скачать

Орнитиновый цикл. Регуляция. Обезвреживания аммиака. Синтез аспрататСкачать

Л.22 | РЕАКЦИИ МАТРИЧНОГО СИНТЕЗА | ОБЩАЯ БИОЛОГИЯ ЕГЭСкачать

Биохимия: Регуляция синтеза холестерола и желчных кислотСкачать

Шноль С. Э. - Введение в биоорганическую химию - Обмен веществСкачать

Как решать ОРГАНИЧЕСКИЕ ЦЕПОЧКИ? Основные типы химических реакцийСкачать

ЕГЭ Биология | Синтез белка. РЕАКЦИИ МАТРИЧНОГО СИНТЕЗАСкачать

2.15. Причина реакций ионного обмена | Неорганика к ЕГЭ | Георгий МишуровскийСкачать

Получение алканов. Реакция Дюма (механизм + сложные случаи). ЕГЭ по химии.Скачать

Решение задач на пластинки | Решение задач по химии | Химия ЕГЭ, ЦТ, ЦЭСкачать

Задание №35: вывод формулы органического соединения | Химия 10 класс | УмскулСкачать

Решение задач на тему: "Нахождение константы равновесия и равновесных концентраций". 3ч. 10 классСкачать