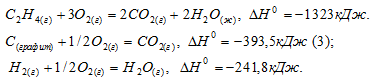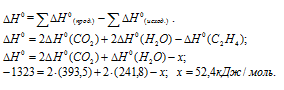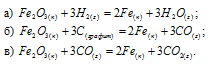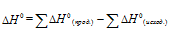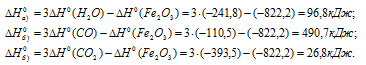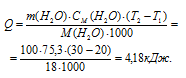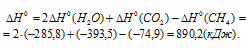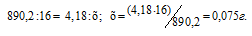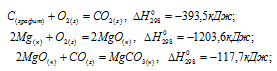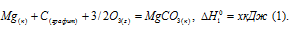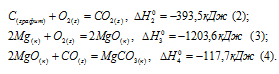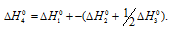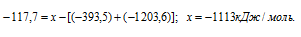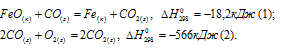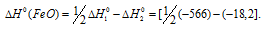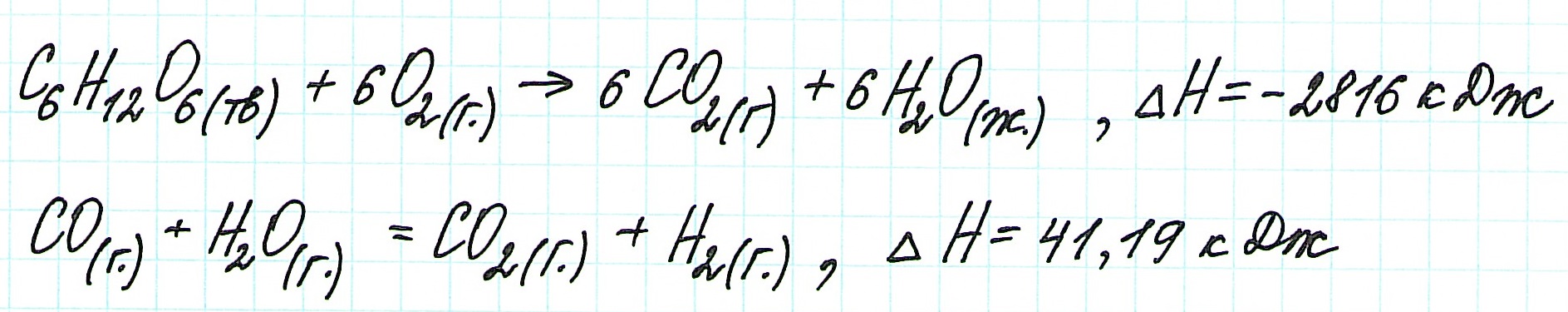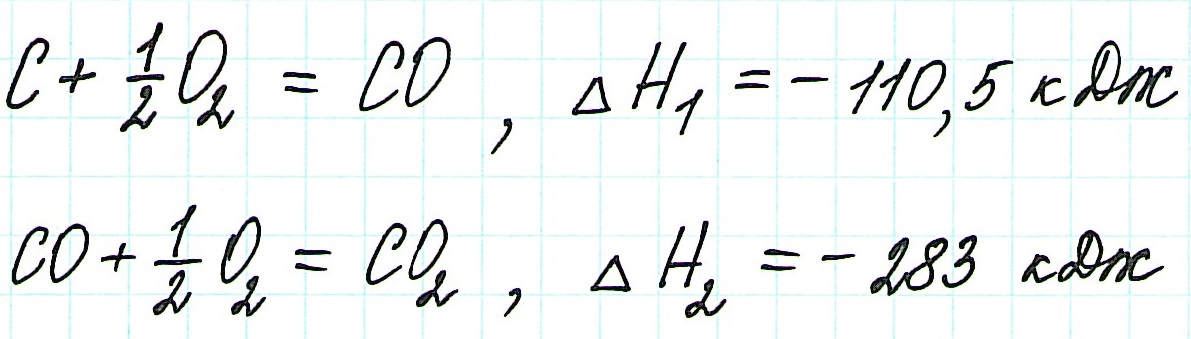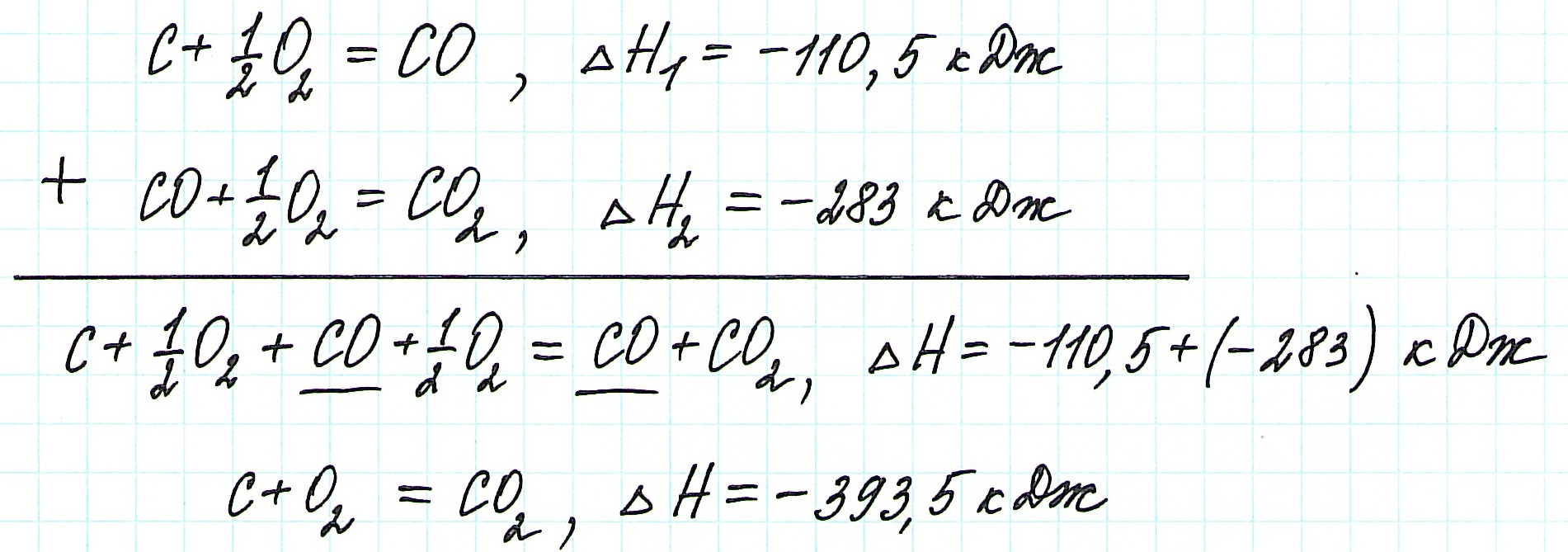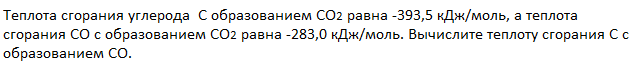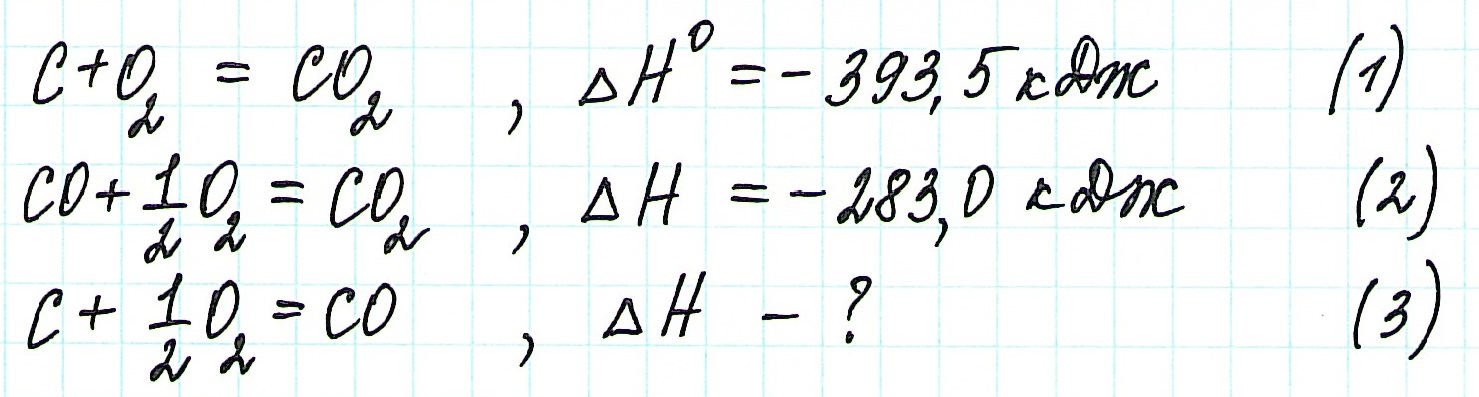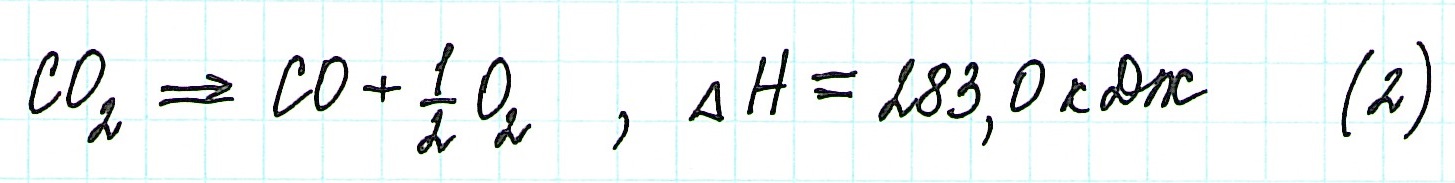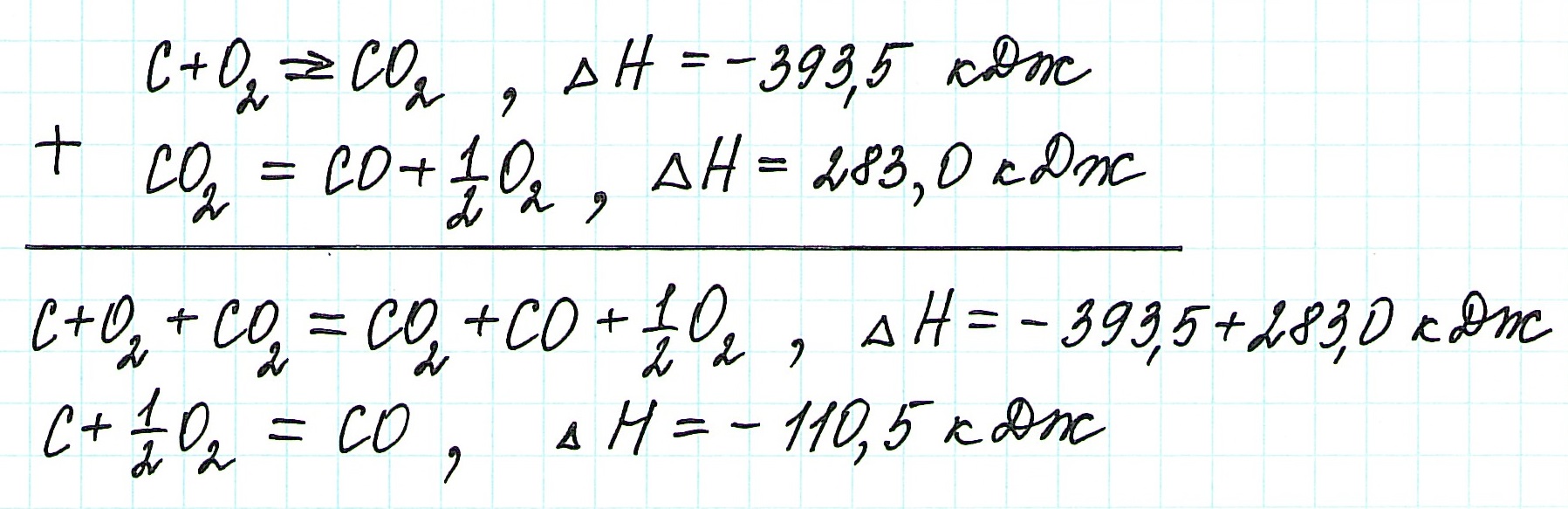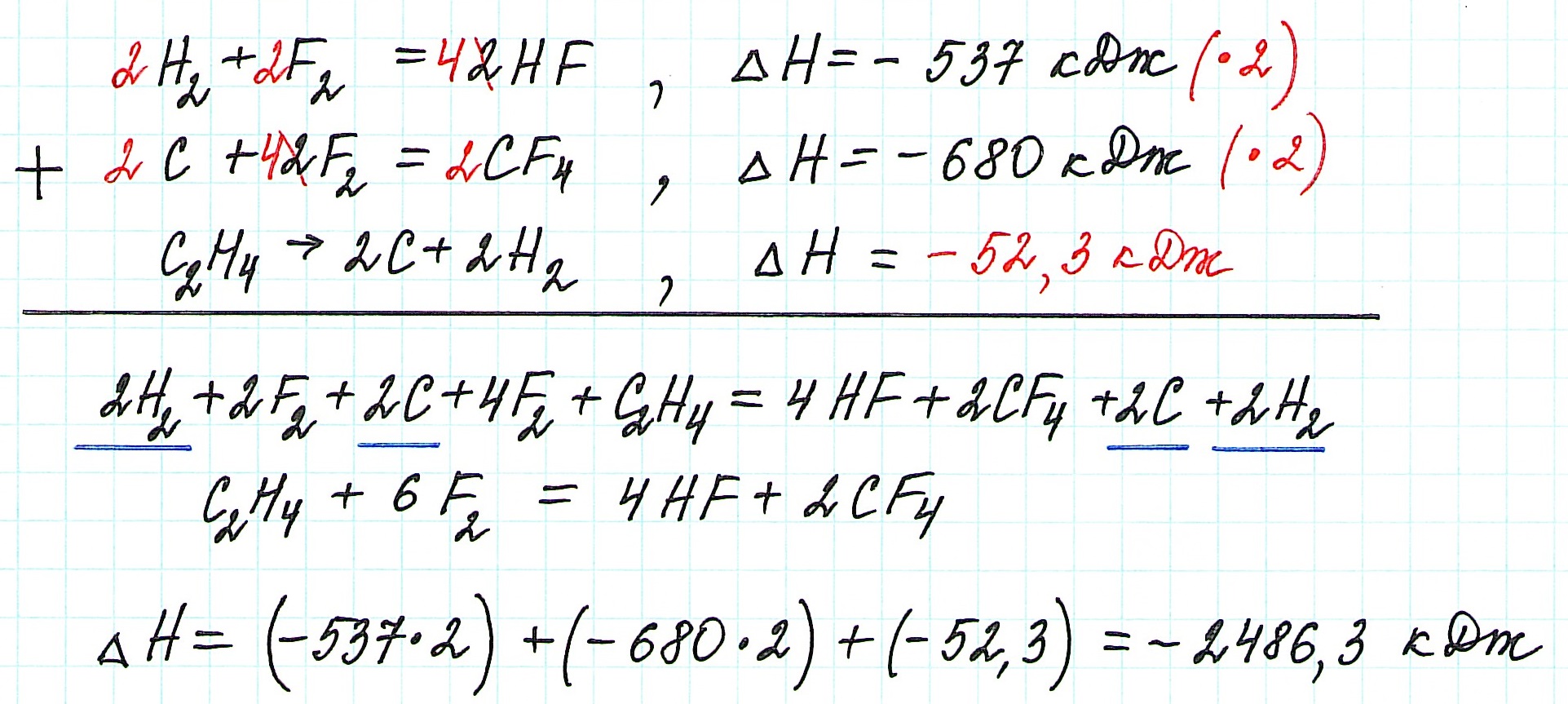- Задачи к разделу Основы термодинамики с решениями
- Задачи к разделу Основы термодинамики с решениями
- Закономерности протекания химических реакций. Теплоты образования веществ
- ЗАКОН ГЕССА И ЕГО СЛЕДСТВИЯ: РЕШЕНИЕ ТИПОВЫХ ЗАДАЧ
- Экзотермические и эндотермические реакции
- Закон Гесса как основной закон термохимии и примеры расчетов с его использованием
- Следствие из закона Гесса: вычисление энтальпии реакции
- Задачи к разделу Основы термодинамики с решениями
- Задачи к разделу Основы термодинамики с решениями
- Please wait.
- We are checking your browser. gomolog.ru
- Why do I have to complete a CAPTCHA?
- What can I do to prevent this in the future?
- Термохимические уравнения. лекция. практические задания
- 💥 Видео
Видео:Экзо- и эндотермические реакции. Тепловой эффект химических реакций. 8 класс.Скачать

Задачи к разделу Основы термодинамики с решениями
Здесь вы найдете примеры задач на вычисление таких термодинамических параметров как энтальпия, энтропия, энергия Гиббса. Определение возможности самопроизвольного протекания процесса, а также составление термохимических уравнений.
Видео:Решение задач на термохимические уравнения. 8 класс.Скачать

Задачи к разделу Основы термодинамики с решениями
Задача 1. Рассчитайте стандартную энтальпию и стандартную энтропию химической реакции. Определите в каком направлении при 298 °К (прямом или обратном) будет протекать реакция. Рассчитайте температуру, при которой равновероятны оба направления реакции.
Fe2O3 (к) + 3H2 = 2Fe(к) + 3H2O(г)
Используя справочные данные стандартных энтальпий веществ, находим:
Используя справочные данные стандартных энтропий веществ, находим:
При Т=298°К, ΔG > 0 – реакция не идет самопроизвольно, т.е. реакция будет протекать в обратном направлении.
Чтобы рассчитать температуру, при которой равновероятны оба направления реакции, надо ΔG приравнять к нулю:
При Т = 705,83 К реакция будет идти равновероятно как в прямом так и в обратном направлении.
Задача 2. Вычислите энергию Гиббса и определите возможность протекания реакции при температурах 1000 и 3000 К.
| Cr2O3 (т) + 3C (т) = 2Cr (т) + 3CO (г) | ||||
| ΔH298, кДж/моль | — 1141 | 0 | 0 | — 110,6 |
| ΔS298, Дж/(моль×К) | 81,2 | 5,7 | 23,6 | 197,7 |
Вычисления энергии Гиббса проводим согласно выражению:
Необходимо рассчитать энтальпию и энтропию химической реакции.
Используя справочные данные стандартных энтальпий веществ, находим:
Аналогично, используя справочные данные стандартных энтропий веществ, находим:
Найдем энергию Гиббса при 1000 К
ΔG1000 > 0, следовательно, реакция самопроизвольно не идет.
Найдем энергию Гиббса при 3000 К
ΔG3000 ˂ 0, следовательно, реакция протекает самопроизвольно.
Задача 3. Определите тепловой эффект сгорания жидкого CS2(ж) до образования газообразных СО2 и SO2. Сколько молей CS2 вступят в реакцию, если выделится 700 кДж тепла?
Уравнение реакции сгорания жидкого сероуглерода следующее:
Тепловой эффект реакции вычислим подставляя справочные данные стандартных энтальпий веществ в выражение:
Т.е. при сгорании 1 моля сероуглерода выделяется 1075,1 кДж тепла
а при сгорании x молей сероуглерода выделяется 700 кДж тепла
Найдем х:
x = 700·1/1075,1 = 0,65 моль
Итак, если в результате реакции выделится 700 кДж тепла, то в реакцию вступят 0,65 моль CS2
Задача 4. Вычислите тепловой эффект реакции восстановления оксида железа (II) водородом, исходя из следующих термохимических уравнений:
1. FeO (к) + CO (г) = Fe (к) + CО2 (г); ΔH1 = -18,20 кДж;
2. СO (г) + 1/2O2 (г) = СO2 (г) ΔН2 = -283,0 кДж;
3. H2 (г) + ½ O2 (г) = H2O (г) ΔН3 = -241,83 кДж.
Реакция восстановления оксида железа (II) водородом имеет следующий вид:
4. FeO (к) + H2 (г) = Fe (к) + H2O (г)
Чтобы вычислить тепловой эффект реакции необходимо применить закон Гесса, т.е. реакцию 4. можно получить, если сложить реакции 1. и 2. и вычесть реакцию 1.:
Таким образом, тепловой эффект реакции восстановления оксида железа (II) водородом равен
Задача 5. Реакция горения бензола выражается термохимическим уравнением:
С6Н6(ж) + 7½ О2(г) = 6СО2(г) + 3Н2О(г) – 3135,6 кДж.
Вычислите теплоту образования жидкого бензола. Определите теплотворную способность жидкого бензола при условии, что стандартные условия совпадают с нормальными.
Тепловой эффект реакции равен:
В нашем случае ΔHр-ции = – 3135,6 кДж, найдем теплоту образования жидкого бензола:
Теплотворная способность жидкого бензола вычисляется по формуле:
М(бензола) = 78 г/моль
QТ = – 3135,6· 1000 / 78 = — 4,02·10 4 кДж/кг
Теплотворная способность жидкого бензола QТ = — 4,02·10 4 кДж/кг
Задача 6. Реакция окисления этилового спирта выражается уравнением:
С2Н5ОН(ж) + 3,0 О2(г) = 2СО2(г) + 3Н2О(ж).
Определить теплоту образования С2Н5ОН(ж), зная ΔН х.р. = — 1366,87 кДж. Напишите термохимическое уравнение. Определите мольную теплоту парообразования С2Н5ОН(ж) → С2Н5ОН(г), если известна теплота образования С2Н5ОН(г), равная –235,31 кДж·моль -1 .
Исходя из приведенных данных, запишем термохимическое уравнение:
Тепловой эффект реакции равен:
Используя справочные данные теплот образования веществ, найдем теплоту образования С2Н5ОН(ж):
ΔH 0 C2H5OH(ж) = -277,36 кДж/моль
ΔH 0 парообразования = — 235,31 + 277,36 = 42,36 кДж/моль
Мы определили, что теплота образования С2Н5ОН(ж) равна
ΔH 0 C2H5OH(ж) = -277,36 кДж/моль
ΔH 0 парообразования = 42,36 кДж/моль
Задача 7. Чем можно объяснить, что при стандартных условиях, невозможна экзотермическая реакция:
СО2 (г)+Н2 (г) ↔ СО (г)+Н2О (ж)?
Рассчитайте ΔG данной реакции. При каких температурах данная реакция становится самопроизвольной?
Рассчитаем ΔG данной реакции:
Для этого сначала определим ΔH и ΔS реакции:
Используя справочные данные стандартных энтальпий веществ, находим:
Аналогично, используя справочные данные стандартных энтропий веществ, находим:
Найдем энергию Гиббса при стандартных условиях
следовательно, реакция самопроизвольно не идет.
Найдем при каких температурах данная реакция становится самопроизвольной.
В состоянии равновесия ΔGр-ции= 0, тогда
Задача 8. Рассчитав на основании табличных данных ΔG и ΔS, определите тепловой эффект реакции:
2 NO (г) + Cl2 (г) ↔ 2 NOCl(г).
При постоянных температуре и давлении, изменение энергии Гиббса связано с энтальпией и энтропией выражением:
На основании табличных данных рассчитаем ΔG и ΔS
ΔH = — 40,64 + 298 · (-121,04/1000) = — 76,7 кДж/моль
Тепловой эффект реакции ΔH = — 76,7 кДж/моль
Задача 9. С чем будет более интенсивно взаимодействовать газообразный хлористый водород (в расчете на 1 моль): с алюминием или с оловом? Ответ дайте, рассчитав ΔG 0 обеих реакций. Продуктами реакций являются твердая соль и газообразный водород.
Рассчитаем ΔG 0 для реакции взаимодействия газообразного хлористого водорода (в расчете на 1 моль) с алюминием
В реакции принимает участие 2 моль Al(т), тогда ΔGр-ции1 1 моля Al(т) равно
ΔG 0 р-ции 1 = -701,98 / 2 = -350,99 кДж/моль
Рассчитаем ΔG 0 для реакции взаимодействия газообразного хлористого водорода (в расчете на 1 моль) с оловом:
ΔG 0 р-ции 2 = -288,4 + 0- 0- 2·(-95,27) = -97,86 кДж/моль
Задача 10. Не прибегая к вычислениям, определите, какие знаки (>0, 0.
Видео:Задачи на ТЕПЛОВОЙ ЭФФЕКТ | Термохимические уравненияСкачать

Закономерности протекания химических реакций. Теплоты образования веществ
Задача 293.
Определить 
Решение:
Обозначим искомую величину [ 

Ответ: 52,4 кДж/моль.
Задача 294.
Сравнить 
Решение:
По табличным данным стандартные энтальпии образования Fe2O3(к), Н2O(г) и СО(г) соответственно равны -822,2, -241,8, -110,5 и -393,5 кДж/моль (стандартные энтальпии образования простых веществ принято считать равными нулю). Для расчета 
Ответ: а) 96,8 кДж; б) 490,7 кДж; в) 26,8 кДж.
Задача 295.
Найти массу метана, при полном сгорании которой (с образованием жидкой воды) выделяется теплота, достаточная для нагревания 100 г воды от 20 до 30°С. Мольную теплоемкость воды принять равной 75,3Дж/(моль . К).
Решение:
Мольная теплоёмкость (CM) – это количество теплоты, необходимое для нагревания одного киломоля вещества на один градус. Находим количество теплоты необходимое для нагревания 100 г воды от 20 0 С до 30 0 С по формуле:
Табличные данные стандартных энтальпий образования СН4(г), Н2О(ж) и СО2(г) соответственно равны -74,9, -285,8 и -393,5кДж/моль. Стандартные энтальпии простых веществ принято считать равными нулю.
Уравнение реакции горения метана имеет вид:
Стандартную энтальпию реакции рассчитаем, используя уравнение из следствия закона Гесса:
Теперь, учитывая, что при сгорании 1 моля метана выделяется 890,2 кДж теплоты, рассчитаем его массу, которая необходима для выделения 4,18 кДж теплоты из пропорции:
Ответ: 0,075г.
Задача 296.
Вычислить 
Решение:
Обозначим искомую величину через x, запишем термохимическое уравнение образования MgCO3 из простых веществ:
Затем запишем уравнения реакций образования CO2, MgO и MgCO3 из CO2 и MgO:
Из уравнений (1), (2) и (3) можно получить уравнение (4). Для этого нужно из уравнения (1) вычесть сумму уравнения (2) и ½ уравнения (3), получим:
Подставляя значения энтальпий образования веществ, находим искомую величину:
Ответ: -1113 кДж/моль.
Задача 297.
Исходя из 
вычислить 
FeO(к) + Н2(г) = Fe(к) + Н2О(г) (3)
Решение:
Так как оксид железа (II) при взаимодействии с оксидом углерода (II) образует железо и оксид углерода (IV), то значение 
Тогда 
Видео:Тепловой эффект химических реакций. Термохимические уравненияСкачать

ЗАКОН ГЕССА И ЕГО СЛЕДСТВИЯ: РЕШЕНИЕ ТИПОВЫХ ЗАДАЧ
Закон Гесса (1840 г.) представляет собой частный случай закона сохранения энергии. Он позволяет определить тепловой эффект химического взаимодействия, используя данные о состояниях веществ только в начале и в конце процесса. Для этого применяется так называемая формула закона Гесса, оформленная в виде формулировки следствия из него.
Итак, что же из себя представляет закон, о котором идет речь? Как, пользуясь им, можно проводить вычисления?
Видео:Термохимические реакции. Практическая часть - решение задачи. 9 класс.Скачать

Экзотермические и эндотермические реакции
Основной категорией химического процесса, с которой закон Гесса имеет дело, является тепловой эффект – главный объект термохимии.
Тепловым эффектом Q считают теплоту, либо подающуюся в систему, либо выделяющуюся из нее в ходе химического взаимодействия.
Так, если теплота подается в систему (то есть поглощается из внешней среды), то процесс является эндотермическим. Если теплота, наоборот, уходит из системы в окружающую среду, то процесс является экзотермическим.
Каждая реакция отображается с помощью уравнения. Если в уравнении указан тепловой эффект химического процесса, то такое уравнение называется термохимическим. В нем обязательно записываются либо агрегатные состояния веществ, определяющие общее состояние системы, либо их аллотропные модификации (в случае простых веществ).
Обозначения агрегатных состояний записываются нижним индексом в скобках рядом с химической формулой вещества.
Например, для экзотермического процесса:
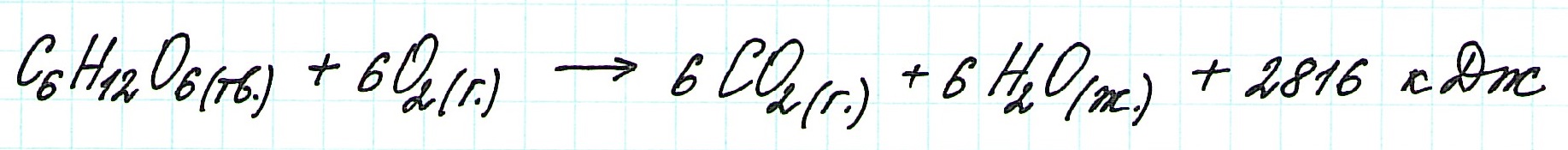

— (тв.) – твердое, или (к.) – кристаллическое;
Тепловой эффект Q реакции и изменение энтальпии ΔН имеют одинаковые численные значения, а по знаку противоположны:
В связи с этим приведенные выше уравнения можно записать так:
Видео:Химия ЦТ | Задачи по термохимическим уравнениямСкачать

Закон Гесса как основной закон термохимии и примеры расчетов с его использованием
Закон Гесса констатирует:
При экзотермическом взаимодействии углерода (графита) и кислорода образуется углекислый газ. У этого процесса есть два возможных пути: напрямую или через промежуточную стадию, идущую с образованием угарного газа (оксида углерода (II)):
При прямом процессе, идущем непосредственно с образованием углекислого газа, выделяется 393,5 кДж энергии:
Если процесс взаимодействия графита с кислородом идет в две стадии, то каждая из них также сопровождается выделением энергии:
Просуммируем эти два уравнения:
Получаем то же, что и в первом случае (то есть при прямом взаимодействии графита с кислородом): выделяется 393,5 кДж энергии.
Таким образом, результат реакции совершенно не зависит как от пройденного пути, так и от количества промежуточных стадий. Важными оказываются состояния веществ: начальное и конечное.
Прежде, чем рассмотреть примеры расчетов, в которых используется формула закона Гесса, необходимо сделать некоторые уточнения:
1) результаты термохимических расчетов (и измерений) всегда относят к одному молю вещества, которое образуется в ходе реакции;
2) теплота образования – это количество теплоты, выделяющееся при реакции простых веществ с образованием 1 моля продукта;
3) теплоты образования простых веществ принимают за ноль;
4) если прямой процесс является экзотермическим, то обратный будет эндотермическим, и наоборот.
Пример 1.
Запишем термохимические уравнения реакций, о которых идет речь:
Представим уравнение (2) так, чтобы СО стал конечным продуктом реакции, а не исходным веществом. Для этого запишем уравнение в обратном виде. Теплота сгорания по знаку в таком случае станет противоположной:
Для получения ответа на вопрос задачи (по закону Гесса) просуммируем уравнения (1) и (2):
Таким образом, при сгорании углерода с образованием угарного газа выделяется 110,5 кДж энергии.
Пример 2.
В реакции, для которой требуется вычислить теплоту:
- участвуют 1 молекула этилена и 6 молекул фтора;
- образуются 2 молекулы тетрафторуглерода и 4 молекулы фтороводорода.
— в первой из данных по условию реакций все коэффициенты и теплоту реакции умножим на 2, чтобы получить 4 молекулы фтороводорода;
— во второй реакции также все коэффициенты и теплоту реакции умножим на 2, чтобы получить 2 молекулы тетрафторуглерода;
— уравнение третьей реакции запишем в обратном виде, чтобы этилен стал исходным веществом, а не продуктом реакции;
— изменим знак теплоты третьей реакции на противоположный, так как ее уравнение записываем в обратном виде.
Просуммируем все уравнения:
Таким образом, теплота реакции этилена с фтором ΔН= -2486,3 кДж.
Видео:Химия | Тепловой эффект химической реакции (энтальпия)Скачать

Следствие из закона Гесса: вычисление энтальпии реакции
Чаще всего в вычислениях применяется не сам закон Гесса, а следствие из него. Оно позволяет вычислить как изменение энтальпии реакции, так и энтальпию образования любого из участников химического взаимодействия.
Следствие утверждает, что

А если учесть коэффициенты, то так:
Для вычислений обычно применяют стандартные энтальпии образования, так как именно в стандартных состояниях вещества наиболее устойчивы:
Стандартные теплоты (энтальпии) образования являются табличными величинами.
Задача 1. Используя данные таблицы стандартных термодинамических величин , вычислите изменение энтальпии для реакции:
Решение:
Задача 2.
Решение:
Задача 3. 
Тепловой эффект в термодинамическом уравнении относят к 1 молю образующегося вещества. С учетом этого запишем уравнение реакции следующим образом:
Следовательно, для данной реакции термохимическое уравнение будет выглядеть так:
В дополнение ко всему сказанному отметим, что некоторые тепловые эффекты реакций, идущих при стандартном давлении, меняются с температурой. Однако эти изменения незначительны. Поэтому при выполнении термодинамических вычислений для нестандартных условий можно использовать стандартные величины теплот образования. Появится в итоге небольшая ошибка, что вполне допускается.
Таким образом, закон Гесса, а также следствие из него позволяют проводить расчеты, в основе которых лежат тепловые явления химических процессов.
Далее будут рассмотрены случаи, в которых используется формула закона Гесса для расчета таких термодинамических величин, как энтропия и энергия Гиббса.
Видео:ДВИ по химии. Термохимия. Уравнение Аррениуса, закон Гесса, задачи на теплоемкостьСкачать

Задачи к разделу Основы термодинамики с решениями
Здесь вы найдете примеры задач на вычисление таких термодинамических параметров как энтальпия, энтропия, энергия Гиббса. Определение возможности самопроизвольного протекания процесса, а также составление термохимических уравнений.
Видео:09 Фаз диагр двухкомп сист 3 растворыСкачать

Задачи к разделу Основы термодинамики с решениями
Задача 1. Рассчитайте стандартную энтальпию и стандартную энтропию химической реакции. Определите в каком направлении при 298 °К (прямом или обратном) будет протекать реакция. Рассчитайте температуру, при которой равновероятны оба направления реакции.
Fe2O3 (к) + 3H2 = 2Fe(к) + 3H2O(г)
Используя справочные данные стандартных энтальпий веществ, находим:
Используя справочные данные стандартных энтропий веществ, находим:
При Т=298°К, ΔG > 0 – реакция не идет самопроизвольно, т.е. реакция будет протекать в обратном направлении.
Чтобы рассчитать температуру, при которой равновероятны оба направления реакции, надо ΔG приравнять к нулю:
При Т = 705,83 К реакция будет идти равновероятно как в прямом так и в обратном направлении.
Задача 2. Вычислите энергию Гиббса и определите возможность протекания реакции при температурах 1000 и 3000 К.
| Cr2O3 (т) + 3C (т) = 2Cr (т) + 3CO (г) | ||||
| ΔH298, кДж/моль | — 1141 | 0 | 0 | — 110,6 |
| ΔS298, Дж/(моль×К) | 81,2 | 5,7 | 23,6 | 197,7 |
Вычисления энергии Гиббса проводим согласно выражению:
Необходимо рассчитать энтальпию и энтропию химической реакции.
Используя справочные данные стандартных энтальпий веществ, находим:
Аналогично, используя справочные данные стандартных энтропий веществ, находим:
Найдем энергию Гиббса при 1000 К
ΔG1000 > 0, следовательно, реакция самопроизвольно не идет.
Найдем энергию Гиббса при 3000 К
ΔG3000 ˂ 0, следовательно, реакция протекает самопроизвольно.
Задача 3. Определите тепловой эффект сгорания жидкого CS2(ж) до образования газообразных СО2 и SO2. Сколько молей CS2 вступят в реакцию, если выделится 700 кДж тепла?
Уравнение реакции сгорания жидкого сероуглерода следующее:
Тепловой эффект реакции вычислим подставляя справочные данные стандартных энтальпий веществ в выражение:
Т.е. при сгорании 1 моля сероуглерода выделяется 1075,1 кДж тепла
а при сгорании x молей сероуглерода выделяется 700 кДж тепла
Найдем х:
x = 700·1/1075,1 = 0,65 моль
Итак, если в результате реакции выделится 700 кДж тепла, то в реакцию вступят 0,65 моль CS2
Задача 4. Вычислите тепловой эффект реакции восстановления оксида железа (II) водородом, исходя из следующих термохимических уравнений:
1. FeO (к) + CO (г) = Fe (к) + CО2 (г); ΔH1 = -18,20 кДж;
2. СO (г) + 1/2O2 (г) = СO2 (г) ΔН2 = -283,0 кДж;
3. H2 (г) + ½ O2 (г) = H2O (г) ΔН3 = -241,83 кДж.
Реакция восстановления оксида железа (II) водородом имеет следующий вид:
4. FeO (к) + H2 (г) = Fe (к) + H2O (г)
Чтобы вычислить тепловой эффект реакции необходимо применить закон Гесса, т.е. реакцию 4. можно получить, если сложить реакции 1. и 2. и вычесть реакцию 1.:
Таким образом, тепловой эффект реакции восстановления оксида железа (II) водородом равен
Задача 5. Реакция горения бензола выражается термохимическим уравнением:
С6Н6(ж) + 7½ О2(г) = 6СО2(г) + 3Н2О(г) – 3135,6 кДж.
Вычислите теплоту образования жидкого бензола. Определите теплотворную способность жидкого бензола при условии, что стандартные условия совпадают с нормальными.
Тепловой эффект реакции равен:
В нашем случае ΔHр-ции = – 3135,6 кДж, найдем теплоту образования жидкого бензола:
Теплотворная способность жидкого бензола вычисляется по формуле:
М(бензола) = 78 г/моль
QТ = – 3135,6· 1000 / 78 = — 4,02·10 4 кДж/кг
Теплотворная способность жидкого бензола QТ = — 4,02·10 4 кДж/кг
Задача 6. Реакция окисления этилового спирта выражается уравнением:
С2Н5ОН(ж) + 3,0 О2(г) = 2СО2(г) + 3Н2О(ж).
Определить теплоту образования С2Н5ОН(ж), зная ΔН х.р. = — 1366,87 кДж. Напишите термохимическое уравнение. Определите мольную теплоту парообразования С2Н5ОН(ж) → С2Н5ОН(г), если известна теплота образования С2Н5ОН(г), равная –235,31 кДж·моль -1 .
Исходя из приведенных данных, запишем термохимическое уравнение:
Тепловой эффект реакции равен:
Используя справочные данные теплот образования веществ, найдем теплоту образования С2Н5ОН(ж):
ΔH 0 C2H5OH(ж) = -277,36 кДж/моль
ΔH 0 парообразования = — 235,31 + 277,36 = 42,36 кДж/моль
Мы определили, что теплота образования С2Н5ОН(ж) равна
ΔH 0 C2H5OH(ж) = -277,36 кДж/моль
ΔH 0 парообразования = 42,36 кДж/моль
Задача 7. Чем можно объяснить, что при стандартных условиях, невозможна экзотермическая реакция:
СО2 (г)+Н2 (г) ↔ СО (г)+Н2О (ж)?
Рассчитайте ΔG данной реакции. При каких температурах данная реакция становится самопроизвольной?
Рассчитаем ΔG данной реакции:
Для этого сначала определим ΔH и ΔS реакции:
Используя справочные данные стандартных энтальпий веществ, находим:
Аналогично, используя справочные данные стандартных энтропий веществ, находим:
Найдем энергию Гиббса при стандартных условиях
следовательно, реакция самопроизвольно не идет.
Найдем при каких температурах данная реакция становится самопроизвольной.
В состоянии равновесия ΔGр-ции= 0, тогда
Задача 8. Рассчитав на основании табличных данных ΔG и ΔS, определите тепловой эффект реакции:
2 NO (г) + Cl2 (г) ↔ 2 NOCl(г).
При постоянных температуре и давлении, изменение энергии Гиббса связано с энтальпией и энтропией выражением:
На основании табличных данных рассчитаем ΔG и ΔS
ΔH = — 40,64 + 298 · (-121,04/1000) = — 76,7 кДж/моль
Тепловой эффект реакции ΔH = — 76,7 кДж/моль
Задача 9. С чем будет более интенсивно взаимодействовать газообразный хлористый водород (в расчете на 1 моль): с алюминием или с оловом? Ответ дайте, рассчитав ΔG 0 обеих реакций. Продуктами реакций являются твердая соль и газообразный водород.
Рассчитаем ΔG 0 для реакции взаимодействия газообразного хлористого водорода (в расчете на 1 моль) с алюминием
В реакции принимает участие 2 моль Al(т), тогда ΔGр-ции1 1 моля Al(т) равно
ΔG 0 р-ции 1 = -701,98 / 2 = -350,99 кДж/моль
Рассчитаем ΔG 0 для реакции взаимодействия газообразного хлористого водорода (в расчете на 1 моль) с оловом:
ΔG 0 р-ции 2 = -288,4 + 0- 0- 2·(-95,27) = -97,86 кДж/моль
Задача 10. Не прибегая к вычислениям, определите, какие знаки (>0, 0.
Видео:Кристаллогидраты. Задачи повышенной сложности. Часть 2.Скачать

Please wait.
Видео:Влияние температуры на скорость химических реакций. 10 класс.Скачать

We are checking your browser. gomolog.ru
Видео:Гальванические элементы. 1 часть. 10 класс.Скачать

Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
Видео:Электроды и гальванические элементыСкачать

What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 70648e6aed934c1a • Your IP : 87.119.247.227 • Performance & security by Cloudflare
Видео:Решение задач на вычисление энергии Гиббса. 2 часть. 10 класс.Скачать
Термохимические уравнения. лекция. практические задания
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
Рабочие листы и материалы для учителей и воспитателей
Более 2 500 дидактических материалов для школьного и домашнего обучения
311 лекций для учителей,
воспитателей и психологов
Получите свидетельство
о просмотре прямо сейчас!
Термохимические уравнения включают в себя кроме химических формул тепловой эффект реакции. Числовое значение в уравнении реакции строго соответствует количествам веществ, участников реакции, т.е. коэффициентам. Благодаря этому соответствию, можно установить пропорциональные отношения между количеством вещества или массой и количеством теплоты в этой реакции.
Например: Термохимическое уравнение разложения малахита
( CuOH ) 2 CO 3 = 2 CuO + H 2 O + CO 2 — 47 кДж
Мы видим, что на разложение 1 моля малахита необходимо израсходовать 47 кДж, при этом образуется 2 моля оксида меди, 1 моль воды и 1 моль углекислого газа. Если мы затратим энергии в 2 раза больше, мы сумеем разложить 2 моля малахита, при этом получим 4 моля оксида меди, 2 моля воды и 2 моля углекислого газа.
Аналогично можно установить пропорциональные отношения, используя коэффициенты и молярные массы участников реакции. 47 кДж энергии затратится на разложение 94 г малахита, при этом выделится 160 г оксида меди, 18 г воды и 44 г углекислого газа. Пропорция несложная, но, используя массовые числа, учащиеся часто допускают расчетные ошибки, поэтому я рекомендую решать задачи с пропорциями через количество вещества.
Задача 1. Определите количество теплоты, которое выделится при образовании 120 г MgO в результате реакции горения магния, с помощью термохимического уравнения.
2 Mq + O 2 = 2 MqO + 1204 кДж
1) Определяем количества оксида магния, используя формулу для нахождения количества вещества через массу.
n ( MqO ) = 120г/ 40 г/моль = 3 моль
2) Составляем пропорцию с учетом коэффициентов в уравнении реакции
💥 Видео
2. Комплексообраз, лигандыСкачать

Галогены: фтор, хлор, бром и иод | Химические свойства #галогены #химия #видеоурок #егэхимияСкачать

Кондуктометрическое титрование (NaOH + HCl → NaCl + H₂O)Скачать

sp2-гибридизацияСкачать

Галогены (F, Cl, Br, I). Химические свойстваСкачать