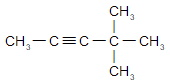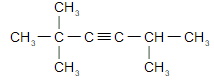- Основные разделы
- Контрольные работы
- Ответы на контрольную работу по теме «Металлы»(Габриелян)
- Решить цепочку CO2 + H2O — — — (фотосинтез)Х1 — — — (брожение)Х2 — — — — ( + О2, ферменты) — — — Х3( + Сl2) — — — Х4 ?
- Даны три простых вещества — А, В, С?
- Даны три простых вещества — А, В, С?
- Напишите структурную формулу вещества С3Н6О2, если известно, что его водный раствор изменяет окраску метилового оранжевого в красный цвет, с хлором это вещество образует соединение С3Н5ClО2, а при наг?
- Какие группы веществ дают реакцию серебряного зеркала?
- Помогите сделать цепочку превращений?
- Какое соединение образуется при взаимодействии оксида алюминия с раствором гидроксида калия?
- Напишите структурные формулы этанола, этиленгликоля и фенола?
- Какие группы веществ дают реакцию серебрянного зеркала?
- О наличии каких функциональных групп свидетельствует образование красного осадка при нагревании глюкозы с гидроксидом меди 2 ?
- При электролизе водного раствора нитрата меди(2) на катоде выделился металл?
- Дана цепочка превращений определите формулы веществ 1 4 и напишите уравнения реакций
- 🎬 Видео
Видео:Решение цепочек превращений по химииСкачать

Основные разделы
Видео:Химические Цепочки — Решение Цепочек Химических Превращений // Химия 8 классСкачать

Контрольные работы
Видео:Химические Цепочки — Решение Цепочек Химических Превращений // Химия 8 классСкачать

Ответы на контрольную работу по теме «Металлы»(Габриелян)
- Post category:Контрольные работы по химии 9 класс
- Reading time: 12 минут чтения
ЗАДАНИЕ 1
Напишите уравнения возможных реакций взаимодействия натрия и цинка с веществами: хлором, водой, соляной кислотой.
Рассмотрите одну из записанных реакций в свете ОВР.
2Nа + 2Н2О = 2NаОН + Н2
2Nа + 2НСl = 2NаСl + Н2
2Nа + Cl2 = 2NаСl
Zn + Cl2 = ZnCl2
Zn0 -2e→Zn2+ окисляется, восстановитель
Cl20+2e→2Cl- восстанавливается, окислитель
Zn + H2O = ZnO + H2.
Zn + 2HCl = ZnCl2 + H2
ЗАДАНИЕ 2
Напишите уравнения реакций, с помощью которых можно осуществить превращения по схеме
Fe →FeCl2 →Fe(N03)2 →Fe(OH)2 →FeO.
Превращение 3 рассмотрите в свете ТЭД.
Fe + 2HCl = FeCl2 + H2
FeCl2 + 2AgNO3 = 2AgCl + Fe(NO3)2
Fe(NO3)2 + 2NaOH = Fe(OH)2 + 2NaNO3
Fе2++ 2NO3-+ 2Na++2OH- =2Na++2NO3-+ Fе(ОН)2
Fе2++ 2OH- = Fе(ОН)2
Fе(ОН)2= FеО+ Н2О
ЗАДАНИЕ 3
При взаимодействии 12 г магния с избытком соляной кислоты выделилось 10 л водорода (н. у.). Вычислите объемную долю выхода продукта реакции.
Mg + 2HCl = MgCl2 + H2
n (Mg) = 12/24 = 0,5 моль
V (H2) = 10/22,4 = 0,446 моль
n (Mg) = n (H2) по уравнению (теор.)
выход = 0,446 /0,5 = 0,89 = 89 %
ЗАДАНИЕ 1
Напишите уравнения возможных реакций лития и меди с веществами: хлором, водой, соляной кислотой.
Рассмотрите одну из записанных реакций в свете ОВР.
2Li + Cl2 = 2LiCl
2Li + 2H2O = 2LiOH + H2
2Li + 2HCl = 2LiCl + H2
Cu + Cl2 = CuCl2
Cu + H2O = не реагирует
Cu + HCl = не реагирует
2Li+CL2= 2LiCL
Li- e—> Li+ восстановитель
CL2+2e—-> 2CL- окислитель
ЗАДАНИЕ 2
Напишите уравнения реакций, с помощью которых можно осуществить превращения по схеме
Са →CaO →Са(ОН)2 →Ca(N03)2 → Са3(Р04)2.
Превращение 3 рассмотрите в свете ТЭД.
2Ca+O2=2CaO
CaO+2NaOH=Ca(OH)2+Na2O
2HNO3 + Ca(OH)2 =Ca(NO3)2 + 2H2O
2H+ +2NO3- + Ca(OH)2 =Ca2+ +2NO3- + 2H2O
2H+ + Ca(OH)2 =Ca2+ +2H2O
3Ca(NO3)2 + 2Н3PO4 = Ca3(PO4)2 + 6HNO3
ЗАДАНИЕ 3
При термическом разложении 10 г известняка было получено 1,68 л углекислого газа (н. у.). Вычислите объемную долю выхода продукта реакции.
CaCO3 = CaO+CO2
n (CaCO3) = 10/100 = 0,1 моль
V (CO2) = 1,68/22,4 = 0,075 моль
n (CaCO3) = n (CO2) по уравнению (теор.)
выход = 0,075/0,1 = 0,75 = 75 %
ЗАДАНИЕ 1
Напишите уравнения возможных реакций кальция и железа с веществами: хлором, водой, соляной кислотой.
Рассмотрите одну из записанных реакций в свете ОВР.
Са + Cl2 = CaCl2
Ca + 2HCl = CaCl2 + H2
Ca + 2H2O = Ca(OH)2 + H2
2Fe + 3Cl2 = 2FeCl3
Fe + 2HCl = FeCl2 + H2
ЗАДАНИЕ 2
Напишите уравнения реакций, с помощью которых можно осуществить превращения по схеме:
Аl →Аl203 →АlСl3 →Аl(ОН)3 →Al(N03)3.
Превращение 3 рассмотрите в свете ТЭД.
4Al + 3O2 = 2 Al2O3
Al2O3 + 6HCl = 2AlCl3 + 3H2O
AlCl3 + 3NH3 + 3H2O = Al(OH)3 + 3NH4Cl
Al3+ +3Cl- + 3NH3 + 3H2O = Al(OH)3 + 3NH4+ +Cl-
Al3+ + 3NH3 + 3H2O = Al(OH)3 + 3NH4+
Аl(ОН)3+3НNО3=Аl(NО3)3+3Н2О.
ЗАДАНИЕ 3
При взаимодействии 23 г натрия с водой было получено 8,96 л водорода (н. у.). Найдите объемную долю выхода продукта реакции (в %).
2Na + 2H2O = 2NaOH + H2 ↑
n (Na) = 23/23= 1 моль
V (H2) = 8,96/22,4 = 0,4 моль
n (Na) : n (H2) = 2:1
n (H2) = 1/ 2 = 0,5 моль по уравнению (теор.)
выход = 0,4/0,5 = 0,8 = 80 %
ЗАДАНИЕ 1
Напишите уравнения возможных реакций металлов калия и магния с хлором, водой, соляной кислотой.
Рассмотрите одну из этих реакций в свете ОВР.
2K + 2H2O = 2KOH + H2.
2К + CI2 = 2КCI
2К + 2HCI = 2КCI + H2
Mg + 2HCl = MgCl2 + H2
Mg + Cl2 = MgCl2
Mg 0 -2e→ Mg 2+ окисляется, восстановитель
Cl20+2e→2Cl- восстанавливается, окислитель
Mg+2H2O=Mg(OH)2+H2
ЗАДАНИЕ 2
Напишите уравнения реакций для данных переходов:
Li →Li20 →LiOH →Li2S04.
Превращение 3 рассмотрите в свете ТЭД.
4Li + O2 = 2Li2O
Li2O + H2O = 2LiOH
2LiOH + Н2SO4 = Li2SO4 + 2Н2О
2Li+ +2OH- + 2Н+ +SO42- = 2Li+ +SO42- + 2Н2О
2OH- + 2Н+ — = 2Н2О
ЗАДАНИЕ 3
При взаимодействии 60 г кальция с водой выделилось 30 л водорода (н. у.). Найдите объемную долю выхода продукта реакции.
Са + 2Н2О = Са(ОН)2 + Н2
n (Са) = 60/40= 1,5 моль
V (H2) = 30/22,4 = 1,34 моль
n (Са) = n (H2) = по уравнению (теор.)
выход = 1,34/1,5 = 0,89 = 89 %
ЗАДАНИЕ 1
Напишите уравнения возможных реакций магния и алюминия с веществами: кислородом, бромом, разбавленной серной кислотой.
Рассмотрите две из этих реакций в свете ОВР, а одну — в свете ТЭД.
2 Мg + O2 = 2 МgО
Мg 0 -2e→ Мg 2+ окисляется, восстановитель
О20+4e→2 О 2- восстанавливается, окислитель
Мg + Br 2 = Мg Br2
Мg 0 -2e→ Мg 2+ окисляется, восстановитель
Br 20+2e→2 Br — восстанавливается, окислитель
Мg + Н2SO4 = МgSО4 + Н2
Мg + 2Н+ = Мg2+ + Н2
4Al + 3O2 = 2Al2O3,
2Al + 3H2SO4 = Al2(SO4)3 + 3H2
2Al + 3Br2 = 2AlBr3
ЗАДАНИЕ 2
Определите формулы веществ Х1 и Х2 в цепочке превращений:
Са →Х1 →Са(ОН)2 →Х2 →Са(НС03)2.
Напишите уравнения реакций, с помощью которых можно осуществить превращения по данной схеме.
2Ca+O2=2CaO
CaO+H2O=Ca(OH)2
Ca(OH)2 + CO2 = CaCO3 ↓ + H2O
CaCO3 + CO2 + H2O ↔ Ca(HCO3)2
ЗАДАНИЕ 3
При взаимодействии 12 г магния с избытком соляной кислоты выделилось 10 л водорода (н. у.). Вычислите объемную долю выхода продукта реакции (в %).
Mg + 2НСl = MgCl2 + Н2
n (Mg) = 12/24= 0,5 моль
n (H2) = n (Mg) по уравнению (теор.)
n (H2) = 10/22,4 = 0,44 моль (пр.)
ŋ = V (H2) (пр.)/ V (H2) (теор.) = n (H2) (пр.)/ n (H2) (теор.) = 0,44/0,5 = 0,89 = 89%
ЗАДАНИЕ 1
Напишите уравнения возможных реакций меди и магния с веществами: кислородом, иодом, разбавленной серной кислотой.
Рассмотрите две из этих реакций в свете ОВР, а одну — в свете ТЭД.
2Cu + O2 = 2CuO
2Cu + I2 = 2CuI
Cu + H2SO4 = не идет
2 Мg + O2 = 2 МgО
Мg 0 -2e→ Мg 2+ окисляется, восстановитель
О20+4e→2 О 2- восстанавливается, окислитель
Мg + Н2SO4 = МgSО4 + Н2
Мg + 2Н+ = Мg2+ + Н2
Мg + I 2 = Мg I 2
Мg 0 -2e→ Мg 2+ окисляется, восстановитель
I 20+2e→2 I — восстанавливается, окислитель
ЗАДАНИЕ 2
Определите формулы веществ X1 и Х2 в цепочке превращений:
Zn →Х1→ ZnS04 →Х2 →ZnO.
Напишите уравнения реакций, с помощью которых можно осуществить превращения по данной схеме.
2Zn + O2 = 2ZnO
ZnO+H2SO4 —>ZnSO4 + H2O
ZnSO4 + 2NaOH (разб.) = Zn(OH)2↓ + Na2SO4
Zn(OH)2= ZnO + H2O
ЗАДАНИЕ 3
При термическом разложении 10 г карбоната кальция было получено 1,68 л углекислого газа (н. у.). Вычислите объемную долю выхода продукта реакции.
CaCO3 → CaO + CO2
n (CaCO3) = 10/100= 0,1 моль
n (CO2) = n (CaCO3) по уравнению (теор.)
n (CO2) = 1,68/22,4 = 0,075 моль (пр.)
ŋ = V (CO2) (пр.)/ V (CO2) (теор.) = n (CO2) (пр.)/ n (CO2) (теор.) = 0,075/0,1 = 0,75 = 75%
ЗАДАНИЕ 1
Напишите уравнения возможных реакций железа и цинка с веществами: кислородом, хлором, разбавленной серной кислотой.
Рассмотрите две из этих реакций в свете ОВР, а одну — в свете ТЭД.
3Fe + 2O2 = Fe2O3 • FeO
Fe + Н2SO4 = FeSO4 + Н2
2Fe + 3Cl2 = 2FeCl3
2Zn + O2 = 2ZnO
Zn 0 -2e→ Zn 2+ окисляется, восстановитель
О20+4e→2 О 2- восстанавливается, окислитель
Zn + Cl2 = ZnCl2
Zn0 -2e→Zn2+ окисляется, восстановитель
Cl20+2e→2Cl- восстанавливается, окислитель
Zn + H2SO4 = ZnSO4 + H2
Zn + 2Н+ = Zn 2+ + Н2
ЗАДАНИЕ 2
Определите формулы веществ Х1 и Х2 в цепочке превращений:
Fe →Х1 →Fe(OH)2 →Х2 →Fe.
Напишите уравнения реакций, с помощью которых можно осуществить превращения по данной схеме.
Fe — 1 —> FeCl2 — 2 —> Fe (OH)2 — 3 —> FeO -4-> Fe
1. Fe + 2HCl —> FeCl2 + H2
2. FeCl2 + 2NaOH —> Fe(OH)2 + 2NaCl
Fe2+ + 2OH- —> Fe (OH)2
3. Fe (OH)2 — t —> FeO + H2O
4. FeO + C = Fe + CO
ЗАДАНИЕ 3
При взаимодействии 23 г натрия с водой было получено 8,96 л водорода (н. у.). Найдите объемную долю выхода продукта реакции.
2Na + 2H2O = 2NaOH + H2 ↑
n (Na) = 23/23= 1 моль
2n (H2) = n (Na) по уравнению (теор.)
n (H2) = 0,5 моль теор.
n (H2) = 8,96/22,4 = 0,4 моль (пр.)
ŋ = V (H2) (пр.)/ V (H2) (теор.) = n (H2) (пр.)/ n (H2) (теор.) = 0,4/0,5 = 0,8 = 80%
ЗАДАНИЕ 1
Напишите уравнения возможных химических реакций бериллия и железа с веществами: кислородом, бромом, разбавленной серной кислотой.
Рассмотрите две из этих реакций в свете ОВР, а одну — в свете ТЭД.
3Fe + 2O2 = Fe2O3 • FeO
Fe + Н2SO4 = FeSO4 + Н2
2Fe + 3Br 2 = 2Fe Br3
2 Ве + O2 = 2 ВеО
Ве0 -2e→ Ве 2+ окисляется, восстановитель
О20+4e→2 О 2- восстанавливается, окислитель
Ве + Br 2 = Ве Br2
Ве 0 -2e→ Ве 2+ окисляется, восстановитель
Br 20+2e→2 Br — восстанавливается, окислитель
Ве + Н2SO4 = Ве SО4 + Н2
Ве + 2Н+ = Ве 2+ + Н2
ЗАДАНИЕ 2
Определите формулы веществ Х1 и Х2 в цепочке превращений:
Fe → Х1 →Fe(OH)3 →Х2 →Fe.
Напишите уравнения реакций, с помощью которых можно осуществить превращения по данной схеме.
Fe 1→FeCl3 2→Fe(OH)3 3→Fe2O3 4→ Fe
1. 2Fe + 3Cl2 t →2FeCl3
2. FeCl3+ 3NaOH → Fe(OH)3 ↓ + 3NaCl
3. 2Fe(OH)3 t → Fe2O3 + H2O
4. 2Fe2O3 + 3C t → 4 Fe + 3CO2
ЗАДАНИЕ 3
При взаимодействии 60 г кальция с водой выделилось 30 л водорода (н. у.). Найдите объемную долю выхода продукта реакции (в %).
Ca + 2H2О = Ca(OH)2 + Н2
n (Ca) = 60/40= 1,5 моль
n (H2) = n (Ca) по уравнению (теор.)
n (H2) = 30/22,4 = 1,34 моль (пр.)
ŋ = V (H2) (пр.)/ V (H2) (теор.) = n (H2) (пр.)/ n (H2) (теор.) = 1,34/1,5 = 0,89 = 89%
ЗАДАНИЕ 1
Напишите уравнения возможных реакций магния, алюминия и серебра с неметаллом, водой, кислотой, раствором соли.
Реакции металлов с растворами кислоты и соли рассмотрите с точки зрения ОВР и ТЭД.
1. Mg + 2HCl = MgCl2 + H2
Mg + 2H+ = Mg2+ + H2
Mg0 — 2e = Mg2+ восстановитель
2H+ + 2e= H2 окислитель
Mg + Cl2 = MgCl2
Mg+2H2O=Mg(OH)2+H2
Mg + CuCl2 = MgCl2 + Cu
Mg0 + Cu2+ = Mg2+ + Cu0
Mg0 — 2e = Mg2+ восстановитель
Cu2+ + 2e= Cu0 окислитель
2. 2Al + 6HCl = 2AlCl3 + 3H2
2Al + 6H+ = 2Al3+ + 3H02
Al 0 — 3e = Al3+ восстановитель
2H+ + 2e= H2 окислитель
2Al + 3Cl2 = 2AlCl3
2Al + 6H2O = 2Al(OH)3 + 3H2
3HgCI2 + 2Al = 2AICI3 + 3Hg
3Hg2+ + 2Al0 = 2AI3+ + 3Hg0
Hg2+ + 2е = Hg0 восстановитель
Al0 – 3е= AI3+ окислитель
3. Ag + 2HCl = не реагирует
2Ag + S = Ag2S
Ag+ H2O = не реагирует
Ag + FeCl3 = AgCl + FeCl2
Ag0 + Fe3+= Ag++ Fe2+
Ag0 — 1е= Ag+ восстановитель
Fe3++1е= Fe2+окислитель
ЗАДАНИЕ 2
Определите формулы веществ Х1, Х2 и Х3 в цепочке превращений:
Напишите уравнения реакций, с помощью которых можно осуществить превращения по данной схеме.
2Ве + О2 = 2ВеО
ВеО +2HCl = BeCl2 + H2O
BeCl2 + 2NaOH = Be(OH)2 + 2NaCl
Be(OH)2 + 2NaOH= Na2BeO2 + 2H2O
ЗАДАНИЕ 3
При взаимодействии 12 г технического магния, содержащего 5% примесей, с избытком соляной кислоты, выделилось 10 л водорода (н. у.). Вычислите объемную долю выхода продукта реакции.
Mg + 2HCl = MgCl2 + H2
n(Mg) = 12-12*0,05/24 = 11,4 /24= 0,475 моль
n (H2) (теор.) = n(Mg) =0,475 моль
n (H2) = 10/22,4 = 0,44 моль (пр.)
ŋ = V (H2) (пр.)/ V (H2) (теор.) = n (H2) (пр.)/ n (H2) (теор.) = 0,44/0,475 = 0,92 = 92%
ЗАДАНИЕ 1
Напишите уравнения возможных реакций лития, меди, бария, алюминия с веществами: неметаллом, водой, кислотой, раствором соли.
Реакции металлов с растворами кислоты и соли рассмотрите с точки зрения ОВР и ТЭД.
1. 2Li + Сl2 = 2LiСl
2Li + 2H2O = 2LiOH + H2
2Li + 2НСl = 2LiСl + Н2
2Li0 + 2Н+ = 2Li+ + Н02
Li0 – 1e = Li+ восстановитель
2Н+ + 2e= Н02 окислитель
2Li + CuСl 2= 2LiС1 + Cu
2Li0 + Cu2+ = 2Li+ + Cu0
Li0 – 1e = Li+ восстановитель
Cu2+ + 2e= Cu0 окислитель
2. 2Al + 6HCl = 2AlCl3 + 3H2
2Al + 6H+ = 2Al3+ + 3H02
Al 0 — 3e = Al3+ восстановитель
2H+ + 2e= H2 окислитель
2Al + 3Cl2 = 2AlCl3
2Al + 6H2O = 2Al(OH)3 + 3H2
3HgCI2 + 2Al = 2AICI3 + 3Hg
3Hg2+ + 2Al0 = 2AI3+ + 3Hg0
Hg2+ + 2е = Hg0 восстановитель
Al0 – 3е= AI3+ окислитель
3. Ва + 2HCl = ВаCl2 + H2
Ва + 2H+ = Ва 2+ + H2
Ва 0 — 2e = Ва 2+ восстановитель
2H+ + 2e= H2 окислитель
Ва + Cl2 = ВаCl2
Ва +2H2O= Ва(OH)2+H2
Ва + CuCl2 = ВаCl2 + Cu
Ва + Cu2+ = Ва 2+ + Cu0
Ва 0 — 2e = Ва 2+ восстановитель
Cu2+ + 2e= Cu0 окислитель
4. Cu + Cl2 = CuCl2
Cu + H2O = не реагирует
Cu + HCl = не реагирует
Cu + 2FeCl3 = CuCl2 + 2FeCl2.
Cu 0 + Fe3+= Cu2 ++ Fe2+
Cu 0 — 2е= Cu + восстановитель
Fe3++1е= Fe2+окислитель
ЗАДАНИЕ 2
Определите формулы веществ Х1, Х2 и Х3 в цепочке превращений:
Напишите уравнения реакций, с помощью которых можно осуществить превращения по данной схеме.
Fe + 2HСl → FeCl2 + H2↑
FeCl2+ 2NaOH → Fe(OH)2 + 2NaCl
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3↓
2Fe(OH)3 = Fe2O3 + 3H2O
ЗАДАНИЕ 3
При термическом разложении 20 г известняка, содержащего 10% некарбонатных примесей, было получено 3,23 л углекислого газа (н. у.).
Вычислите объемную долю выхода продукта реакции (в %).
CaCO3 = CaO+CO2
n (CaCO3) = 20-20*0,1/100= 18/100=0,18 моль
V (CO2) = 3,23/22,4 = 0,145 моль (практ.)
n (CaCO3) = n (CO2) по уравнению (теор.)= 0,18 моль
выход = 0,145/0,18 = 0,801 = 80,1 %
ЗАДАНИЕ 1
Напишите уравнения возможных реакций кальция, железа и цинка с неметаллом, водой, кислотой, раствором соли.
Реакции металлов с растворами кислоты и соли рассмотрите с точки зрения ОВР и ТЭД.
1. Са + 2HCl = СаCl2 + H2
Са0 + 2H+ = Са 2+ + H2
Са 0 — 2e = Са 2+ восстановитель
2H+ + 2e= H2 окислитель
Са + Cl2 = СаCl2
Са +2H2O= Са(OH)2+H2
Са + CuCl2 = СаCl2 + Cu
Са + Cu2+ = Са 2+ + Cu0
Са 0 — 2e = Са 2+ восстановитель
Cu2+ + 2e= Cu0 окислитель
2.
2Fe + 3Cl2 t →2FeCl3
3. 2Zn + O2 = 2ZnO
Zn + H2O = ZnO + H2
Zn + H2SO4 = ZnSO4 + H2
Zn + 2Н+ = Zn 2+ + Н2
Zn 0 + 2H+ = Zn 2+ + H02
Zn 0 — 2e = Zn 2+ восстановитель
2H+ + 2e= H2 окислитель
Zn + CuSO4 = Cu + ZnSO4
Zn 0 + Cu2+ = Zn 2+ + Cu0
Zn 0 — 2e = Zn 2+ восстановитель
Cu2+ + 2e= Cu0 окислитель
ЗАДАНИЕ 2
Определите формулы веществ Х1, Х2 и Х3 в цепочке превращений:
Напишите уравнения реакций, с помощью которых можно осуществить превращения по данной схеме.
2Ca+O2=2CaO
CaО+H2O=Ca(OH)2
Ca(OH)2+H2CO3=CaCO3+2H2O
CaCO3 + CO2 + H2O ↔ Ca(HCO3)2
Ca(HCO3)2 t →CaCO3↓ + CO2 + H2O
ЗАДАНИЕ 3
Прй взаимодействии 24,15 г технического натрия, содержащего 5% примесей, было получено 8,96 л водорода (н. у.).
Вычислите объемную долю выхода продукта реакции (в %).
2Na + 2H2O = 2NaOH + H2
n(Na) = 24,15-24,15*0,05/23 =23 /23= 1 моль
n (H2) (теор.) = 0,5 n(Mg) =0,5 моль
n (H2) = 8,96/22,4 = 0,4 моль (пр.)
ŋ = V (H2) (пр.)/ V (H2) (теор.) = n (H2) (пр.)/ n (H2) (теор.) = 0,4/0,5 = 0,8 = 80%
ЗАДАНИЕ 1
Напишите уравнения возможных реакций бериллия, железа и меди с веществами: неметаллом, водой, кислотой, раствором соли.
Реакции металлов с растворами кислоты и соли рассмотрите с точки зрения ОВР и ТЭД.
1. 2 Ве + O2 = 2 ВеО
Ве + Н2SO4 = ВеSО4 + Н2
Ве + 2Н+ = Ве 2+ + Н2
2. Cu + Cl2 = CuCl2
Cu + H2O = не реагирует
Cu + HCl = не реагирует
Cu + 2FeCl3 = CuCl2 + 2FeCl2.
Cu 0 + Fe3+= Cu2 ++ Fe2+
Cu 0 — 2е= Cu + восстановитель
Fe3++1е= Fe2+окислитель
3. 2Fe + 3Cl2 t →2FeCl3
ЗАДАНИЕ 2
Определите формулы веществ Х1, Х2 и Х3 в цепочке превращений:
Напишите уравнения реакций, с помощью которых можно осуществить превращения по данной схеме.
2Zn + O2 = 2ZnO
ZnO + 2HNO3 = Zn(NO3)2 + H2O
Zn(NO3)2 + 2NaOH = 2NaNO3 + Zn(OH)2
Zn(OH)2= ZnO + H2O
ЗАДАНИЕ 3
При взаимодействии 60 г технического кальция, содержащего 2% примесей, с водой было получено 30 л водорода (н. у.). Вычислите объемную долю выхода продукта реакции.
Ca + 2H2О = Ca(OH)2 + Н2
n(Ca) = 60-60*0,02/40 =58,8 /40= 1,47 моль
n (H2) (теор.) = n(Ca) =1,47 моль
n (H2) = 30/22,4 = 1.34 моль (пр.)
ŋ = V (H2) (пр.)/ V (H2) (теор.) = n (H2) (пр.)/ n (H2) (теор.) = 1,34/1,47 = 0,91 = 91%
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Решить цепочку CO2 + H2O — — — (фотосинтез)Х1 — — — (брожение)Х2 — — — — ( + О2, ферменты) — — — Х3( + Сl2) — — — Х4 ?
Химия | 10 — 11 классы
Решить цепочку CO2 + H2O — — — (фотосинтез)Х1 — — — (брожение)Х2 — — — — ( + О2, ферменты) — — — Х3( + Сl2) — — — Х4 .
Даны : глицерин, сахароза, этанол, глюкоза, этиленгликоль Какое из этих соединений при нагревании с гидроксидом меди(2) образует осадок красного цвета?
Какие из этих соединений при обычной температуре растворяют Cu(OH)2 с образованием cине — фиолетового раствора?
6CO2 + 6H2O = C6H12O6 (X1) + 6O2
C6H12O6 = 2C2H5OH (X2) + 2CO2
C2H5OH + O2 = фермент = CH3COH (X3) + 2H2O
CH3COH + Cl2 = ClCH2COH (X4) + HCl
Глицерин, сахароза, глюкоза, этиленгликоль как многоатомные спиртыпри обычной температуре растворяют Cu(OH)2 с образованием cине — фиолетового раствора.
Глюкозапри нагревании с гидроксидом меди(2) образует осадок красного цвета из — за альдегидной группы.
Видео:Как решать ОРГАНИЧЕСКИЕ ЦЕПОЧКИ? Основные типы химических реакцийСкачать

Даны три простых вещества — А, В, С?
Даны три простых вещества — А, В, С.
Соединение С и В хорошо растворяется в воде и окрашивает лакмус в красный цвет.
Соединение А с В образует твердое бесцветное кристаллическое вещество.
Если на это вещество подействовать серной кислотой, то выделяется соединение В с С.
Назовите эти вещества, напишите уравнение соответствующих реакций.
Видео:ОГЭ. Задание 21. Цепочка превращений.Скачать
Даны три простых вещества — А, В, С?
Даны три простых вещества — А, В, С.
Соединение С и В хорошо растворяется в воде и окрашивает лакмус в красный цвет.
Соединение А с В образует твердое бесцветное кристаллическое вещество.
Если на это вещество подействовать серной кислотой, то выделяется соединение В с С.
Назовите эти вещества, напишите уравнение соответствующих реакций.
Видео:8 КЛАСС | Как решать ЦЕПОЧКИ ХИМИЧЕСКИХ РЕАКЦИЙ | Цепочки превращенийСкачать

Напишите структурную формулу вещества С3Н6О2, если известно, что его водный раствор изменяет окраску метилового оранжевого в красный цвет, с хлором это вещество образует соединение С3Н5ClО2, а при наг?
Напишите структурную формулу вещества С3Н6О2, если известно, что его водный раствор изменяет окраску метилового оранжевого в красный цвет, с хлором это вещество образует соединение С3Н5ClО2, а при нагревании его натриевой соли с гидроксидом натрия образуется этан.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Какие группы веществ дают реакцию серебряного зеркала?
Какие группы веществ дают реакцию серебряного зеркала?
1)глюкоза, глицерин, этиленгликоль.
2)глицерин, глюкоза, сахароза.
3)глюкоза, формальдегид, метановая кислота.
4)глюкоза, молочная кислота, этиленгликоль?
Напишите уравнения реакций.
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Помогите сделать цепочку превращений?
Помогите сделать цепочку превращений.
Этанол — этен — этиленгликоль.
Видео:Как составлять ХИМИЧЕСКИЕ УРАВНЕНИЯ | 4 лайфхака - 95 ВСЕХ РЕАКЦИЙ в химии!Скачать

Какое соединение образуется при взаимодействии оксида алюминия с раствором гидроксида калия?
Какое соединение образуется при взаимодействии оксида алюминия с раствором гидроксида калия?
Видео:8 класс. Цепочки превращений. Генетические ряды.Скачать

Напишите структурные формулы этанола, этиленгликоля и фенола?
Напишите структурные формулы этанола, этиленгликоля и фенола.
Как изменяется кислотность этих соединений.
Видео:1.4. Алканы: Решение цепочек. ЕГЭ по химииСкачать

Какие группы веществ дают реакцию серебрянного зеркала?
Какие группы веществ дают реакцию серебрянного зеркала?
1)глюкоза, глицерин, этиленгликоль 2)глицерин, глюкоза, сахароза 3)глюкоза, формальдегид, метановая кислота 4)глюкоза, молочная кислота, этиленгликоль.
Напишите уравнения реакций.
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

О наличии каких функциональных групп свидетельствует образование красного осадка при нагревании глюкозы с гидроксидом меди 2 ?
О наличии каких функциональных групп свидетельствует образование красного осадка при нагревании глюкозы с гидроксидом меди 2 ?
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

При электролизе водного раствора нитрата меди(2) на катоде выделился металл?
При электролизе водного раствора нитрата меди(2) на катоде выделился металл.
Металл нагрели с оксидом меди(2), при этом образовалось соединение красного цвета.
Это соединение обработали необходимым кол — вом конц.
Серной кислоты при нагревании иинаблюдали выделение гажа с резким запахом.
При добавлении к получившемуся раствору сульфида натрия образовался черный осадок.
Напишите уравнения четырех описанных реакций.
На этой странице находится вопрос Решить цепочку CO2 + H2O — — — (фотосинтез)Х1 — — — (брожение)Х2 — — — — ( + О2, ферменты) — — — Х3( + Сl2) — — — Х4 ?, относящийся к категории Химия. По уровню сложности данный вопрос соответствует знаниям учащихся 10 — 11 классов. Здесь вы найдете правильный ответ, сможете обсудить и сверить свой вариант ответа с мнениями пользователями сайта. С помощью автоматического поиска на этой же странице можно найти похожие вопросы и ответы на них в категории Химия. Если ответы вызывают сомнение, сформулируйте вопрос иначе. Для этого нажмите кнопку вверху.
Видео:ВАЛЕНТНОСТЬ. Графические формулы веществ | Химия | TutorOnlineСкачать

Дана цепочка превращений определите формулы веществ 1 4 и напишите уравнения реакций
FOR-DLE.ru — Всё для твоего DLE 😉
Привет, я Стас ! Я занимаюсь так называемой «вёрсткой» шаблонов под DataLife Engine.
На своем сайте я выкладываю уникальные, адаптивные, и качественные шаблоны. Все шаблоны проверяются на всех самых популярных браузерх.
Раньше я занимался простой вёрсткой одностраничных, новостных и т.п. шаблонов на HTML, Bootstrap. Однажды увидев сайты на DLE решил склеить пару шаблонов и выложить их в интернет. В итоге эта парочка шаблонов набрала неплохую популярность и хорошие отзывы, и я решил создать отдельный проект.
Кроме шаблонов я так же буду выкладывать полезную информацию для DataLife Engin и «статейки» для веб мастеров. Так же данный проект будет очень полезен для новичков и для тех, кто хочет правильно содержать свой сайт на DataLife Engine. Надеюсь моя работа вам понравится и вы поддержите этот проект. Как легко и удобно следить за обновлениями на сайте?
Достаточно просто зарегистрироваться на сайте, и уведомления о каждой новой публикации будут приходить на вашу электронную почту!
Задание 1
Какие углеводороды называют алкинами? Алкинами называют углеводороды с общей формулой CnH2n-2, в молекулах которых содержится одна тройная углерод-углеродная связь С≡С.
Приведите названия, молекулярные и структурные формулы первых четырёх представителей гомологического ряда алкинов.
| Название | Молекулярная формула | Структурная формула |
| этин | C2H 2 | HC≡CH |
| пропин | C3H 4 | HC≡C ― CH 3 |
| бутин-1 | C4H 6 | HC≡C ― CH2 ― CH 3 |
| пентин-1 | C5H 8 | H3C ― C≡C ― CH2 ― CH 3 |
Задание 2
Сравните общие формулы диеновых и ацетиленовых углеводородов. Общие формулы CnH2n-2 одинаковые.
Можно ли однозначно сказать, к какому классу углеводородов принадлежит вещество с формулой C4H6? Нельзя, т.к. молекулярная формула не отражает пространственное строение молекулы. Например, формуле C4H6 могут соответствовать алкин и алкадиен.
Напишите структурные формулы одного алкадиена и одного алкина, имеющих такой состав, и назовите их.
| Структурная формула алкадиена C4H6: | Структурная формула алкина C4H6: |
| CH2=CH―CH=CH2 бутадиен-1,3 | H3C ― C≡C ― CH 3 бутин-2 |
Какой вид изомерии характерен для этих соединений? Для алкадиенов и алкинов характерны следующие виды изомерии:
― углеродного скелета;
― положение связи (двойной или тройной) ;
― межклассовая изомерия; цис-транс-изомерия.
Задание 3
Назовите по международной номенклатуре следующие углеводороды:
а) 4-метилпентин-2 (опечатка в задании)
б) пентин-1
в) 3,3-диметилбутин-1
Задание 4
Напишите структурные формулы следующих алкинов:
а) бутин-1;
HC≡C ― CH2 ― CH 3
б) пентин-2;
CH3 ― C≡C ― CH2 ― CH 3
в) 4,4-диметилпентин-2;
г) 2,2,5-триметилгексин-3.
Завдання 5
Сравните химические свойства этилена и ацетилена. Какие общие черты и различия вы можете отметить? Ответ проиллюстрируйте уравнениями химических реакций.
Этилен и ацетилен сгорают в кислороде:
CH2=CH2 + 3O2 ⟶ 2CO2 + 2H2O
2HC≡CH + 5O2 ⟶ 4CO2 + 2H2O
В реакции гидратации этилена образуется спирт, а ацетилена – альдегид:
CH2=CH2 + H2O кат. ⟶ CH3 ― CH2 ― OH
HC≡CH + H2O кат. ⟶ CH3 ― CHO
Этилен и ацетилен вступают в реакцию гидрогалогенирования, при этом с ацетиленом она протекает в две стадии:
CH2=CH2 + HBr ⟶ CH3 ― CH2Br
HC≡CH + HBr ⟶ CH2=CHBr
CH2=CHBr + HBr ⟶ CH3 ― CHBr2
Этилен и ацетилен вступают в реакцию галогенирования, при этом с ацетиленом она протекает в две стадии:
CH2=CH2 + Br2 ⟶ CH2Br ― CH2Br
Задание 7
На технический карбид кальция массой 40 г подействовали избытком воды. При этом образовалось 11,2 л газа (н.у.). Определите массовую долю примесей в карбиде кальция.
Дано: m(CaC2 c прим.)=40 г, V(C2H2)=11,2 л
Найти: ω(примеси)-?
Решение
1-й способ
1. Количество вещества этина рассчитываем по формуле: ʋ=V/Vm, где Vm― молярный объём.
ʋ(C2H2)=V( C2H2 )/Vm=11,2 л : 22,4 л/моль=0,5 моль
2. Составляем химическое уравнение: CaC2 + 2H2O ⟶ C2H2↑ + Ca(OH)2
По уравнению реакции ʋ(CaC2): ʋ(C2H2)=1:1 , количества вещества одинаковые, поэтому :
ʋ(CaC2)=ʋ( C2H2 )=0,5 моль
3. Массу технического карбита кальция рассчитываем по формуле: m=ʋ•M, где M ― молярная масса.
M(CaC2)=64 г/моль
m( CaC2 )= ʋ(CaC2) • M( CaC2 )=0,5 моль • 64 г/моль=32 г
4. Рассчитываем массу примесей в техническом карбиде кальция.
m(примесей)=m(CaC2 c прим.)-m(CaC2)=40 г — 32 г=8 г
5. Рассчитываем массовую долю примесей в техническом карбиде кальция:
ω(примеси)=(m(примеси)/ m(CaC2 c прим.)) • 100% =8 г : 40 г • 100%=20%
2-й способ
1. Составляем химическое уравнение:
х г 11,2 л
CaC2 + 2H2O ⟶ C2H2↑ + Ca(OH)2
64 г 22,4 л
Над формулами соединений CaC2 и C2H2 записываем неизвестную массу технического карбида кальция (х г) и приведенный в условии задачи объём этина (11,2 л), а под формулами соединений ― массу и объём количества вещества согласно коэффициентам в химическом уравнении. При н.у. 1 моль любого газа занимает объём 22,4 л.
M(CaC2)=64 г/моль, поэтому масса 1 моль=64 г
х= m( CaC2)=64 г • 11,2 л : 22,4 л=32 г
2. Рассчитываем массовую долю технического карбида кальция:
ω( CaC2 )=(m( CaC2 )/ m(CaC2 c прим.)) • 100% =32 г : 40 г • 100%=80%
3. Рассчитываем массовую долю примесей в техническом карбиде кальция.
ω (примеси)= ω (CaC2 c прим.)- ω (CaC2)=100% — 80%=20%
Ответ: ω(примеси)=20%
Задание 8
Термохимическое уравнение реакции горения ацетилена имеет вид 2C2H2 + 5O2 ⟶ 4CO2 + 2H2O + 2600 кДж Рассчитайте количество теплоты, которое выделится при сгорании 44,8 л ацетилена (н.у.).
По термохимическому уравнению реакции с 44,8 л (2 моль) С2H2 выделяется 2600 кДж теплоты,
по условию задачи с 44,8 л С2H2 ― х кДж теплоты.
х = 22,4 л ● 2600 кДж : 22,4 л=2600 кДж
Ответ: 2600 кДж
🎬 Видео
Проклятая химическая реакция 😜 #shortsСкачать

8 класс. Составление уравнений химических реакций.Скачать

Задание 21 – решаем на максимум | Химия ОГЭ 2023Скачать

Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

Составление формул органических соединений по названиюСкачать