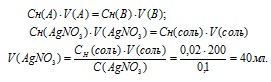CrCl3 — соль образованная слабым основанием и сильной кислотой, поэтому реакция гидролиза протекает по катиону.
- Первая стадия (ступень) гидролиза
- Вторая стадия (ступень) гидролиза
- Третья стадия (ступень) гидролиза
- Среда и pH раствора хлорида хрома (III)
- Вычисления при обменных реакциях комплексных соединений. Заряды комплексных ионов
- Соли хрома: химические свойства и получение
- Соли хрома
- Соли хрома (II)
- Соли хрома (III)
- Гидролиз солей хрома (III)
- Хромиты
- Соли хрома (VI)
- 🎥 Видео
Видео:Реакции ионного обмена. Все типы №14Скачать

Первая стадия (ступень) гидролиза
Молекулярное уравнение
CrCl3 + HOH ⇄ CrOHCl2 + HCl
Полное ионное уравнение
Cr 3+ + 3Cl — + HOH ⇄ CrOH 2+ + 2Cl — + H + + Cl —
Сокращенное (краткое) ионное уравнение
Cr 3+ + HOH ⇄ CrOH 2+ + H +
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Вторая стадия (ступень) гидролиза
Молекулярное уравнение
CrOHCl2 + HOH ⇄ Cr(OH)2Cl + HCl
Полное ионное уравнение
CrOH 2+ + 2Cl — + HOH ⇄ Cr(OH)2 + + Cl — + H + + Cl —
Сокращенное (краткое) ионное уравнение
CrOH 2+ + HOH ⇄ Cr(OH)2 + + H +
Видео:9 класс. Реакции ионного обмена. Ионные уравнения.Скачать

Третья стадия (ступень) гидролиза
Молекулярное уравнение
Cr(OH)2Cl + HOH ⇄ Cr(OH)3 + HCl
Полное ионное уравнение
Cr(OH)2 + + Cl — + HOH ⇄ Cr(OH)3 + H + + Cl —
Сокращенное (краткое) ионное уравнение
Cr(OH)2 + + HOH ⇄ Cr(OH)3 + H +
Видео:Реакции ионного обмена за 45 минут | Химия ЕГЭ 10 класс | УмскулСкачать

Среда и pH раствора хлорида хрома (III)
В результате гидролиза образовались ионы водорода (H + ), поэтому раствор имеет кислую среду (pH
Видео:75. Ионные реакции в растворах электролитовСкачать

Вычисления при обменных реакциях комплексных соединений. Заряды комплексных ионов
Задача 719.
Эмпирическая формула соли CrCl3 . 5H2O. Исходя из того, что координационное число хрома равно б, вычислить, какой объем 0,1 н. раствора AgNO3 понадобится для осаждения внешнесферно связанного хлора, содержащегося в 200 мл 0,01 М раствора комплексной соли; считать, что вся вода, входящая в состав соли, связана внутрисферно.
Решение:
Так как пять молекул воды, входящие в состав соли, связаны внутрисферно, и координационное число центрального атома хрома равно 6, то координационная формула соли будет иметь вид: [Cr(H2O)5Cl]Cl2. Во внешней сфере соли будет находиться два хлорид-иона, т.е. СЭ(Cl) = 2CM = 0,01 . 2 = 0,02н.
Для расчета объёма раствора AgNO3 используем математическое выражение следствия из закона эквивалентов (так называемое правило пропорциональности):
CH(A) . V(A) = CH(B) . V(B)
где Сн(A) и Cн(В) – молярные концентрации эквивалентов веществ А и В, моль; V(A) и V(B) – объёмы растворов веществ А и В.
Подставив данные задачи, вычислим объём раствора нитрата серебра, получим:
Ответ: 40 мл.
Задача 720.
Написать в молекулярной и ионно-молекулярной форме уравнения обменных реакций, происходящих между:
а) K4[Fe(CN)6] и CuSO4; б) Na3[Co(CN)6] и FeSO4; в) K3[Fe(CN)6] и AgNO3, имея в виду, что образующиеся комплексные соли нерастворимы в воде.
Решение:
а) Молекулярная форма:
После приведения членов в обеих частях равенства, получим:
После приведения членов в обеих частях равенства, получим:
3K + + [Fe(CN)6] 3- + 3Ag + + 3NO3 — = Ag3[Fe(CN)6]↓ + 3K+ + 3NO3-
После приведения членов в обеих частях равенства, получим:
Задача 721.
Найти заряды комплексных частиц и указать среди них катионы, анионы и неэлектролиты: а) [Co(NH3)5Cl];
б) [Cr(NH3)4PO4]; в) [Ag(NH3)2]; г) [Cr(OH)6]; д) [Co(NH3)3(NO2)3]; е) [Cu(H2O)4].
Решение:
а) [Co(NH3)5Cl]. Заряды нона кобальта (III) +3, хрома (III), меди (II) и серебра принимаем равными соответственно +3, +3, +2, и +1; заряд молекулы аммиака и молекулы воды равен нулю, заряды хлорид-, нитрит-, гидроксид- и фосфат-ионов соответственно равны -1, -1, -1 и -3.
Составляем алгебраические суммы зарядов для каждого из указанных соединений, получим:
а) +3 + (-1) = +2 (катион); б) +3 + (-3) = 0 (неэлектролит); в) +1 = +1 (катион); г) +3+ 6(-1) = -3 (анион); +3 + 3(-1) = 0 (неэлектролит); е) +2 = +2 (катион).
Задача 722.
Определить степень окисленности комплексообразователя в следующих комплексных ионах: а) [Fe(CN)6] 4- , б) [Ni(NH3)5Cl] + , в) [Co(NH3)2(NO2)4] — , г) [Co(H2O)4Br2] + , д) [AuCl4] — , е) [Hg(CN)4] 2- , ж) [Cd(CN)4] 2- .
Решение:
а) Определение степени окисленности комплексообразователя в [Fe(CN)6] 4– .
Определяем степень окисленности железа, учитывая, что сумма зарядов частиц равна -4. Заряд CN равен -1. Тогда получим: х + 6(-1) = -4; х = -4 + 6; х = +2.
б) Определение степени окисленности комплексообразователя в [Ni(NH 3 ) 5 Cl] +
Определяем степень окисленности никеля, учитывая, что сумма зарядов частиц равна +1. Заряд NH3 равен 0, а Cl равен -1.
Тогда получим: х + 5(0) + (-1) = +1; х = +1 + 1; х = +2.
в) Определение степени окисленности комплексообразователя в [Co(NH 3 ) 2 (NO 2 ) 4 ] —
Заряд Со равен (х), NH3 – (0), NO2 – (-1). Отсюда, учитывая, что сумма зарядов частиц равна (-1), найдём заряд кобальта: х + 4(-1) + 2(0) = -1; х = +3. Степень окисленности равна +3.
г) Определение степени окисленности комплексообразователя в [Co(H 2 O) 4 Br 2 ] +
Заряд Сr равен (х), H2O – (0), Br – (-1). Отсюда, учитывая, что сумма зарядов частиц равна (+1), найдём заряд хрома: х + 4(0) + 2(-1) = +1; х = +3. Степень окисленности равна +3.
д) Определение степени окисленности комплексообразователя в [AuCl 4 ] — . Заряд Au равен (х), Cl — (-1). Отсюда, учитывая, что сумма зарядов частиц равна (-1), найдём заряд золота: х + 4(-1) = -1; х = +3. Степень окисленности равна +3.
е) Определение степени окисленности комплексообразователя в [Hg(CN) 4 ] 2-
Заряд Hg равен (х), CN — (-1). Отсюда, учитывая, что сумма зарядов частиц равна (-1), найдём заряд ртути: х + 4(-1) = -2; х = +2. Степень окисленности ртути равна +2.
ж)Определение степени окисленности комплексообразователя в [Cd(CN) 4 ] 2-
Заряд Сd равен (х), CN — (-1). Отсюда, учитывая, что сумма зарядов частиц равна (-1), найдём заряд кадмия: х + 4(-1) = -2; х = +2. Степень окисленности кадмия равна +2.
Видео:Составление ур-й окислительно-восст. реакций методом ионно-электронного баланса. 1ч. 10 класс.Скачать

Соли хрома: химические свойства и получение
Соли хрома
Соли хрома (II)
Все соли хрома (II) – сильные восстановители. В растворах окисляются даже кислородом воздуха.
Например , хлорид хрома (II) окисляется кислородом в растворе в присутствии щелочи до соединений хрома (III):
Концентрированные кислоты-окислители (азотная и серная) также окисляют соединения хрома (II):
Соли хрома (III)
Хром с валентностью III образует два типа солей:
- Соли, в которых хром (III) является катионом. Например , хлорид хрома (III) CrCl3.
- Соли, в которых хром (III) входит в состав кислотного остатка – хромиты и гидроксокомплексы хрома (III) . Например , хромит калия, KCrO2. или гексагидроксохромат (III) калия K3[Cr(OH)6].
1. Соли хрома (III) проявляют слабые восстановительные свойства . окисляются под действием сильных окислителей в щелочной среде.
Например , бром в присутствии гидроксида калия окисляет хлорид хрома (III):
2CrCl3 + 3Br2 + 16KOH → 2K2CrO4 + 6KBr + 6KCl + 8H2O
или сульфат хрома (III):
Пероксид водорода в присутствии щелочи также окисляет соли хрома (III):
Даже перманганат калия в щелочной среде окисляет соли хрома (III):
Комплексные соли хрома (III) также окисляются сильными окислителями в присутствии щелочей.
Например , гексагидроксохроматы окисляются бромом в щелочи:
Оксид свинца (IV) также окисляет хромиты:
2. Соли хрома (III) в щелочной среде образуют гидроксид хрома (III), который сразу растворяется, образуя гидроксокомплекс.
2CrCl3 + 6KOH → 2Cr(OH)3 + 6KCl
3. Более активные металлы вытесняют хром (III) из солей.
Например , цинк реагирует с хлоридом хрома (III):
Гидролиз солей хрома (III)
Растворимые соли хрома (III) и сильных кислот гидролизуются по катиону. Гидролиз протекает ступенчато и обратимо, т.е. чуть-чуть:
I ступень: Cr 3+ + H2O = CrOH 2+ + H +
II ступень: CrOH 2+ + H2O = Cr(OH )2 + + H +
Однако сульфиды, сульфиты, карбонаты хрома (III) и их кислые соли гидролизуются необратимо, полностью, т.е. в водном растворе не существуют, а разлагаются водой в момент образования.
Например , при сливании растворов солей хрома (III) и сульфита, гидросульфита, карбоната или сульфида натрия протекает взаимный гидролиз:
Более подробно про гидролиз можно прочитать в соответствующей статье.
Хромиты
Соли, в которых хром (III) входит в состав кислотного остатка (хромиты) — образуются из оксида хрома (III) при сплавлении с щелочами и основными оксидами:
Для понимания свойств хромитов их удобно мысленно разделить на два отдельных вещества.
Например , хромит натрия мы поделим мысленно на два вещества: оксид хрома (III) и оксид натрия.
NaСrO2 разделяем на Na2O и Cr2O3
При этом очевидно, что хромиты реагируют с кислотами. При недостатке кислоты образуется гидроксид хрома (III):
NaCrO2 + HCl (недостаток) + H2O → Cr(OH)3 + NaCl
В избытке кислоты гидроксид хрома (III) не образуется:
NaCrO2 + 4HCl (избыток) → CrCl3 + NaCl + 2H2O
NaCrO2 + 4HCl → CrCl3 + NaCl + 2H2O
Под действием избытка воды хромиты гидролизуются:
Соли хрома (VI)
Оксиду хрома ( VI ) соответствуют две кислоты – хромовая Н2 CrO 4 и дихромовая Н2 Cr 2 O 7. Поэтому хром в степени окисления +6 образует два типа солей: хроматы и дихроматы.
Например , хромат калия K2CrO4 и дихромат калия K2Cr2O7.
1. Различить эти соли довольно легко: хроматы желтые, а дихроматы оранжевые. Хроматы устойчивы в щелочной среде, а дихроматы устойчивы в кислой среде.
При добавлении к хроматам кислот они переходят в дихроматы.
Например , хромат калия взаимодействует с серной кислотой и разбавленной соляной кислотой с образованием дихромата калия:
И наоборот: дихроматы реагируют с щелочами с образованием хроматов.
Например , дихромат калия взаимодействует с гидроксидом калия с образованием хромата калия:
Видеоопыт взаимных переходов хроматов и дихроматов при добавлении кислоты или щелочи можно посмотреть здесь.
2. Хроматы и дихроматы проявляют сильные окислительные свойства. При взаимодействии с восстановителями они восстанавливаются до соединений хрома (III).
В нейтральной среде хроматы и дихроматы восстанавливаются до гидроксида хрома (III).
Например , дихромат калия реагирует с сульфитом натрия в нейтральной среде:
Хромат калия окисляет сульфид аммония:
При взаимодействии с восстановителями в щелочной среде хроматы и дихроматы образуют комплексные соли.
Например , хромат калия окисляет гидросульфид аммония в щелочной среде:
Хромат натрия окисляет сернистый газ:
Хромат натрия окисляет сульфид натрия:
При взаимодействии с восстановителями в кислой среде хроматы и дихроматы образуют соли хрома (III).
Например , дихромат калия окисляет сероводород в присутствии серной кислоты:
Дихромат калия окисляет йодид калия, фосфид кальция, соединения железа (II), сернистый газ, концентрированную соляную кислоту:
🎥 Видео
Реакции ионного обмена: от простых реакций до самых жёстких заданий на ЕГЭ! | Химия ЕГЭ | УмскулСкачать

Химия 9 класс — Как определять Степень Окисления?Скачать

Ионные уравнения (реакции в растворах электролитов)Скачать

NH3 + HCl = NH4Cl | Получение хлорида аммонияСкачать

CrCl3+Na2S.aviСкачать

Реакции ионного обмена, задание №30 ЕГЭ | Екатерина Дацук | ХИМИЯ ЕГЭСкачать

Химия ЕГЭ Полное и сокращенное ионное уравнение реакцийСкачать

Cr(OH)3+HNO3=Cr(NO3)3+H2O Ионное и молекулярное уравнения реакции, демонстрация.Скачать

Количественный химический анализ вод (нефтепродукты) ПНД Ф 14.1:2:4. 128-98.Скачать

Хлорид Аммония. Аммиак. МНОГО ДЫМА БЕЗ ОГНЯ!Скачать

Определение хлорид-ионовСкачать

Лекция 3 Электролиты рН и рОНСкачать
Восстановление оксида меди аммиаком / Reduction of copper oxide by amoniaСкачать

Получение аммиака в лабораторных условиях. Растворимость в воде. Индикаторы.Скачать