Cr2(SO4)3 — соль образованная слабым основанием и сильной кислотой, поэтому реакция гидролиза протекает по катиону.
Видео:Реакции ионного обменаСкачать

Первая стадия (ступень) гидролиза
Полное ионное уравнение
2Cr 3+ + 3SO4 2- + 2HOH ⇄ 2CrOH 2+ + 2SO4 2- + 2H + + SO4 2-
Сокращенное (краткое) ионное уравнение
Cr 3+ + HOH ⇄ CrOH 2+ + H +
Видео:Cr(OH)3+HNO3=Cr(NO3)3+H2O Ионное и молекулярное уравнения реакции, демонстрация.Скачать

Вторая стадия (ступень) гидролиза
Полное ионное уравнение
2CrOH 2+ + 2SO4 2- + 2HOH ⇄ 2Cr(OH)2 + + SO4 2- + 2H + + SO4 2-
Сокращенное (краткое) ионное уравнение
CrOH 2+ + HOH ⇄ Cr(OH)2 + + H +
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Третья стадия (ступень) гидролиза
Полное ионное уравнение
2Cr(OH)2 + + SO4 2- + 2HOH ⇄ 2Cr(OH)3 + 2H + + SO4 2-
Сокращенное (краткое) ионное уравнение
Cr(OH)2 + + HOH ⇄ Cr(OH)3 + H +
Видео:How to write the Equation for Cr(OH)3 + H2OСкачать

Среда и pH раствора сульфата хрома (III)
В результате гидролиза образовались ионы водорода (H + ), поэтому раствор имеет кислую среду (pH
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Опыт 37 — Опыт 45
Опыт 37
Совместный гидролиз сульфата хрома (III)
и карбоната натрия.
Результат:
1) Ионные уравнения реакций:
а) 2Cr 3+ + 3SO − 2 4+ 6Na + + 3CO 2− 3 = 2Cr +3 + 3CO 2− 3 + 6Na + + 3SO − 2 4
б) Cr2(CO3)3 + 3H2O = 2Cr(OH)3↓ + 3CO2↓
в) Cr2(SO4)3 + 3Na2CO3 + 3H2O = 2Cr(OH)3↓ + 3CO2↑ + 3Na2SO4.
Вывод:
Гидроксид хрома (III) проявляет свойства основания. Соли
хрома (III) сильно гидролизуются, вследствие чего невозмож-
но существование Cr2(CO3)3.
Для полного протекания гидролиза необходимо кипятить
раствор для удаления CO2.
Опыт 38
Перевод хроматов в дихроматы
и дихроматов в хроматы
Результат:
1) Ионные реакции проведенных реакций:
а) 2CrO − 2 4+ 2H + ⇔ Cr2O 2− 7 + H2O
Раствор переходит из темной окраски в более темную.
б) Cr2O 2− 7 + 2OH − ⇔ 2CrO − 2 4+ H + .
Раствор становится темным.
Опыт 39
Взаимодействие хромата калия с хлоридом бария
Результат:
1) Ионные уравнения реакции:
K2CrO4 + BaCl2= BaCrO4↓ + 2HCl.
В сокращенной форме:
CrO − 2 4+ Ba 2+ = BaCrO4↓
2) Образуется хромат бария, имеющий желтый цвет
Опыт 40
Окисление ионов Mn 2+ до ионов Mn 4 +
Результаты:
1) Ионные уравнения приведенных реакций:
Mn 2+ + 2OH − = Mn(OH)2↓
Образуется гидроксид марганца (II) имеющий розовую ок-
раску.
Mn(OH)2 + H2O = Mn(OH)4 + H2O
92
Гидроксид марганца (II) быстро темнеет, окисляясь даже
кислородом воздуха до гидроксида марганца (IV).
Опыт 41
Получение гидроксида железа (III)
и изучение его свойств
Результат:
1) Ионные уравнения проведенных реакций:
а) FeCl3 + 3NaOH = Fe(OH)3↓ + 3NaCl.
Образуется бурый осадок гидроксида железа (III).
б) 2Fe(OH)3 + 3H2SO4 = Fe2(SO4)3 + 6H2O
Происходит растворение гидроксида железа (III) в серной
кислоте с образованием желто-коричневого раствора.
Опыт 42
Получение гидроксида железа (III)
и изучение его свойств
Результат:
1) Уравнения проведенных реакций:
а) FeSO4 + 2NaOH = Fe(OH)2↓ + Na2SO4
бледно-зеленый
б) 4Fe(OH)2 + 2H2O + O2 = 4Fe(OH)3↓
красно-коричневый
в) Fe(OH)2 + 2HCl = FeCl2 + H2O
образуется бледно зеленый раствор.
93
Опыт 43
Качественные реакции на ионы Fe 3+ и Fe3+
Результат:
1) Уравнения проведенных реакций:
а) Fe 3+ + [Fe(CN)6] 4− = [Fe2(CN)6] −
синего цвета
б) Fe3+ + CNS− = Fe(CNS)3↓
темно-красный осадок
в) Fe2+ + [Fe(CN)6] 3 − = [Fe2(CN)6] − .
синего цвета
Опыт 44
Гидролиз солей железа (III)
Результат:
1) Ионное уравнение гидролиза солей на первой стадии.
а) Fe 3+ + CO 2− 3 = Fe2(CO3)3
б) Fe2(CO3)3 + 3H2O = 2Fe(OH)3↓ + 3CO2↑
Образуется осадок красно-коричневого цвета и выделяется
углекислый газ.
Опыт 45
Получение гидроксида никеля (II)
и изучение его свойств
Результат:
1) Уравнение реакции:
а) NiSO4 + 2NaOH = Ni(OH)2↓ + Na2SO4
Образуется осадок зеленого цвета.
94
2) Исследование характера гидроксида никеля.
а) Ni(OH)2 + 2HCl = NiCl2 + H2O
Происходит растворение гидроксида с образованием блед-
но-зеленого раствора.
б) Ni(OH)2 + NaOH ≠ — реакция не происходит.
задача №
к главе «ЛАБОРАТОРНЫЕ ОПЫТЫ».
Видео:ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Химия, Биология, подготовка к ГИА и ЕГЭ
Ионные реакции — реакции между ионами в растворе
Давайте разберем основные ионные химические реакции неорганической и некоторые реакции органической химии.
Очень часто в различных заданиях по химии просят написать не только химические уравнения в молекулярной форме, но и в ионной (полные и сокращенные). Как уже было замечено, ионные химические реакции идут в растворах. Зачастую, вещества распадаются на ионы именно в воде.
Полное ионное уравнение химической реакции: все соединения — электролиты, переписываем в ионном виде с учетом коэффициентов:
2Na + +2OH — +2H + + SO -2 = 2Na + + SO4 -2 + 2H2O — полное ионное уравнение реакции
Сокращенное ионное уравнение химической реакции: сокращаем одинаковые составляющие:
OH — + H + = H2O — сокращенное ионное уравнение реакции
По результатам этого сокращения одинаковых ионов видно, какие ионы образовали то, что нерастворимо или малорастворимо — газообразные продукты или реагенты, осадки или малодиссоциирующие вещества.
Не раскладывают на ионы в ионных химических реакциях вещества:
1. нерастворимые в воде соединения (или малорастворимые) (см. ТАБЛИЦЫ );
Сa 2+ + 2NO3 — + 2Na + +2OH — = Ca(OH)2 + 2Na + +2NO3 — — полное ионное уравнение реакции
Сa 2+ + 2OH — = Ca(OH)2 — сокращенное ионное уравнение реакции
2. газообразные вещества, например, O2, Cl2, NO и т.д.:
2Na + + S -2 + 2H + +2Cl — = 2Na + + 2Cl — + H2S — полное ионное уравнение реакции
S -2 + 2H + = H2S — сокращенное ионное уравнение реакции
3. малодиссоциирующие вещества (H2O, NH4OH);
OH — + H + = H2O — сокращенное ионное уравнение реакции
4. оксиды (все: и образованные металлами, и неметаллами);
2AgNO3 + 2NaOH = Ag2O + 2NaNO3 + H2O
2Ag + + 2NO3 — + 2Na + + 2OH — = Ag2O + 2NO3 — + 2Na + + H2O — полное ионное уравнение реакции
2Ag + + 2OH — = Ag2O + H2O — сокращенное ионное уравнение реакции
5. органические вещества (органические кислоты относят к малодиссоциирующим веществам)
CH3COOH + Na + + OH — = CH3COO — + Na + + H2O — полное ионное уравнение реакции
CH3COOH + OH — = CH3COO — + H2O — сокращенное ионное уравнение реакции
Зачастую ионные химические реакции — это реакции обмена .
Если все участвующие в реакции вещества находятся в виде ионов, то связывание их с образованием нового вещества не происходит, поэтому реакция в этом случае практически не осуществима.
Отличительной особенностью химических реакций ионного обмена от окислительно-восстановительных реакций является то, что они протекают без изменения степеней окисления, участвующих в реакции частиц.
- в ЕГЭ это вопрос А23 — Реакции ионного обмена
- в ГИА (ОГЭ) это А8— Реакции ионного обмена
🎥 Видео
How to Write the Net Ionic Equation for HNO2 + Cr(OH)3 = Cr(NO2)3 + H2OСкачать

Ионные уравнения реакций. Составляем полные и сокращенные ионные уравнения. Часть 1.Скачать

Окислительно-восстановительные реакции в кислой среде. Упрощенный подход.Скачать

Электролитическая диссоциация кислот, оснований и солей. 9 класс.Скачать

Проклятая химическая реакция 😜 #shortsСкачать

Получим гидроксиды в 2 стадии (закрепление материала)Скачать
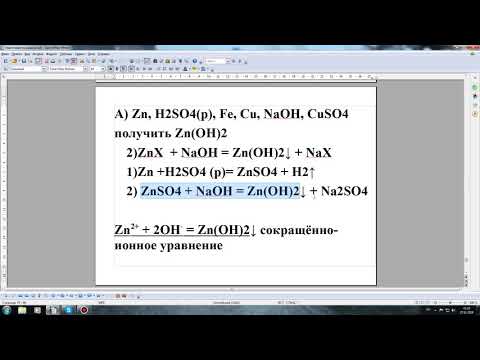
Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Полный разбор варианта ОГЭ | Химия 2023 | УмскулСкачать

Al(OH)3 + NaOH → Na[Al(OH)4] | Получение гидроксида алюминия и растворение его в избытке щёлочиСкачать
![Al(OH)3 + NaOH → Na[Al(OH)4] | Получение гидроксида алюминия и растворение его в избытке щёлочи](https://i.ytimg.com/vi/_u6eAdWg96A/0.jpg)
Химия 9 класс — Как определять Степень Окисления?Скачать

Расстановка коэффициентов в химических реакциях: как просто это сделатьСкачать

РИО. РАЗБОР ЗАДАНИЯ 31. ХИМИЯ ЕГЭСкачать

Окислительно-восстановительные реакции. Метод электронного баланса. ЕГЭСкачать

