| Хлорид кобальта II | |
|---|---|
 | |
 | |
| Систематическое наименование | Хлорид кобальта II |
| Традиционные названия | хлористый кобальт, двухлористый кобальт |
| Хим. формула | CoCl2 |
| Рац. формула | CoCl2 |
| Состояние | твёрдое |
| Молярная масса | 129,84 г/моль |
| Плотность | 3,356 г/см 3 гексагидрат: 1,92 г/см³ |
| Температура | |
| • плавления | 735 °C |
| • кипения | 1049 °C |
| Энтальпия | |
| • образования | −310 кДж/моль |
| ГОСТ | ГОСТ 4525-77 |
| Рег. номер CAS | 7646-79-9 |
| PubChem | 24288 |
| Рег. номер EINECS | 231-589-4 |
| SMILES | |
| RTECS | GF9800000 |
| ChEBI | 35696 |
| Номер ООН | 3288 |
| ChemSpider | 22708 |
| ЛД50 | 80 мг/кг |
| Токсичность | весьма ядовит |
| Сигнальное слово | опасно |
| Пиктограммы СГС |    |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Хлорид кобальта II (дихлорид кобальта) — кобальтовая соль соляной (хлороводородной) кислоты с формулой CoCl2. Относится к классу галогенидов кобальта.
Хлорид кобальта II гигроскопичен. Известны кристаллогидраты CoCl2· n H2O ( n = 1, 2, 4, 5, 6):
- сине-фиолетовый моногидрат (устойчив на воздухе до 110 °C, т. пл. 335 °C, с разложением);
- фиолетовый дигидрат (устойчив до 90 °C, т. пл. 206 °C, с разложением);
- темно-красный тетрагидрат;
- красный пентагидрат;
- розовый гексагидрат (т. пл. 51,2 °C, с разложением) — хлорид кобальта шестиводный: CoCl2·6H2O;
Видео:How to Write the Net Ionic Equation for CoCl2 + Ca(OH)2 = Co(OH)2 + CaCl2Скачать

Содержание
- 1 Физические свойства
- 2 Получение
- 3 Применение
- 4 Токсичность
Видео:Cobalt II Chloride Reaction With Sodium Hydroxide (CoCl2 + NaOH)Скачать
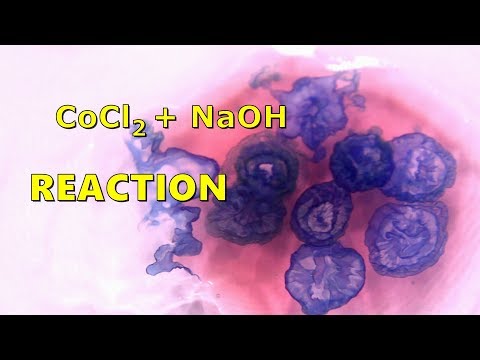
Физические свойства
Безводный дихлорид кобальта при нормальных условиях представляет собой парамагнитные гигроскопичные блестящие голубые гексагональные кристаллы, при нагреве до 680°C переходит в другую полиморфную модификацию.
- Молекулярная масса безводного вещества: 129,84.
- Температура кипения: 1049 °C.
- Температура плавления: 735 °C (по другим источникам 724 °C).
- Теплота плавления 38 кДж/моль.
- Теплота испарения 14,5 кДж/моль.
- Теплоёмкость 78,49 Дж/(моль·К).
- Молярная электропроводность при бесконечном разведении при 25 °C равна 260,7 См·см²/моль.
- Плотность: 3,356 г/см 3 .
- Давление паров при 770 °C: 5,33 кПа.
- Хорошо растворим в воде, метиловом и этиловом спиртах, ацетоне.
- Не растворяется в пиридине и метилацетате.
Растворимость в воде:
- при 7 °C 45,0 г/100 мл;
- при 20 °C 52,9 г/100 мл.
Видео:Химическая реакция CoCl2 с KSCNСкачать

Получение
- действием хлора на нагретый до 850—900 °C порошкообразный кобальт;
- растворением металлического кобальта, его оксида CoO, гидроксида Co(OH)2 или карбоната CoCO3 в НСl с последующей дегидратацией в вакууме при 150 °C или обработкой тионилхлоридом SOCl2.
- безводный — дегидратацией кристаллогидратов CoCl2· n H2O;
Видео:How to find the Oxidation Number for C in the K2C2O4 ion. (Potassium oxalate ion)Скачать

Применение
- Применяют в метеорологии для изготовления индикаторной бумаги, с помощью которой определяют атмосферную влажность.
- протравы при крашении тканей,
- микродобавки в корм скоту,
- компоненты растворов для нанесения кобальтовых покрытий на металлы
- индикатор влажности в составе силикагеля, используется свойство изменения окраски кристаллогидрата при увеличении количества захваченных молекул воды.
- для получения катализаторов
- Хлорид кобальта придает стеклянной массе синюю окраску, поэтому он применяется для производства синего и голубого декоративного стекла.
- Хлорид кобальта образует прочные связи с циан-ионом. Это навело на мысль использовать хлорид кобальта в качестве антидота при отравлении цианидами. Хотя был получен положительный эффект, сами соли кобальта обладают высокой токсичностью и являются канцерогенами.
- для низкотемпературного капсулирования порошка гамма-оксида железа (III) ферритом кобальта (II) в производстве магнитных лент.
Видео:8 Подключение комнатного регулятора температуры и приоритетного устройства к котлу EKCO.L2Скачать

Токсичность
Как и все соединения кобальта, его хлорид ядовит.
Видео:Токовые клещи СМ2С от IEK. Практика применения.Скачать

Cocl2 4kscn k2 co scn 4 2kcl ионное уравнение
Реакции ионного обмена, протекающие между растворами солей
I. Запишем уравнение реакции между растворами карбоната натрия и хлорида кальция.
В результате этого взаимодействия образуется осадок карбоната кальция и хлорид натрия.
Рис. 1. Осадок карбоната кальция
Na 2CO 3 +CaCl 2 = CaCO 3 ↓ + 2NaCl — молекулярное уравнение
Рассмотрим сущность данной реакции обмена. Вы знаете, что карбонат натрия в воде диссоциирует на два катиона натрия и карбонат-анион.
Хлорид кальция в воде также диссоциирует на катион кальция и хлорид — анионы.
В ходе реакции осуществляется обмен ионами, приводящий к образованию осадка карбоната кальция.
2Na + + CO3 2- + Ca 2+ + 2Cl — = CaCO 3 ↓ + 2Na + + 2Cl — — полное ионное уравнение.
Ca 2+ + CO 3 2- = CaCO 3 ↓ – сокращённое ионное уравнение
Химические реакции, протекающие в растворах с участием свободных ионов, называются ионными реакциями.
Запись уравнения реакции с участием ионов называют уравнением в ионной форме (ионное уравнение)
II. Запишем ещё одно уравнение химической реакции, приводящей к образованию осадка карбоната кальция.
При взаимодействии карбоната натрия с нитратом кальция образуется осадок карбоната кальция и нитрат натрия. Запишем уравнение в молекулярной форме:
Na 2CO 3 +Ca(NO 3) 2 = CaCO 3 ↓ + 2NaNO 3 — молекулярное уравнение
Запишем уравнение в ионной форме:
2Na + + CO 3 2- + Ca 2+ + 2NO 3 — = CaCO 3 ↓ + 2Na + + 2 NO 3 — – полное ионное уравнение
Ca 2+ + CO 3 2- = CaCO 3 ↓ – сокращённое ионное уравнение
Обратите внимание: суть обеих реакций взаимодействия карбоната натрия с нитратом кальция и с хлоридом кальциям сводится к тому, что из катиона кальция и карбонат — аниона образуется нерастворимый карбонат кальция.
Теперь мы видим, что для получения карбоната кальция надо взять такие вещества, чтобы в состав одного вещества входили катионы кальция, а в состав другого – карбонат — ионы.
Сущность реакции ионного обмена отражают с помощью сокращённого ионного уравнения.
Видео:How to Write the Net Ionic Equation for CuSO4 + K2S = CuS + K2SO4Скачать

Образование осадка сульфата бария
Видео:How to find the Oxidation Number for Cr in Na2CrO4 (Sodium chromate)Скачать
Рассмотрим еще пример реакции ионного обмена, приводящей к образованию осадка.
Запишем уравнение реакции между сульфатом калия и хлоридом бария в молекулярном виде, в сокращённом ионном виде и в полном ионном виде.
K 2SO 4 +BaCl 2 = BaSO 4 ↓ + 2KCl – молекулярное уравнение
При взаимодействии сульфата калия и хлоридом бария образуется осадок сульфата бария и хлорид калия. Это молекулярная форма уравнения.
Ниже записана полная ионная форма.
2K + + SO 4 2- + Ba 2+ + 2Cl — = BaSO 4 ↓ + 2K + + 2Cl — – полное ионное уравнение
Если мы зачеркнём слева и справа одинаковые ионы, то получим сокращённое ионное уравнение.
Ba 2+ + SO 4 2- = BaSO 4 ↓ – сокращённое ионное уравнение
Таким образом, для получения сульфата бария необходимо, чтобы в состав одного вещества входили катионы бария, а в состав другого – сульфат – анионы.
1. Какой из приведенных реакций не соответствует сокращенное ионное уравнение: Ba 2+ + SO4 2- = BaSO4?
Ответ: уравнению №2, т.к. вода тоже является неэлектролитом и на ионы не распадается: Ba 2+ + 2OH — + 2H + + SO4 2- = BaSO4 + 2H2O
2. Какой из приведенных реакций соответствует сокращенное ионное уравнение Ca 2+ + CO3 2- = CaCO3?
Ответ: уравнение №1, т.к. оба исходных вещества — растворимые соли, распадаются на ионы, а в продуктах реакции только одно вещество CaCO3выпадает в осадок
3. Реакция между какой парой веществ сопровождается одновременным выпадением осадка и образованием воды?
1) Нитрат калия и хлорид кальция
2) карбонат бария и соляная кислота
3) гидроксид бария и соляная кислота
4) гидроксид бария и серная кислота
4. Реакция между какой парой веществ сопровождается одновременным выделением газа и образованием воды?
1) сульфид натрия и соляная кислота
2) силикат натрия и соляная кислота
3) карбонат натрия и соляная кислота
4) хлорид натрия и серная кислота
5. Какая пара ионов не может одновременно присутствовать в растворе?
Ответ: №2, т.к. ионы меди и сульфид-ионы образуют нерастворимую соль сульфид меди (II)
6. При сливании каких двух растворов в воде практически не остается ионов?
Ответ: №2, т.к. Ba(OH)2 + H2SO4 = BaSO4 + 2H2O происходит связывание всех ионов с образованием осадка и воды
7. При добавлении какого вещества к раствору гидроксида натрия происходит выделение газа?
Ответ: №1, т.к. NH4Cl + NaOH = NaCl + NH3 + H2O
Видео:How to find the Oxidation Number for Cr in Cr2S2Скачать

Комплексные соединения
Видео:CO2 MonitorСкачать

Комплексные соединения
Комплексные соединения классифицируются по природе лигандов или по характеру комплексных ионов.
Чаще комплексные соединения классифицируются по природе лиганда. Следуя этому принципу, можно выделить следующие группы комплексных соединений: аммиакаты и аминаты, аквакомплексы, ацидокомплексы, полигалогениды и др.
Аммиакаты – комплексы, содержащие во внутренней сфере в качестве лигандов молекулы аммиака. Их образуют почти все металлы.
Аммиакаты меди, серебра, никеля легко образуются при смешении растворов соответствующей соли и аммиака. При этом сначала образуется основная соль, которая затем растворяется вследствие процесса комплексообразования. Например:
2CuSO4 + 2NH4OH = (CuOH)2SO4↓ + (NH4)2SO4;
(CuOH)2SO4↓ + 8NH4OH = [Cu(NH3)4]SO4 + [Cu(NH3)4](OH)2 + 8H2O.
Аминаты – комплексные соединения, содержащие в качестве лиганда различные органические амины, чаще всего этилендиамин NH2 – CH2 – CH2 – NH2, который в комплексном соединении занимает обычно два координационных места. Таковы, например, соединения: [PtEn2]Cl2, [CoEn3]Cl3, [NiEn3]Br2, где En – молекула этилендиамина.
Аквакомплексы — комплексные соединения, в которых лигандами являются молекулы воды. При кристаллизации аквакомплексов образуются кристаллогидраты.
В кристаллогидратах молекулы воды обычно координированы вокруг катиона. Строение их не во всех случаях установлено, поэтому в химических формулах кристаллогидратов присоединение воды обычно указывают посредством точки: CrCl3∙6H2O, CuSO4∙5H2O, CoCl3∙6H2O, FeSO4∙7H2O, Na2CO3∙10H2O.
Ацидокомплексы — комплексные соединения, в которых лигандами являются кислотные остатки: K2[HgI4], Na2[PtCl6], K3[Ag(S2O3)2].
Ацидокомплексы можно представить и как сочетание солей, вследствие чего их также называют комплексными соединениями типа двойных солей: HgI2 ∙ 2KI, PtCl4 ∙ 2NaCl, Ag2S2O3 ∙ 3K2S2O3.
Существуют также комплексные соединения, во внутренней сфере которых имеются как молекулы воды, так и молекулы аммиака и кислотные остатки. Известны ряды комплексных соединений, в которых осуществляется постепенный переход от аммиакатов к аква – или ацидосоединениям, например: [Cr(NH3)6]3+, [Cr(NH3)5H2O]3+, [Cr(NH3)4(H2O)2]3+, [Cr(NH3)3(H2O)3]3+, [Cr(NH3)2(H2O)4]3+, [Cr(NH3)(H2O)5]3+, [Cr(H2O)6]3+.
В зависимости от характера комплексных ионов, комплексные соединения подразделяется на следующие группы:
а) катионные комплексы [Cu(NH3)4]Cl2, [Cr(H2O)6]Cl3;
б) анионные комплексы K3[Fe(CN)6], H2[SiF6];
в) катионно-анионные комплексы [Pt(NH3)4][PtCl4], [Co(NH3)6][Co(C2O4)3];
г) нейтральные комплексы (неэлектролиты) [Co(NH3)3(NO2)3]o, [Pt(NH3)2Br4]o.
Номенклатура комплексных соединений
Согласно современной номенклатуре первым в комплексном соединении называется анион в именительном падеже и только потом катион — в родительном падеже.
При названии комплексного иона прежде всего называют находящиеся во внутренней сфере анионы, прибавляя к их латинскому названию окончание «о», Например, хлоро(хлоридо), циано(цианидо), сульфито, OН — гидроксо и т. д.
Далее называют нейтральные лиганды. При этом пользуются терминами: для координированного аммиака — аммин, для воды — аква. Число лигандов указывают греческими числительными: 1 — моно (обычно не приводится),
2 — ди, 3 — три, 4 — тетра, 5 — пента, 6 — гекса. Затем переходят к названию центрального атома. Если центральный атом входит в состав комплексного катиона, то использует русское название элемента и в скобках указывают его степень окисления (римскими цифрами). Если центральный атом содержится в комплексном анионе, то употребляют латинское название комплексообразователя, после которого указывают его степень окисления, а в конце прибавляют суффикс – ат, например:
[Pt(NH3)4Cl2]Cl2 – хлорид дихлоротетраамминплатины (IV);
[Ag(NH3)2]Cl – хлорид диамминсеребра (I);
K2[HgI4] – тетраидомеркурат (II) калия или тетраиодогидраргират (II) калия;
(NH4)2[Pt(OH)2Cl4] – дигидроксотетрахлороплатинат (IV) аммония.
Те же принципы соблюдаются и при наименовании комплексных соединений, не являющихся электролитами. Например: [Pt(NH3)2Br4] – тетрабромодиамминплатина (IV).
а) Дайте названия комплексным соединениям: [Ni(NH3)6]Cl2 , Na2[Zn(OH)4];
б) Составьте формулу комплексного соединения по его названию: гексацианоферрат (II) калия; гексатиоцианоферрат (III) калия.
Для (а) и (б) укажите центральный атом, лиганды, внутреннюю координационную сферу, внешнюю сферу. Напишите уравнения диссоциации этих соединений в водных растворах и выражения для констант нестойкости.
2.а) В каком растворе (при равной молярной концентрации), больше ионов Ag+ :
[Ag(NO2)2-; [Ag(NH3)2]+; [Ag(S2O3)2]3- . Константы нестойкости комплексных ионов соответственно равны 1,3 ∙ 10-3; 6,8 ∙ 10-8; 1,0 ∙ 10-13 . Напишите формулы соединений, содержащих эти ионы.
б) Константы нестойкости комплексных ионов: [Co(CN)4]2-; [Cd(CN)4]2-; [(Hg(CN)4]2- соответственно равны 8 × 10-20, 4 ×10-41 , 1,4 × 10-17. Какой из этих ионов является более прочным? Напишите формулы соединений, содержащих эти ионы.
3. а)В каком направлении будет протекать процесс и почему?
К2[HgI4] + 4KCN Û K2[Hg(CN)4] + 4KI
Kнест = 1,38 ×10-30 Kнест =6,03 ×10-10
б) Допишите уравнения реакций и установите, в каком направлении они будут протекать. Объясните почему.
[Cd(NH3)4]CI2 + KCN= K[Ag(CN)2] + K2S2O3 =
Kн ([Cd(NH3)4]2+) = 2,75∙10-7 Kн([Ag(CN)2]1-) = 1,0 × 10-21
Kн ([Cd(CN)4]2-) = 7,76∙10-18 Kн([Ag(S2O3)]1-) =1,0 ×10-18
Пример решения 1-го вопроса.
Формула комплексного соединения и его название
📹 Видео
Sally On C v2 (104bpm)Скачать

Как написать чистое ионное уравнение для K2S + CoCl2 = KCl + CoSСкачать

How to Write the Net Ionic Equation for CaCl2 + K2SO4= CaSO4 + KClСкачать

Как написать суммарное ионное уравнение для CoCl2 + КОН = Co(OH)2 + KClСкачать

How to Write the Net Ionic Equation for CaCl2 + Na2S = NaCl + CaSСкачать

How to Write the Net Ionic Equation for CuSO4 + K2CO3 = CuCO3 + K2SO4Скачать

How to Write the Net Ionic Equation for CaCl2 + ZnSO4 = ZnCl2 + CaSO4Скачать

Как написать чистое ионное уравнение для CoCl2 + NaOH = Co(OH)2 + NaClСкачать

How to Write the Net Ionic Equation for K2S + CuCl2 = KCl + CuSСкачать

How to find the Oxidation Number for C in CuCO3 | Copper (II) carbonateСкачать




