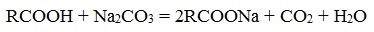- Содержание:
- История открытия мыла
- Химическая формула мыла
- Особенные свойства мыла
- Классификация мыла
- Способы получения мыла
- Процесс изготовления мыла
- Как ПАВ влияют на природу
- Вопрос 7 Параграф 13 Химия 10 класс О.С.Габриелян Мыла все про них
- Что такое мыло поясните записью уравнения химической реакции какими опытами можно
- 🎥 Видео
Содержание:
Мыло – это вещество, которое используется в качестве косметического средства или средства бытовой химии. Это жидкий или твердый продукт, который содержит поверхностно-активные вещества (ПАВ). Эти вещества снижают поверхностное натяжение и увеличивают смачивающую способность воды.
Видео:Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

История открытия мыла
Впервые о мыле в Древнем Риме в 77 г. н.э. говорил Плиний Старший. В Русь из Византийской империи пришло не только православие, но и мыло. Особенно поддерживал мыловарение Петр I.
Формула мыла в химии была определена Мишелем Эжен Шеврёль в XIX веке. Ученый установил, что мыло — это смесь натриевых солей жирных кислот. В нашей столице первое производство мыла было открыто во второй половине XIX века. Мыло стоило одну копейку, поэтому его могли покупать даже бедные люди.
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Химическая формула мыла
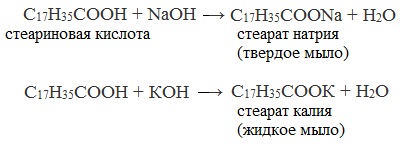
Например, формула твердого мыла C17H35COONa, а жидкого – C17H35COOК. В состав мыла также входят красящие вещества и ароматизаторы.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Особенные свойства мыла
Мыло формирует пену благодаря образованию мицелл и высокой поверхностной активности. Остаток кислоты – гидрофобная часть очищающего средства, карбоксильный ион – гидрофильная.
Грязь растворяется в несколько этапов:
- Гидрофобная часть мыла связывается с гидрофобной частью грязи, которая обволакивается слоем гидрофильных групп.
- Гидрофильная часть мыла реагирует с водой.
- Ионы мыла притягивают грязь, которая с потоком воды удаляется с поверхности.
Видео:Расчеты по уравнениям химических реакций. 1 часть. 8 класс.Скачать

Классификация мыла
I. По особенностям реагирования с водой:
- растворимые щелочные – калиевые, натриевые и аммониевые соли высших карбоновых кислот;
- нерастворимые металлические – соли других металлов.
II. По агрегатному состоянию:
- жидкие – соли калия, аммония;
- твердые – соли натрия, лития и других металлов.
III. По сферам применения:
- хозяйственные (применяются для стирки вещей);
- медицинские (содержат дезинфицирующие средства);
- туалетные (используются для мытья тела) и др.
Видео:8 класс. Составление уравнений химических реакций.Скачать

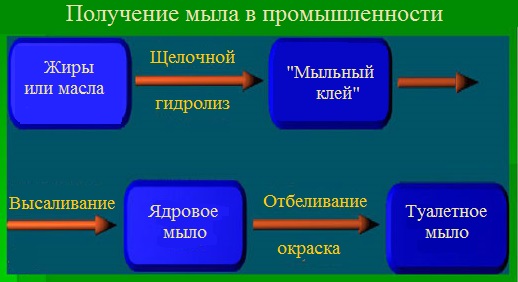
Способы получения мыла
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Процесс изготовления мыла
Очищающее средство в промышленных условиях синтезируют в результате двух стадий.
- Химическая стадия. Она включает в себя карбонатное омыление, где нейтрализуется около 70 % кислот. Остальная часть кислот нейтрализуются гидроксидом натрия.
- Механическая стадия. Охлаждение, сушение, шлифование, отделка и упаковка готового материала.
Мыло можно сварить двумя способами.
- Прямой способ. В данном случае применяется только хорошо очищенная жировая смесь. В результате образуется мыльный клей, на 67-70% состоящий из жирных кислот. Прямой способ актуален в производстве хозяйственного мыла.
- Косвенный способ. Мыльный клей высаливают, т.е. обрабатывают электролитами. Мыльную массу затем разделяют на несколько фаз: ядро, подмыльный клей, подмыльный щелок. Мыльное ядро примерно на 65 % состоит из высших карбоновых кислот. Потом ядро обрабатывают как очищающее средство, полученное прямым способом. Косвенный способ актуален для изготовления декоративные мыла.
Видео:Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Как ПАВ влияют на природу
Водоемы могут самоочищаться, что достигается разбавлением, оседанием частичек на дно и созданием отложений, разложением органики до аммиака и солей аммония при помощи микробов. Устранить негативные последствия действия ПАВ сложно, ведь ПАВ в водоемах присутствуют в виде гомологов и изомеров. Если концентрация ПАВ в смеси близка к критической, то вредные свойства всех веществ в смеси суммируются.
ПАВ можно классифицировать на две группы:
- быстро разрушающиеся;
- практически неразрушающиеся и накапливающиеся в опасных концентрациях.
ПАВ опасны для природы, т. к. они понижают поверхностное натяжение. Если в водоемах поверхностное натяжение изменяется, то концентрация кислорода в воде снижается. Это приводит к развитию биомассы водных растений и гибели водных животных. Но ПАВ могут быть не только вредными, но и безопасными. Некоторые ПАВ распадаются на углеводы.
В организм человека или животного ПАВ попадают с пищей, водой и через кожу. ПАВ могут вызывать аллергию, которые иногда сопровождаются осложнениями.
Видео:Химия | Тепловой эффект химической реакции (энтальпия)Скачать

Вопрос 7 Параграф 13 Химия 10 класс О.С.Габриелян Мыла все про них
Приветики) С определением поможете?? Еще и получение мыла бы. короче я не знаю как отвечать( помогите.
Что такое мыла? Как их получают? Почему реакцию ще-
лочного гидролиза жиров называют омылением?
Привет. да ты же мыло каждый день используешь, а не знаешь про него ничего((( теперь будешь знать, держи ответ.
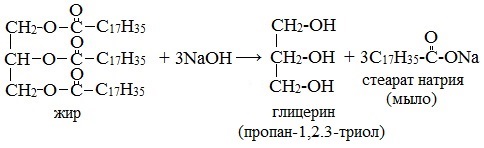
Мыла — соли высших карбоновых кислот, их получают путем омыления жиров, гидролизом жиров в щелочной среде. Реакцию щелочного гидролиза жиров называют омылением, т.к. продуктами данной реакции являются мыла и глицерин.
Видео:Решение задач на термохимические уравнения. 8 класс.Скачать

Что такое мыло поясните записью уравнения химической реакции какими опытами можно
Известно несколько способов получения мыл.
- Нейтрализация кислот углекислым натрием (кальцинированной содой)
- Нейтрализация кислот гидроксидом натрия (каустической содой)
Жидкие калиевые мыла и твердые натриевые мыла получают растворением высших алифатических кислот в водных растворах едких щелочей:
- Омыление триглицеридов гидроксидом натрия
Получение мыла основано на реакции омыления — кипячением животного сала либо растительного масла с гидроксидом натрия или калия (гидролиз сложных эфиров жирных кислот (т.е. жиров) в присутствии щелочей), в результате которого образуется трехатомный спирт глицерин и соли высших карбоновых кислот (мыло):
Прямой способ. В специальных емкостях (варочных котлах) нагретые жиры омыляют едкой щёлочью (обычно гидроксидом натрия). Для гидролиза жира в щелочной среде берется немного топленого свиного сала, около 10 мл этилового спирта и 10 мл раствора щелочи.
В результате реакции в варочных котлах образуется однородная вязкая жидкость, густеющая при охлаждении — мыльный клей, состоящий из мыла и глицерина. Содержание жирных кислот в мыле, полученном непосредственно из мыльного клея обычно 40—60 %. Такой продукт имеет название «клеевого мыла».
Косвенный способ заключается в дальнейшей обработке мыльного клея.
Варку мыла заканчивают обработкой мыльного раствора (мыльного клея) избытком щелочи или раствором хлорида натрия. В результате этого на поверхность раствора всплывает концентрированный слой мыла, называемый ядром.
Он содержит не менее 60 % жирных кислот; нижний слой — подмыльный щёлок, раствор электролита с большим содержанием глицерина. (также содержит загрязняющие компоненты, содержавшиеся в исходном сырье).
Полученное мыло называют ядровым, а процесс его выделения из раствора – отсолкой или высаливанием.
Производство хозяйственного мыла заканчивают на стадии высаливания, при этом происходит очистка мыла от белковых, красящих и механических примесей. Производство туалетного мыла проходит все стадии механической обработки. Наиболее важной из них является шлифовка, т.е. переведение ядрового мыла в раствор кипячением с горячей водой и повторным высаливанием. При этом мыло получается особо чистым и светлым.
Для улучшения некоторых характеристик хозяйственного мыла, а также для удешевления в него вводят наполнители: некоторые натриевые соли, которые при растворении в воде приводят к подщелачиванию; клеи и крахмал – способствуют пенообразованию мыльного раствора и стойкости пены, однако моющей способностью не обладают.
Особое место среди наполнителей занимает сапонин, получаемый выщелачиванием некоторых растений и прежде всего мыльного корня. Он хорошо растворяется в воде и его растворы сильно пенятся. Сапонин применяют для дорогих сортов мыла.
При использовании в качестве щёлочи каустической соды получают твердое натриевое мыло. Мягкое или даже жидкое калиевое мыло образуется, когда применяется каустический поташ.
Главное условие красящих веществ, употребляемых для подкраски туалетного мыла, — это хорошее смешивание их с мылом и отсутствие вредного влияния на кожу.
Красный цвет для прозрачного мыла получают при помощи фуксина и эозина, для непрозрачного мыла используют киноварь и сурик. Желтый цвет мылу придает экстракт куркумы и пикриновая кислота. Для получения мыла зеленого цвета применяют зеленый анилин или хромовую зеленую краску. Коричневый цвет мыла образуется из светлой или темной коричневой анилиновой краски или жженого сахара.
В промышленности вместо щелочи применяют соду, а так как жиры являются одной из главных составляющих пищи человека, то за основу берут не животные жиры, а углеводороды, входящие в состав парафинов (нефти).
Мыла полученные из синтетических кислот аналогичны по своей химической природе обычным мылам.
🎥 Видео
Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Экзо- и эндотермические реакции. Тепловой эффект химических реакций. 8 класс.Скачать

Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

Опыты по химии. Омыление жировСкачать

25. Схема реакции и химическое уравнениеСкачать

Опыты по химии. Сравнение свойств мыла и синтетических моющих средств: мыло и СМС в жесткой водеСкачать

Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Обратимость и необратимость химических реакций. Химическое равновесие. 1 часть. 9 класс.Скачать

Скорость химических реакций. 9 класс.Скачать

ХИМИЧЕСКИЕ УРАВНЕНИЯ | Как составлять уравнения реакций | Химия 8 классСкачать