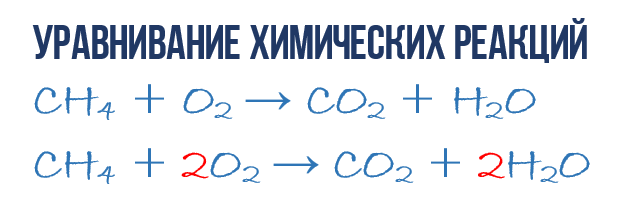Химическое уравнение – это условное изображение химической реакции с помощью химических формул веществ, числовых коэффициентов и математических символов.
При записи химических уравнений должен строго соблюдаться закон сохранения массы: массы вступивших в реакцию веществ, равны массе продуктов реакции.
Химическая реакция – процесс, при котором вещества, обладающие определенным составом и свойствами, превращаются в другие вещества – с другим составом и свойствами. При этом в составе атомных ядер изменений не происходит.
Химические реакции всегда сопровождаются физическими эффектами – поглощением или выделением теплоты, изменениями агрегатного состояния и окраски веществ.
Пример составления химического уравнения:
слева 2 атома Fe – справа 1 атом Fe (множитель 2)
слева 3 атома O – справа 1 атом O (множитель 3)
Затем подбирается коэффициент для H2O:
слева 2 атома H – справа 2 атома H (множитель 1), но т.к. справа 3 атома O, то множитель для H2O получаем 3. Н в правой части уравнения имеет множитель 6, для равновесия Н, в левой части используем множитель 3.
Итоговое химическое уравнение:
Выпадение осадка в результате химической реакции обозначается в химическом уравнении стрелкой вниз ↓. Это означает, что соединение нерастворимо:
Выделение газа в результате химической реакции обозначается в химическом уравнении стрелкой вверх ↑.
Виды химических реакций.
Реакции соединения: хотя бы два элемента образуют один продукт:
Реакции разложения: вещество распадается на два или более простых элемента (соединения):
Реакция замещения: обязательно участвуют атомы какого-нибудь простого вещества, которые замещают атомы одного из элементов в сложном веществе:
Цинк заместил водород в его соединении с хлором (HCl). Водород при этом выделяется в виде газа.
Реакция обмена: реагенты и продукты реакции являются сложными веществами:
Видео:Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Актуальные вопросы химической символики
статья (химия, 11 класс) по теме
В статье обсуждаются вопросы корректного использования химических символов и даны рекомендации по устранению ошибок, которые могут привести к снижению оценки ЕГЭ в части С.
Видео:Стрелки вверх и вниз, что значат?Скачать

Скачать:
| Вложение | Размер |
|---|---|
| aktualnye_voprosy_himicheskoy_simvoliki_avtosohranennyy.docx | 22.63 КБ |
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Предварительный просмотр:
Актуальные вопросы химической символики
В.О.Воробьев, методист ИМЦ, учитель химии ГБОУ СОШ №77
Для успешной сдачи ЕГЭ по химии учащимся необходимо выполнить задания всех частей (А, В и С), представленных в КИМах. Причем, в отличие от частей А и В, где необходимо отметить правильный ответ или привести последовательность цифр, часть С предполагает развернутые ответы на поставленные вопросы и проверяется экспертами.
Опыт работы автора в экспертной комиссии на протяжении нескольких лет говорит о том, что учащиеся зачастую либо не знают смысла химических символов и используют их формально, либо не придают значения правильности и точности их записи. В настоящей работе сделана попытка обобщения допускаемых ошибок и неточностей, а также даны рекомендации по использованию элементов химического языка, не допускающего двоякого толкования.
С помощью знаков и чисел показывают степени окисления и заряды ионов. Причем, для обозначения степени окисления знак ставят перед числом, а заряда иона — после числа. Например: SO 3 -2 – оксид серы (VI), в котором атомы кислорода проявляют степень окисления -2 ,а SO 3 2- — двузарядный сульфит-анион. Как видно, последовательность символов принципиально влияет на смысл приведенных записей.
Для различия единичных значений принята запись знаков и единицы для степеней окисления и только знаков для заряда ионов. Ag +1 – атом серебра, находящийся в степени окисления +1, а Ag + — однозарядный катион серебра; Cl -1 – атом хлора в степени окисления -1, а Cl — — однозарядный анион хлора. Попытка не следовать этому правилу приводит к абсурду: NO 3 -1 – несуществующее соединение азота и кислорода, в котором атомы кислорода проявляют степень окисления -1, тогда как NO 3 — — вполне корректная формула нитрат- аниона. Кроме того, символы 1- или 1+ в химической письменности вообще отсутствуют.
Степень окисления также может быть равна нулю, поэтому, например, запись С 0 вполне однозначна — в простых веществах или в формальдегиде степень окисления углерода действительно равна нулю. Попытка подобным образом показать отсутствие заряда у электронейтральной молекулы также приводит к абсурду: запись H 2 O 0 говорит о том, что в молекуле воды атом кислорода имеет степень окисления равную нулю, что, конечно же, не так.
В заданиях С1 в качестве окислителя нередко встречается перманганат калия KMnO 4 . При составлении уравнения электронного баланса запись
означает, что в перманганате калия марганец будто бы находится в состоянии семизарядного катиона, что, конечно, не так, тогда как запись
вполне корректна, ведь уравнения электронного баланса описывают изменения именно степеней окисления, а не зарядов ионов.
«Стрелка или равенство»
Согласно каноническому определению, химия – наука о веществах, их превращениях и явлениях, сопровождающих эти превращения. Состав веществ выражают химические формулы, превращение веществ – химические уравнения, включающие формулы и коэффициенты, а явления, сопровождающие превращения — термохимические уравнения. В связи с этим, при записи собственно уравнений между левой и правой частью ставят стрелку:
Если же указан тепловой эффект, необходим знак равенства, так как учтены не только материальные, но и энергетические изменения, происходящие в ходе процесса:
Иногда учащиеся составляют схему реакции, например:
в которую после расстановки коэффициентов добавляется символ.
2Al + 3S __→ Al 2 S 3
Такой символ не встречается в химической литературе и допускает двоякое толкование. Добавим лишь, что коэффициенты в уравнениях должны ставиться учащимися по умолчанию, а не по указанию учителя.
«Символы над стрелкой»
При записи уравнений многих реакций необходимо указывать наличие специальных условий их проведения – нагревания (t или Δ), давления (р), присутствия катализатора и т.п. При этом следует различать условия протекания и условия возникновения реакции. Так, например, для начала процесса горения угля действительно требуется нагревание, однако далее реакция протекает самопроизвольно, поэтому в присутствии над стрелкой обозначения нагревания нет необходимости. Наоборот, запись
указывает на эндотермичность процесса; запись же
СаСО 3 t → СаО + СО 2
вполне правомерна, т.к. разложение карбоната кальция процесс эндотермический.
«Стрелки вниз и вверх».
Если продукт реакции выпадает в осадок, это часто показывают направленной вниз стрелкой. При этом, как правило, проблем не бывает, если учащиеся ищут информацию в таблице растворимости. Другое дело, использование стрелки, направленной вверх, для обозначения факта выделения газообразного продукта.
Привычка всегда ставить этот знак после формулы водорода Н 2 ↑ может приводить к неточностям. К примеру, в уравнении реакции
2СН 4 t → С 2 Н 2 + 3Н 2 ↑
газообразное состояние водорода почему-то подчеркивается стрелкой, тогда как агрегатное состояние ацетилена остается загадкой. Подобные записи, конечно же, говорят о формальности химических знаний и формальном использовании химической символики.
В заключение отметим, что грамотное применение химических символов убережет учащихся от снижения оценки их письменной работы в части С при ее проверке экспертами.
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Урок 13. Составление химических уравнений
В уроке 13 «Составление химических уравнений» из курса «Химия для чайников» рассмотрим для чего нужны химические уравнения; научимся уравнивать химические реакции, путем правильной расстановки коэффициентов. Данный урок потребует от вас знания химических основ из прошлых уроков. Обязательно прочитайте об элементном анализе, где подробно рассмотрены эмпирические формулы и анализ химических веществ.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Химическое уравнение
В результате реакции горения метана CH4 в кислороде O2 образуются диоксид углерода CO2 и вода H2O. Эта реакция может быть описана химическим уравнением:
Попробуем извлечь из химического уравнения больше сведений, чем просто указание продуктов и реагентов реакции. Химичекое уравнение (1) является НЕполным и потому не дает никаких сведений о том, сколько молекул O2 расходуется в расчете на 1 молекулу CH4 и сколько молекул CO2 и H 2 O получается в результате. Но если записать перед соответствующими молекулярными формулами численные коэффициенты, которые укажут сколько молекул каждого сорта принимает участие в реакции, то мы получим полное химическое уравнение реакции.
Для того, чтобы завершить составление химического уравнения (1), нужно помнить одно простое правило: в левой и правой частях уравнения должно присутствовать одинаковое число атомов каждого сорта, поскольку в ходе химической реакции не возникает новых атомов и не происходит уничтожение имевшихся. Данное правило основывается на законе сохранения массы, который мы рассмотрели в начале главы.
Видео:Аминокислоты, которые НАДО ЗНАТЬ ДЛЯ ЕГЭ ПО ХИМИИСкачать

Уравнивание химических реакций
Уравнивание химических реакций нужно для того, чтобы из простого химического уравнения получить полное. Итак, перейдем к непосредственному уравниванию реакции (1): еще раз взгляните на химическое уравнение, в точности на атомы и молекулы в правой и левой части. Нетрудно заметить, что в реакции участвуют атомы трех сортов: углерод C, водород H и кислород O. Давайте подсчитаем и сравним количество атомов каждого сорта в правой и левой части химического уравнения.
Начнем с углерода. В левой части один атом С входит в состав молекулы CH4, а в правой части один атом С входит в состав CO2. Таким образом в левой и в правой части количество атомов углерода совпадает, поэтому его мы оставляем в покое. Но для наглядности поставим коэффициент 1 перед молекулами с углеродом, хоть это и не обязательно:
Затем переходим к подсчету атомов водорода H. В левой части присутствуют 4 атома H (в количественном смысле H4 = 4H) в составе молекулы CH4, а в правой – всего 2 атома H в составе молекулы H2O, что в два раза меньше чем в левой части химического уравнения (2). Будем уравнивать! Для этого поставим коэффициент 2 перед молекулой H2O. Вот теперь у нас и в реагентах и в продуктах будет по 4 молекулы водорода H:
Обратите свое внимание, что коэффициент 2, который мы записали перед молекулой воды H2O для уравнивания водорода H, увеличивает в 2 раза все атомы, входящие в ее состав, т.е 2H2O означает 4H и 2O. Ладно, с этим вроде бы разобрались, осталось подсчитать и сравнить количество атомов кислорода O в химическом уравнении (3). Сразу бросается в глаза, что в левой части атомов O ровно в 2 раза меньше чем в правой. Теперь-то вы уже и сами умеете уравнивать химические уравнения, поэтому сразу запишу финальный результат:
Как видите, уравнивание химических реакций не такая уж и мудреная штука, и важна здесь не химия, а математика. Уравнение (4) называется полным уравнением химической реакции, потому что в нем соблюдается закон сохранения массы, т.е. число атомов каждого сорта, вступающих в реакцию, точно совпадает с числом атомов данного сорта по завершении реакции. В каждой части этого полного химического уравнения содержится по 1 атому углерода, по 4 атома водорода и по 4 атома кислорода. Однако стоит понимать пару важных моментов: химическая реакция — это сложная последовательность отдельных промежуточных стадий, и потому нельзя к примеру истолковывать уравнение (4) в том смысле, что 1 молекула метана должна одновременно столкнуться с 2 молекулами кислорода. Процессы происходящие при образовании продуктов реакции гораздо сложнее. Второй момент: полное уравнение реакции ничего не говорит нам о ее молекулярном механизме, т.е о последовательности событий, которые происходят на молекулярном уровне при ее протекании.
Видео:Как понять что вещество выпадает в осадок или образуется газСкачать

Коэффициенты в уравнениях химических реакций
Еще один наглядный пример того, как правильно расставить коэффициенты в уравнениях химических реакций: Тринитротолуол (ТНТ) C7H5N3O6 энергично соединяется с кислородом, образуя H2O, CO2 и N2. Запишем уравнение реакции, которое будем уравнивать:
Проще составлять полное уравнение, исходя из двух молекул ТНТ, так как в левой части содержится нечетное число атомов водорода и азота, а в правой — четное:
- 2C7H5N3O6 + O2 → CO2 + H2O + N2 (6)
Тогда ясно, что 14 атомов углерода, 10 атомов водорода и 6 атомов азота должны превратиться в 14 молекул диоксида углерода, 5 молекул воды и 3 молекулы азота:
Теперь в обеих частях содержится одинаковое число всех атомов, кроме кислорода. Из 33 атомов кислорода, имеющихся в правой части уравнения, 12 поставляются двумя исходными молекулами ТНТ, а остальные 21 должны быть поставлены 10,5 молекулами O2. Таким образом полное химическое уравнение будет иметь вид:
Можно умножить обе части на 2 и избавиться от нецелочисленного коэффициента 10,5:
Но этого можно и не делать, поскольку все коэффициенты уравнения не обязательно должны быть целочисленными. Правильнее даже составить уравнение, исходя из одной молекулы ТНТ:
Полное химическое уравнение (9) несет в себе много информации. Прежде всего оно указывает исходные вещества — реагенты, а также продукты реакции. Кроме того, оно показывает, что в ходе реакции индивидуально сохраняются все атомы каждого сорта. Если умножить обе части уравнения (9) на число Авогадро NA=6,022·10 23 , мы сможем утверждать, что 4 моля ТНТ реагируют с 21 молями O2 с образованием 28 молей CO2, 10 молей H2O и 6 молей N2.
Есть еще одна фишка. При помощи таблицы Менделеева определяем молекулярные массы всех этих веществ:
- C 7 H 5 N 3 O 6 = 227,13 г/моль
- O 2 = 31,999 г/моль
- CO 2 = 44,010 г/моль
- H 2 O = 18,015 г/моль
- N 2 = 28,013 г/моль
Теперь уравнение 9 укажет еще, что 4·227,13 г = 908,52 г ТНТ требуют для осуществления полной реакции 21·31,999 г = 671,98 г кислорода и в результате образуется 28·44,010 г = 1232,3 г CO2, 10·18,015 г = 180,15 г H2O и 6·28,013 г = 168,08 г N2. Проверим, выполняется ли в этой реакции закон сохранения массы:
| Реагенты | Продукты | |
| 908,52 г ТНТ | 1232,3 г CO 2 | |
| 671,98 г CO 2 | 180,15 г H 2 O | |
| 168,08 г N 2 | ||
| Итого | 1580,5 г | 1580,5 г |
Но необязательно в химической реакции должны участвовать индивидуальные молекулы. Например, реакция известняка CaCO 3 и соляной кислоты HCl, с образованием водного раствора хлорида кальция CaCl 2 и диоксида углерода CO 2 :
Химическое уравнение (11) описывает реакцию карбоната кальция CaCO3 (известняка) и хлористоводородной кислоты HCl с образованием водного раствора хлорида кальция CaCl2 и диоксида углерода CO2. Это уравнение полное, так как число атомов каждого сорта в его левой и правой частях одинаково.
Смысл этого уравнения на макроскопическом (молярном) уровне таков: 1 моль или 100,09 г CaCO3 требует для осуществления полной реакции 2 моля или 72,92 г HCl, в результате чего получается по 1 молю CaCl2 (110,99 г/моль), CO2 (44,01 г/моль) и H2O (18,02 г/моль). По этим численным данным нетрудно убедиться, что в данной реакции выполняется закон сохранения массы.
Интерпретация уравнения (11) на микроскопическом (молекулярном) уровне не столь очевидна, поскольку карбонат кальция представляет собой соль, а не молекулярное соединение, а потому нельзя понимать химическое уравнение (11) в том смысле, что 1 молекула карбоната кальция CaCO3 реагирует с 2 молекулами HCl. Тем более молекула HCl в растворе вообще диссоциирует (распадается) на ионы H + и Cl — . Таким образом более правильным описанием того, что происходит в этой реакции на молекулярном уровне, дает уравнение:
Здесь в скобках сокращенно указано физическое состояние каждого сорта частиц (тв. — твердое, водн. — гидратированный ион в водном растворе, г. — газ, ж. — жидкость).
Уравнение (12) показывает, что твердый CaCO3 реагирует с двумя гидратированными ионами H + , образуя при этом положительный ион Ca 2+ , CO2 и H2O. Уравнение (12) как и другие полные химические уравнения не дает представления о молекулярном механизме реакции и менее удобно для подсчета количества веществ, однако, оно дает лучшее описание происходящего на микроскопическом уровне.
Закрепите полученные знания о составлении химических уравнений, самостоятельно разобрав пример с решением:
Надеюсь из урока 13 «Составление химических уравнений» вы узнали для себя что-то новое. Если у вас возникли вопросы, пишите их в комментарии.
🎦 Видео
ЭТОТ метод поможет на уроках ХИМИИ / Химия 9 классСкачать

8 класс. Распределение электронов в атоме. Электронные формулы.Скачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Проклятая химическая реакция 😜 #shortsСкачать

ХИМИЯ С НУЛЯ — Как решать задачи по Химии на Массовую ДолюСкачать

8 класс. Составление уравнений химических реакций.Скачать

Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

Как расставлять коэффициенты в уравнениях реакций? #shorts #youtubeshortsСкачать

ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

Условия смещения химического равновесия. 9 класс.Скачать

БЕЗУМНЫЙ лайфхак по Химии — Как определить Тип Химической СвязиСкачать

ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Решение задач на термохимические уравнения. 8 класс.Скачать