Видео:Химия 9 класс (Урок№14 - Азот: свойства и применение. Аммиак. Физические и химические свойства.)Скачать

We are checking your browser. gomolog.ru
Видео:Качественная реакция ионов цинка со щелочью. Получение и свойства гидроксида цинкаСкачать

Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
Видео:ГИДРОКСИД НАТРИЯ | NaOH | Химические свойства ГИДРОКСИДА НАТРИЯ | Качественные реакции | ХимияСкачать

What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 7029d80ebf6c1ec2 • Your IP : 87.119.247.227 • Performance & security by Cloudflare
Видео:Опыты по химии. Получение и исследование амфотерных свойств гидроксида алюминияСкачать

Что общего в свойствах гидроксида натрия и аква раствора аммиака? Напишите
Что общего в свойствах гидроксида натрия и аква раствора аммиака? Напишите уравнения реакций взаимодействия этих веществ с серной кислотой, сульфатом алюминия.
- Stepa Zaharko
- Подготовка к ЕГЭ/ОГЭ 2019-11-06 07:30:59 0 1
И гидроксид натрия, и аква раствор аммиака являются основаниями. Но они различные по силе — гидроксид натрия сильное основание, а аква раствор аммиака слабое.
Видео:Это Самый Простой Урок Химии. Химия с нуля — АмфотерностьСкачать

Что общего в свойствах гидроксида натрия и водного раствора аммиака напишите уравнения
FOR-DLE.ru — Всё для твоего DLE 😉
Привет, я Стас ! Я занимаюсь так называемой «вёрсткой» шаблонов под DataLife Engine.
На своем сайте я выкладываю уникальные, адаптивные, и качественные шаблоны. Все шаблоны проверяются на всех самых популярных браузерх.
Раньше я занимался простой вёрсткой одностраничных, новостных и т.п. шаблонов на HTML, Bootstrap. Однажды увидев сайты на DLE решил склеить пару шаблонов и выложить их в интернет. В итоге эта парочка шаблонов набрала неплохую популярность и хорошие отзывы, и я решил создать отдельный проект.
Кроме шаблонов я так же буду выкладывать полезную информацию для DataLife Engin и «статейки» для веб мастеров. Так же данный проект будет очень полезен для новичков и для тех, кто хочет правильно содержать свой сайт на DataLife Engine. Надеюсь моя работа вам понравится и вы поддержите этот проект. Как легко и удобно следить за обновлениями на сайте?
Достаточно просто зарегистрироваться на сайте, и уведомления о каждой новой публикации будут приходить на вашу электронную почту!
ПРОВЕРЬТЕ СВОИ ЗНАНИЯ
Упражнение 1 Составьте схему образования химической связи в молекуле аммиака.
Упражнение 2 Охарактеризуйте физические и химические свойства аммиака. Свяжите их с областями применения этого соединения.
Физические свойства аммиака.
Аммиак ― бесцветный газ с резким характерным запахом, легче воздуха, хорошо растворяется в воде.
Водный раствор аммиака используется в медицине и в быту под названием аммиачная вода, а 10%-ный раствор аммиака в воде более известен под названием нашатырный спирт. Аммиак используется в качестве хладагента в промышленных холодильных установках, т.к. легко сжижается при повышении давления, а испарение сопровождается поглощением теплоты, в результате чего и происходит охлаждение.
Химические свойства аммиака.
1. Водный раствор аммиака изменяет окраску индикатора, т.к. гидрат аммиака – слабый электролит, он незначительно диссоциирует на катион аммония и гидроксид-анион:
NH3•H2O ⇄ NH4 + + OH —
2. Горит в избытке кислорода, при этом образуется азот и водяные пары:
4HN3 + 3O2 = 2N2 + 6H2O
3. Восстанавливает металлы с их оксидов:
2NH3 + 3CuO = N2 + 3Cu + 3H2O
Схема окислительно-восстановительной реакции.
N -3 H3 + Cu +2 O → N2 0 + Cu 0 + H2O
2N -3 -6ē → N2 0 |6|6|1 ― процесс окисления
Cu +2 +2ē → 2Cu 0 |2| |3 ― процесс восстановления
В приведённой реакции аммиак (за счёт атомов азота в степени окисления -3) — восстановитель.
4. Водный раствор аммиака реагирует с кислотами, образуя соли аммония:
NH3 + HCl = NH4Cl
2NH3 + H2SO4 = (NH4)2SO4
Аммиак ― исходное вещество для солей аммония, которые используют в качестве удобрений (фосфаты, хлорид, нитрат аммония), как компоненты взрывчатых веществ (нитрат аммония или аммиачная селитра), в пищевой промышленности (гидрокарбонат, карбонат, хлорид аммония), при выделке кож и (сульфат аммония).
Упражнение 3 Почему аммиак в окислительно-восстановительных реакциях проявляет свойства восстановителя? В аммиаке атом азота обладает минимальной степенью окисления (-3), поэтому он проявляет только восстановительные свойства.
Упражнение 4 В чём состоит донорно-акцепторный механизм образования ковалентной связи? Подтвердите свои рассуждения рассмотрением строения катиона аммония.
Донорно-акцепторный механизм образования ковалентной связи состоит в том, что связь формируется за счёт неподелённой пары электронов атома-донора и свободной орбитали атома-акцептора.
Например, образование катиона аммония происходит в результате возникновения ковалентной связи между атомом азота, имеющим свободную электронную пару (она называется неподелённой), и катионом водорода, который переходит к аммиаку от молекул кислоты. Первый атом называется донором, а второй ― акцептором. 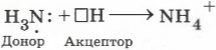
Какой ещё механизм образования ковалентной связи вам известен? Обменный механизм образования ковалентной связи. Например, образование молекулы хлороводорода.
Упражнение 5 Запишите сокращённое ионное уравнение качественной реакции на катион аммония.
NH4 + + OH — = NH3↑ + H2O
ПРИМЕНИТЕ СВОИ ЗНАНИЯ
Упражнение 1 Напишите уравнения реакций получения нитрида натрия и его взаимодействия с водой.
6Na + N2 = 2Na3N
Na3N + 3H2O = 3NaOH + NH3↑
Какая из этих реакций является окислительно-восстановительной?
Реакция получения нитрида натрия, т.к. в ходе химического превращения происходит изменение степени окисления атомов элементов натрия и азота:
6Na + N2 = 2Na3N
Схема окислительно-восстановительной реакции.
Na 0 + N2 0 ⟶ Na3 +1 N -3
Восстановитель Na 0 — 1ē ⟶ Na +1 |1|6|6 ― процесс окисления
Окислитель N2 0 + 6ē ⟶ 2N -3 |6| |1 ― процесс восстановления
Проводим вертикальную черту и пишем за ней число электронов, которые отдали и присоединили атомы натрия и азота. Находим наименьшее общее кратное для чисел 1 и 6 . Это число 6, которое записываем за второй вертикальной чертой посередине, и поделив его поочередно на 1 и 6, записываем результат за третьей чертой в строках, касающихся элементов натрия и азота. Множители 6 и 1 являются искомыми коэффициентами. Поскольку эти элементы изменили степень окисления полностью (в правой части схемы этот элемент ни в одном веществе не проявляет такую же степень окисления, как в исходном веществе) и разными являются индексы этих элементов в формуле исходного вещества и продукта реакции, поэтому ставим коэффициент 6 перед формулой натрия Na и коэффициент 1 (который обычно не пишем) перед формулой азота N2. Подбираем коэффициенты для остальных соединений.
Упражнение 2 С какими из перечисленных веществ реагирует аммиак: водород, азотная кислота, кислород, гидроксид натрия, вода, хлорид калия, оксид меди (II), железо, сульфат аммония? Запишите уравнения соответствующих реакций.
NH3 + HNO3 = NH4NO3
4NH3 + 3O2 = 2N2 + 6H2O
NH3 + H2O ⇄ NH4OH
2NH3 + 3CuO = N2 + 3Cu + 3H2O
Упражнение 3 В двух пробирках без подписи находятся растворы хлорида аммония и хлорида натрия. Какими способами можно распознать эти вещества? Распознать хлорид аммония можно с помощью щелочи NaOH. В пробирке с раствором хлорида аммония выделяющийся аммиак обнаруживают по запаху или посинению влажной красной лакмусовой бумаги. В пробирке с хлоридом натрия никаких изменений не наблюдаем.
Ответ подтвердите уравнениями соответствующих реакций.
NH4Cl + NaOH = NaCl + H2O + NH3↑
NH4 + + Cl — + Na + + OH — = Na + + Cl — + H2O + NH3↑
NH4 + + OH — = H2O + NH3↑
Упражнение 4 В 150 мл воды растворили 67,2 л аммиака (н.у.). Рассчитайте массовую долю аммиака в полученном растворе.
Дано: V(H2O)=150 мл, V(NH3)=67,2 л
Найти: ω(NH3)-?
Решение
1. Вычисляем количество вещества аммиака объёмом 67,2 л по формуле: ʋ =V:VM, где VM=22,4 л/моль при н.у.
ʋ(NH3 )=V( NH3 ):VM=67,2 л : 22,4 л/моль=3 моль
2. Вычисляем массу аммиака в количестве вещества 3 моль по формуле: ʋ=m/M, где M=Mr г/моль.
M ( NH3 )=17 г/моль
m(NH3)= ʋ(NH3) • M(NH3)=3 моль • 17 г/моль=51 г
3. Рассчитываем массу воды:
m(H2O)=V(H2O)•ρ(H2O)=150 мл • 1 г/мл=150 г. Поскольку ρ(Н2О)=1 г/мл, то для воды объём численно равен массе, поэтому данное действие не является обязательным.
4. Рассчитываем массу раствора:
m(раствора)=m(H2O)+m(NH3)=150 г + 51 г = 201 г
5. Вычисляем массовую долю аммиака в полученном растворе:
ω( NH3 )= m ( NH3 ):m(раствора)•100%=51 г : 201 г • 100%=25,4%
Ответ: 25,4%
ВЫРАЗИТЕ МНЕНИЕ
Упражнение 1 Постройте круговые диаграммы, отражающие массовые доли химических элементов в следующих солях: нитрат калия, нитрат аммония, нитрат кальция, сульфат аммония.
Mr(KNO3)=101, Mr(NH4NO3)=80, Mr(Ca(NO3)2)=164, Mr((NH4)2SO4)=132
ω1(N)=Ar(N):Mr(KNO3)=14:101=0,139, или 13,9%
ω2(N)=2•Ar(N):Mr(NH4NO3)=2•14:80=0,35, или 35%
ω3(N)=2•Ar(N):Mr(Ca(NO3)2)=2•14:164=0,171, или 17,1%
ω 4(N)=2•Ar(N):Mr((NH4)2SO4)=2•14:132=0,212, или 21,2%
ω 3(N) ω1(N) ω4(N) ω2(N)
Какую из этих солей вы бы рекомендовали использовать в качестве азотного удобрения? Л учше всего использовать нитрат аммония, т.к. в нем наибольшее содержание азота (35%).
💥 Видео
Амфотерные гидроксиды. Химия ОГЭ 2023 | TutorOnlineСкачать

Опыты по химии. Амфотерность гидроксида цинкаСкачать

Электролитическая диссоциация кислот, оснований и солей. 9 класс.Скачать

Взаимодействие хлорида аммония с гидроксидом натрия | ЕГЭ по химииСкачать

Реакция нейтрализации гидроксида натрия соляной (хлороводородной) кислотойСкачать

Реакция нейтрализации. Урок 26. Химия 7 класс.Скачать

ОСНОВАНИЯ В ХИМИИ — Химические свойства оснований. Реакции оснований с кислотами и солямиСкачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Реакция сульфата меди II ( медный купорос) с гидроксидом натрия ( щелочами)Скачать

50. Химические свойства амфотерных гидроксидовСкачать

ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

Вопрос №7 ЕГЭ | Екатерина Дацук | ХИМИЯ ЕГЭСкачать

Гидролиз солей. 9 класс.Скачать

16. Химические свойства тетрагидроксоалюмината натрия и других соединений алюминияСкачать

Амфотерные свойства гидроксида диксоуранаСкачать

