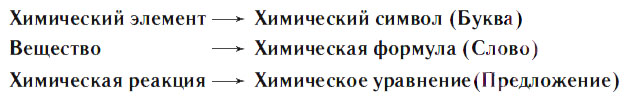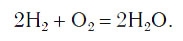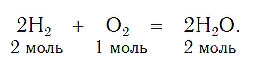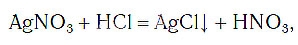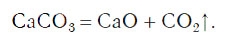Химическая формула необходима для отражения состава вещества с помощью специальных символов и индексов. Формула включает символы химических элементов, уточнить которые всегда можно в таблице Менделеева, и индексы. В последнем случае речь идет о цифре, которая ставится справа снизу после знака элемента и указывает на количество его атомов. При ответственной подготовке к ЕГЭ по химии без умения читать формулы веществ просто не обойтись.
- Химические формулы простых и сложных веществ
- Структурная химическая формула
- Что значит буква q в химии?
- Что означает — буква t над скобкой в химии?
- ХИМИЯ?
- Период в истории химии 7 букв?
- В задаче по химии что значит отфильтровали и прокалили до постоянной массы?
- Что означает в химии буква t над равно?
- Что в химии значит red и ox?
- Ребята, помогите?
- Что обозначает буква в химии u?
- Что значит в химии реагировать?
- Что значить формула в химии N = 2n2?
- Урок 11. Химические уравнения
- Закон сохранения массы веществ
- Химические уравнения
- 🎦 Видео
Видео:Решение задач на термохимические уравнения. 8 класс.Скачать

Химические формулы простых и сложных веществ
Для большинства простых веществ (многие неметаллы и все металлы) формула представляет собой знак соответствующего химического элемента. Так, для вещества медь и химического элемента медь обозначение одинаково — Cu. Если же вещество существует в форме молекул, то к знаку химического элемента справа внизу добавляется индекс, которые указывает на количество атомов в молекуле. В соответствии с этим правилом формула кислорода записывается как O2, хлора — Cl2, фосфора — P4.
Химическая формула простого вещества дает возможность получить следующую информацию:
- Название вещества;
- Относительная атомная масса;
- Молярная масса.
Химическая формула: что это и какую информацию несет
На примере алюминия Al можно сказать следующее:
При записи химических формул сложного вещества указывают знаки всех составляющих химических элементов и индексы, по которым можно определить, сколько элементов конкретного атома входит в молекулу. Если индекс отсутствует, то необходимо иметь в виду, что возле знака находится цифра 1.
Химическая формула: что это и какую информацию несет
В некоторых случаях в уравнении реакции перед формулой может стоять цифра. Речь идет о коэффициенте, отражающем число молекул или молей вещества. Если знак химического элемента стоит не перед, а после коэффициента, то речь идет о количестве атомов данного элемента. Например, 3Cu: количество атомов меди — три, количество моль — тоже три.
Химическая формула сложного вещества дает возможность получить следующую информацию:
- Название вещества;
- Класс веществ, к которым оно относится;
- Относительная молекулярная масса;
- Молярная масса;
- Качественный состав (список образующих вещество химических элементов);
- Количественный состав (количество атомов каждого элемента, количество молей);
- Массовый состав (массовые доли отдельных элементов в веществе, их массы в 1 моле вещества).
Химическая формула: что это и какую информацию несет
Возьмем для примера глюкозу C6H12O6 и разберем ее по представленному выше плану:
- Глюкоза;
- Углеводород;
- Mr(C6H12O6) = 6Ar(C) + 12Ar(H) + 6Ar(O) = 6·12 + 12·1 + 6·16= 72 + 12 + 96 = 180;
- 180 г/моль;
- Углерод, водород, кислород;
- В молекуле глюкозы содержится 6 атомов углерода, 12 атомов водорода и 6 атомов кислорода, в 1 моль глюкозы 6 моль углерода, 12 моль водорода и 6 моль кислорода;
- W(C) = (n(C)·Ar(C))/Mr(C6H12O6) = (6·12)/180= 0,4 (40%)
В 1 моль глюкозы (100 г) содержится 40 г углерода, 7 г водорода и 53 г кислорода.
Химическая формула: что это и какую информацию несет
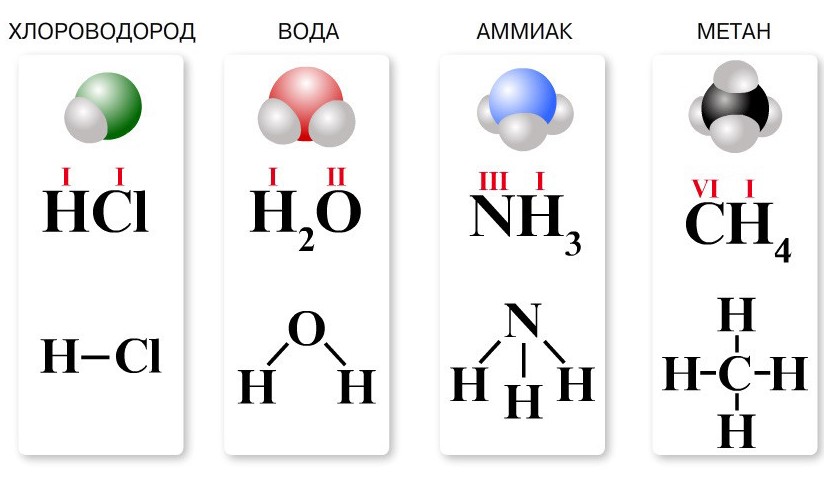
Структурная химическая формула
Под структурной формулой понимается изображение, отражающее в графическом виде структуру молекул, порядок соединения атомов в них, а также валентность элементов. Данная информация может быть представлена в 2D или 3D виде. В первом случае для обозначения общих электронных пар используются штрихи (валентные черточки).
Химическая формула: что это и какую информацию несет
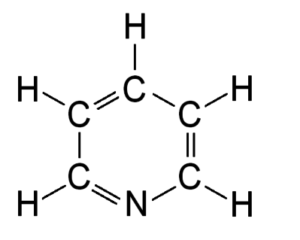
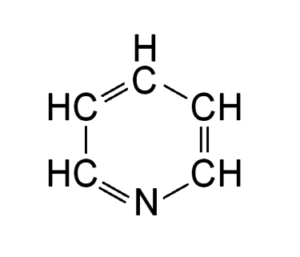
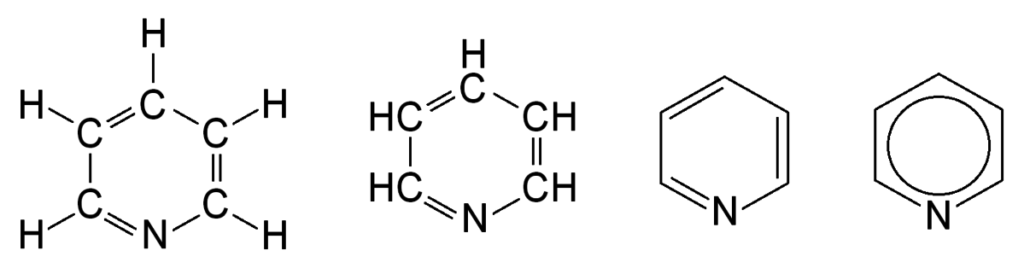
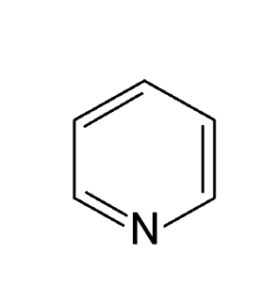
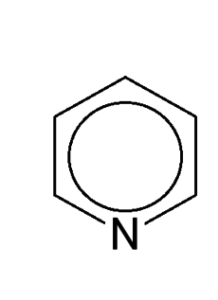
Структурные 2D формулы могут быть представлены в нескольких вариантах (в качестве примера приведен пиридин C5H5N):
- Развернутые. Содержат самую полную информацию, в них представлены все химические элементы и отражены все химические связи;
- Развернутые без указания валентными штрихами связей с атомами водорода;
- Скелетные. Данный вариант является самым кратким — здесь отсутствует информация об атомах водорода, которые связаны с атомами, и о самих связях тоже. Для обозначения атомов углерода и их связей используется ломаная: вершины и концы, которые не контактируют ни с одним из атомов, являются атомами углерода, а звенья между ними — связями.
- Формулы для соединений с бензольным кольцом. Речь идет о шестиугольнике, внутри которого находится окружность. Такая запись свидетельствует о том, что все связи между атомами углерода равноправны.
Порядок составления графических структурных формул первого и второго типов следующий:
- Определяем валентность химических элементов, составляющих вещество;
- Выписываем знаки химических элементов по одному знаку на каждый входящий в вещество атом;
- Соединяем выписанные знаки штрихами. Каждая черта — общая электронная пара, которая связывает химические элементы и в одинаковой степени принадлежит им обоим. Знаки элементов должно окружать такое количество штрихов, которое соответствует их валентности.
Химическая формула: что это и какую информацию несет
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Что значит буква q в химии?
Химия | 5 — 9 классы
Что значит буква q в химии?
Тепловой коэффициент в химической реакции, измеряется в кДж.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Что означает — буква t над скобкой в химии?
Что означает — буква t над скобкой в химии?
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

ХИМИЯ?
Видео:Химические уравнения. Урок 15. Химия 7 классСкачать

Период в истории химии 7 букв?
Период в истории химии 7 букв.
Видео:Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

В задаче по химии что значит отфильтровали и прокалили до постоянной массы?
В задаче по химии что значит отфильтровали и прокалили до постоянной массы?
Как это в реакции с гидроксидом магния будет написано?
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Что означает в химии буква t над равно?
Что означает в химии буква t над равно?
Видео:Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Что в химии значит red и ox?
Что в химии значит red и ox.
Видео:Интенсив "Сокрушительная битва" | Законы сохранения и статика. 9-11 классСкачать

Ребята, помогите?
Что значит ЭО в химии?
Как понять «образуют оксид состава ЭО?
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Что обозначает буква в химии u?
Что обозначает буква в химии u?
Видео:Экзо- и эндотермические реакции. Тепловой эффект химических реакций. 8 класс.Скачать

Что значит в химии реагировать?
Что значит в химии реагировать.
Видео:Химия | Тепловой эффект химической реакции (энтальпия)Скачать

Что значить формула в химии N = 2n2?
Что значить формула в химии N = 2n2.
Перед вами страница с вопросом Что значит буква q в химии?, который относится к категории Химия. Уровень сложности соответствует учебной программе для учащихся 5 — 9 классов. Здесь вы найдете не только правильный ответ, но и сможете ознакомиться с вариантами пользователей, а также обсудить тему и выбрать подходящую версию. Если среди найденных ответов не окажется варианта, полностью раскрывающего тему, воспользуйтесь «умным поиском», который откроет все похожие ответы, или создайте собственный вопрос, нажав кнопку в верхней части страницы.
Zn(OH)2 — записати як кислоту. H2ZnO2 3, 96 г х H2ZnO2 + 2NaOH = Na2ZnO2 + 2H2O 99 143 Складаємо пропорцію : 99 г цинкгідроксиду — 143 г солі 3, 96 х х = 143 х 3, 96 / 99 = 5, 72 г — солі утворилось.
V = m / p v = 28 / 1. 250(p азота) v = 22. 4 л.
M(CH3 — CH2 — CH2 — CH — Cl) = 40 г нью(Cl) = 40 / 35. 5 = 1. 12моль объём(Cl) = 1. 12 * 22. 4 = 25. 088 л m(Cl) = 1. 12 * 40 = 35. 5 г / моль.
1. а)N2(0) + H2(0) = N( — 3)H( + )3N2(0) + 6e = 2N( — 3)|1 окислитель, в — еH2(0) — 2e = 2H( + ) |3 восстановитель, ок — еN2 + 3H2 = 2NH3 б)С ( + 2) — 2ē = > С ( + 4) | 2 | восстановитель, окисление 2О (0) + 4ē = > 2O ( — 2) | 1| окислитель, восстано..
2Al + 3S →Al2S3 1. Mr(Al2S3) = 2 * 27 + 3 * 32 = 150 г / моль n(Al2S3) = m / Mr = 127г / 150г / моль = 0. 847моль 2. N(AL) = 0. 847х2 = 1. 693моль 3. M(AL) = nxMr = 27г / моль х 1. 693моль = 45. 72г Если помог, нажми кнопку Спасибо)).
2H₂O →2H₂ + O₂ (при t) С + O₂ →CO₂↑ CO₂ + H₂O⇄ H₂CO₃ H₂CO₃ + Ca →CaCO₃ + H₂↑ H₂ + O₂→ H₂O.
100 г Х г, Х моль 2Ca + O2 — > 2CaO n = 2 моль n = 1 моль n = 1 моль М = 40 г / моль М = 32 г / моль Vm = 22, 4 л / моль m = 80 г m = 32 г V = 22, 4 л 100 г Са — Х г О2 80 г Са — 32 г О2 m(O2) = 100 * 32 / 80 = 40 г 100 г Са — Хл О2 80 г Са — 22, 4 л..
Сa + O2 = CaO2 xмоль Ca — — — — — — — — — — — 5 моль O2 1 моль Ca — — — — — — — — — 1 моль O2 x = 5 * 1 / 1 = 5моль.
250 : 50 = 5 вот ответ (не умею писать на Укроиннском. ).
Видео:8 класс. Химия. Как расставить коэффициенты в уравнении?Скачать

Урок 11. Химические уравнения
В уроке 11 «Химические уравнения» из курса «Химия для чайников» мы узнаем кем и когда был открыт закон сохранения массы веществ; познакомимся с химическими уравнениями и научимся правильно расставлять в них коэффициенты.
До сих пор при рассмотрении химических реакций мы обращали внимание на их качественную сторону, т. е. на то, как и при каких условиях исходные вещества превращаются в продукты реакций. Но в химических явлениях существует и другая сторона — количественная.
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Химия ПростоСкачать

Закон сохранения массы веществ
Изменяется ли масса веществ, вступивших в химическую реакцию? В поиске ответа на этот вопрос английский ученый Р. Бойль еще в XVII в. провел множество опытов по прокаливанию свинца в запаянных сосудах. После окончания опытов он вскрывал сосуды и взвешивал продукты реакции. В результате Бойль пришел к выводу, что масса вещества после реакции больше массы исходного металла. Он объяснил это присоединением к металлу некой «огненной материи».
Опыты Р. Бойля по прокаливанию металлов повторил русский ученый М. В. Ломоносов в 1748 г. Прокаливание железа он проводил в специальной колбе (реторте) (рис. 56), которая была герметически запаяна. В отличие от Бойля после реакции он оставлял реторту запаянной. Взвешивание реторты после реакции показало, что ее масса не изменилась. Это свидетельствовало о том, что, хотя между металлом и веществом, содержащемся в воздухе, произошла химическая реакция, сумма масс исходных веществ равна массе продукта реакции.

М. В. Ломоносов сделал вывод: «Все перемены, в натуре случающиеся, суть такого состояния, что сколько чего у одного тела отнимется, столько присовокупится к другому, так ежели где убудет несколько материи, то умножится в другом месте».
В 1789 г. французский химик А. Лавуазье доказал, что прокаливание металлов — это процесс их взаимодействия с одной из составных частей воздуха — кислородом. На основе работ М. В. Ломоносова и А. Лавуазье был сформулирован закон сохранения массы веществ в химических реакциях.
Масса веществ, вступивших в химическую реакцию, равна массе веществ, образовавшихся в результате реакции.
При химических реакциях атомы не исчезают бесследно и не возникают из ничего. Их число остается неизменным. А так как они имеют постоянную массу, то и масса образованных ими веществ также остается постоянной.
Закон сохранения массы веществ можно проверить экспериментально. Для этого используют прибор, показанный на рисунке 57, а, б. Главная его часть — двухколенная пробирка. В одно колено нальем известковую воду, во второе — раствор медного купороса. Уравновесим прибор на весах, а затем смешаем оба раствора в одном колене. При этом мы увидим, что выпадает голубой осадок нового вещества. Образование осадка подтверждает, что произошла химическая реакция. Масса прибора при этом остается прежней. Это означает, что в результате химической реакции масса веществ не изменяется.
Закон важен для правильного понимания всего совершающегося в природе: ничто не может исчезнуть бесследно и возникнуть из ничего.
Видео:Задачи на ТЕПЛОВОЙ ЭФФЕКТ | Термохимические уравненияСкачать

Химические уравнения
Химические реакции можно изобразить, используя химический язык формул. Химические элементы обозначают химическими символами, состав веществ записывают при помощи химических формул, химические реакции выражают при помощи химических уравнений, т. е. так же, как из букв составляются слова, из слов — предложения.
Уравнение химической реакции (химическое уравнение) — это условная запись реакции при помощи химических формул и знаков «+» и «=».
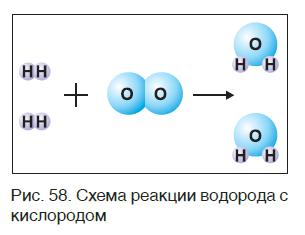
Закон сохранения массы веществ в химических реакциях должен соблюдаться и при составлении уравнений химических реакций. Как и в математических уравнениях, в уравнениях химических реакций имеется левая часть (где записываются формулы исходных веществ) и правая часть (где записываются формулы продуктов реакции). Например (рис. 58):
При написании уравнений химических реакций знак «+» (плюс) соединяет формулы веществ в левой и правой частях уравнения. Так как масса веществ до реакции равна массе образовавшихся веществ, используется знак «=» (равно), который связывает левую и правую части уравнения. Для уравнивания числа атомов в левой и правой частях уравнения используются числа перед формулами веществ. Эти числа называются коэффициентами химических уравнений и показывают число молекул или формульных единиц. Поскольку 1 моль любого вещества состоит из одинакового числа структурных единиц (6,02*10 23 ), то коэффициенты показывают и химические количества каждого из веществ:
При написании химических уравнений применяют также и специальные знаки, например знак «↓», обозначающий, что вещество образует осадок:
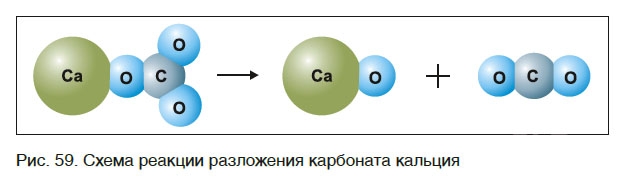
знак «↑», обозначающий, что вещество выделяется в виде газа (рис. 59):
Часто в уравнениях химических реакций над знаком «=» указывают условия их протекания: нагревание (t), облучение светом (hν), электрический ток (↯) и др.
Краткие выводы урока:
- В химических реакциях соблюдается закон сохранения массы веществ: масса исходных веществ равна массе продуктов реакции.
- Сущность химической реакции состоит в перегруппировке атомов, из которых состояли исходные вещества, с образованием новых веществ.
- Число атомов каждого химического элемента до реакции должно быть равно их числу после реакции.
- Химическое уравнение — условная запись реакции при помощи химических формул и специальных знаков.
Надеюсь урок 11 «Химические уравнения» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
🎦 Видео
Расчеты по уравнениям химических реакций. 1 часть. 8 класс.Скачать

ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Расстановка коэффициентов в химических реакциях: как просто это сделатьСкачать

Решение простых уравнений. Что значит решить уравнение? Как проверить решение уравнения?Скачать

Как выучить Химию с нуля за 10 минут? Принцип Ле-ШательеСкачать