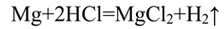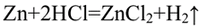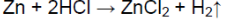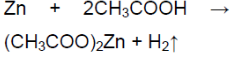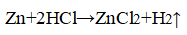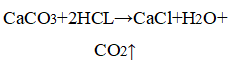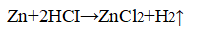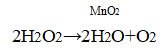В пробирку прилейте 1—2 мл уксусной кислоты и добавьте 1—2 гранулы цинка. Если не наблюдается никаких изменений, пробирку слегка нагрейте на пламени горелки.
1. Что наблюдается при нагревании? Какой газ выделяется? Напишите уравнение реакции.
2. Какие металлы будут реагировать с уксусной кислотой? А какие нет? Сделайте общий вывод об условиях протекания реакций с металлами как органических, так и неорганических кислот.
2CH3COOH + Zn = (CH3COO)2Zn + H2
При взаимодействии цинка с уксусной кислотой образуется соль — ацетат цинка и выделяется газ водород.
2, С уксусной кислотой реагируют металлы, стоящие в ряду активности до водорода, металлы, стоящие в ряду активности после водорода не вытесняют водород из органических и неорганических кислот.
- Please wait.
- We are checking your browser. gomolog.ru
- Why do I have to complete a CAPTCHA?
- What can I do to prevent this in the future?
- Вопросы к параграфу 4 — ГДЗ по Химии 9 класс Учебник Рудзитис, Фельдман
- § 4. Практическая работа №1.
- Изучение влияния условий проведения химической реакции на её скорость
- 1. Влияние природы реагирующих веществ. 1) В три пробирки налейте соляную кислоту. В первую пробирку положите кусочек магния, во вторую — кусочек цинка, в третью — кусочек меди. Что наблюдаете? Какая из реакций протекает быстрее? 2) Налейте в одну пробирку соляной кислоты, в другую — такое же количество уксусной кислоты (концентрация кислот должна быть одинаковой). Опустите в каждую пробирку по две гранулы цинка. Определите, какая реакция протекает быстрее.
- 2. Влияние концентрации реагирующих веществ. В две пробирки поместите по одной грануле цинка. В одну пробирку прилейте 1 мл 30%-ной соляной кислоты, в другую — 1 мл 10%-ной соляной кислоты. Где более интенсивно проходит реакция? Почему?
- 3. Влияние поверхности соприкосновения реагентов. В одну пробирку опустите кусочек мела, в другую насыпьте немного порошка мела. Налейте в пробирки по 1,5 мл соляной кислоты одинаковой концентрации. Есть ли разница в скорости выделения газа?
- 4. Влияние температуры. В две пробирки опустите по одной грануле цинка. Налейте в каждую пробирку по 1 мл соляной кислоты одинаковой концентрации. Одну пробирку опустите в стакан с горячей водой. Сравните интенсивность выделения пузырьков водорода в пробирках и сделайте вывод о влиянии температуры на скорость химической реакции.
- 5. Влияние катализатора. В пробирку налейте 1 мл пероксида водорода и внесите тлеющую лучинку. не прикасаясь к жидкости. Что наблюдаете? Добавьте к пероксиду водорода несколько кристалликов оксида марганца(IV) МnO2, и снова внесите тлеющую лучинку. Что наблюдаете? Какую роль играет МnO2?
- 6. Отчет о работе составьте в произвольной форме и сделайте общий вывод.
- 🔥 Видео
Видео:ЛУЧШАЯ стратегия использования Таблицы Растворимости (химия с нуля)Скачать

Please wait.
Видео:Реакции металлов с кислородом и водой. 8 класс.Скачать

We are checking your browser. gomolog.ru
Видео:Как понять что вещество выпадает в осадок или образуется газСкачать

Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 700f69c9bdd4973f • Your IP : 87.119.247.227 • Performance & security by Cloudflare
Видео:Физика - Газовые законы. Уравнение идеального газа.Скачать

Вопросы к параграфу 4 — ГДЗ по Химии 9 класс Учебник Рудзитис, Фельдман
Авторы: Рудзитис Г.Е., Фельдман Ф.Г.
Видео:Решение задач на термохимические уравнения. 8 класс.Скачать

§ 4. Практическая работа №1.
Изучение влияния условий проведения химической реакции на её скорость
1. Влияние природы реагирующих веществ. 1) В три пробирки налейте соляную кислоту. В первую пробирку положите кусочек магния, во вторую — кусочек цинка, в третью — кусочек меди. Что наблюдаете? Какая из реакций протекает быстрее? 2) Налейте в одну пробирку соляной кислоты, в другую — такое же количество уксусной кислоты (концентрация кислот должна быть одинаковой). Опустите в каждую пробирку по две гранулы цинка. Определите, какая реакция протекает быстрее.
Уравнение химической реакции
Интенсивное выделение газа
Скорость химической реакции между металлом и кислотой увеличивается, когда применяют более активный металл.
Образование пузырьков газа
Ничего не происходит
Уравнение химической реакции
Скорость химической реакции между цинком и кислотой увеличивается, когда применяют более сильную кислоту.
Образование пузырьков газа
2. Влияние концентрации реагирующих веществ. В две пробирки поместите по одной грануле цинка. В одну пробирку прилейте 1 мл 30%-ной соляной кислоты, в другую — 1 мл 10%-ной соляной кислоты. Где более интенсивно проходит реакция? Почему?
Уравнение химической реакции
Скорость реакции тем выше, чем выше концентрация кислоты.
Образование пузырьков газа
3. Влияние поверхности соприкосновения реагентов. В одну пробирку опустите кусочек мела, в другую насыпьте немного порошка мела. Налейте в пробирки по 1,5 мл соляной кислоты одинаковой концентрации. Есть ли разница в скорости выделения газа?
Уравнение химической реакции
Образование пузырьков газа
Если вещество находится в измельчённом виде, газ выделяется интенсивнее, так как увеличивается площадь поверхности соприкосновения веществ.
4. Влияние температуры. В две пробирки опустите по одной грануле цинка. Налейте в каждую пробирку по 1 мл соляной кислоты одинаковой концентрации. Одну пробирку опустите в стакан с горячей водой. Сравните интенсивность выделения пузырьков водорода в пробирках и сделайте вывод о влиянии температуры на скорость химической реакции.
Уравнение химической реакции
При возрастании температуры среды (при нагревании пробирки с помощью горячей воды) реакция идёт интенсивнее.
Образование пузырьков газа
5. Влияние катализатора. В пробирку налейте 1 мл пероксида водорода и внесите тлеющую лучинку. не прикасаясь к жидкости. Что наблюдаете? Добавьте к пероксиду водорода несколько кристалликов оксида марганца(IV) МnO2, и снова внесите тлеющую лучинку. Что наблюдаете? Какую роль играет МnO2?
Уравнение химической реакции
Изменений не наблюдается
При помещении тлеющей лучинки в пробирку с перекисью водорода изменений не наблюдается, потому что кислорода слишком мало. В присутствии MnO2 в качестве катализатора, разложение перекиси водорода ускоряется, кислород выделяется быстрее, лучинка загорается.
Тлеющая лучинка вспыхивает
6. Отчет о работе составьте в произвольной форме и сделайте общий вывод.
На скорость взаимодействия веществ влияют такие факторы, как: природа химических веществ, их концентрация, площадь поверхности контакта, температура и наличие/отсутствие катализатора. Скорость химической реакции увеличивают такие факторы, как: высокая активность взаимодействующих веществ, их высокая концентрация, большая площадь соприкосновения, высокая температура и присутствие катализатора.
🔥 Видео
РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Хлор – жёлтый газ (часть 1). Химия – ПростоСкачать

Плавление и кристаллизация твердых тел, температура плавления, удельная теплота плавления. 8 класс.Скачать

Электролиз. 10 класс.Скачать

Как выучить Химию с нуля за 10 минут? Принцип Ле-ШательеСкачать

Взаимодействие металлов с кислотами. 8 класс.Скачать

Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

9 класс. Реакции ионного обмена. Ионные уравнения.Скачать

Горение топлива и выделение энергии. 8 класс.Скачать

СЕРНАЯ КИСЛОТА разбавленная и концентрированная - в чем отличия? | Химия ОГЭСкачать

ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать

ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Горение. 7 класс.Скачать