Гипотеза де Бройля позволила по-новому описывать поведение микрочастиц. Для описания движения электрона в поле ядра стало возможным применение уже известной волновой теории. В классической электродинамике стационарное волновое уравнение имеет вид:
где Ф — волновая функция; к — волновой вектор.
Решение волнового уравнения (10.2) хорошо известно и является стоячей волной. В одномерном случае Ф = Л sinbr.
В атомной физике чаще всего оперируют энергией тех или иных частиц, поэтому для описания состояний атомов с помощью волнового уравнения (10.2) следует перейти к энергии. Из соотношения де Бройля следует:
где Т, V, Е — кинетическая, потенциальная и полная энергии соответственно.
После подстановки X 2 в уравнение (10.2), использования соотношения (10.1) и несложных преобразований волновое уравнение примет вид:
где V = —-у + —т + тт; v — оператор Гамильтона; / — волновая дх ду dz
Уравнение (10.3) было предложено Э. Шредингером и в квантовой физике называется его именем. Оператор потенциальной энергии V включает в себя все взаимодействия электрона с ядром и с другими электронами. В общем виде получить точное решение уравнения (10.3) для любого атома невозможно. Аналитическое решение было получено лишь для одноэлектронного атома (атома, содержащего только один электрон). В простом случае атома водорода оператор потенциальной энергии Vимеет вид: V = —е 2 /г.
При решении уравнения (10.3) для атома водорода удобно воспользоваться сферической симметрией атома. В этом случае в уравнении Шредингера целесообразно перейти к сферическим координатам г, 0, (р, в которых упрощается получение решения и его графическое представление. В результате преобразования уравнение Шредингера можно разделить на три независимых уравнения, каждое из которых описывает зависимость |/ от сферических координат г, 0, ср, и решить их по отдельности. Окончательное решение представляется в виде произведения трех волновых функций, зависящих только от соответствующих координат: ц/(г, 0, ф) = R(r) • 0(0) • Ф(ф).
После ряда преобразований уравнение Шредингера (для атома водорода) в сферических координатах примет вид:
В этом уравнении каждое слагаемое выражает зависимость каждой функции от соответствующей переменной. Решение для каждой функции приводит к введению квантовых чисел п, /, mt. Главное квантовое число п получается из решения для радиальной составляющей R(r), орбитальное / и магнитное т/ квантовые числа — из решений для 0(0) и Ф(ф) соответственно.
Решением уравнения Шредингера являются собственные волновые функции |которые в случае одноэлектронного атома называются атомными орбиталями и однозначно определяются квантовыми числами п, /, /И/. Атомные орбитали описывают форму, размеры и распределение электронной плотности, соответствующей данному состоянию с данными значениями квантовых чисел.
Волновая функция |/ является комплексной величиной и сама не имеет физического смысла. Физическим смыслом обладает величина ||/| 2 — вероятность обнаружения электрона в данной точке пространства; |ц/| 2 dV — вероятность нахождения электрона в элементарном объеме dV. Для атома водорода максимум функции |)/| 2 dVнаходится в области первой орбиты (-0,529 А).
Каждой волновой функции (атомной орбитали) соответствует определенное значение энергии Е электрона в атоме, которая определяется типом его движения, т.е. значениями квантовых чисел п, /,
Ш/. В соответствии с этими величинами в квантовой механике есть обозначения и номенклатура атомных орбиталей:
- • главное квантовое число п записывается в виде цифры, которая соответствует номеру оболочки — п = 1, 2, 3,
- • для каждого главного квантового числа орбитальное число I принимает значения от 0 до п — 1, соответствующие орбитали (подоболочки) обозначаются буквами латинского алфавита:
• магнитное квантовое число т, принимает значения от —/ до +/, обозначает ориентировку атомной орбитали и указывается в виде правого нижнего индекса, например, Ь0, 2ри 3d2 и т.д. Радиальная часть волновой функции зависит только от квантовых чисел п и /, но не зависит от mh т.е. все функции одной оболочки (например, 3ри 3р0, Ър_) будут иметь схожее радиальное распределение электронной плотности (табл. 10.1). Радиальная функция изображается в виде графиков /?(/*), R 2 (r) (имеет значение вероятности обнаружения электрона в данной точке пространства) или R 2 4nr 2 dr (функции радиального распределения электронной плотности).
Радиальная часть волновых функций
 |  |  |
 |  |  |
 |  |  |
 |  |  |
 |  |  |
 |  |  |
 |  |  |
N — нормировочный коэффициент.
Угловая часть волновой функции 0(0) • Ф(ф) зависит только от квантовых чисел / и mh но не зависит от главного квантового числа п (табл. 10.2 и 10.3). Это означает, что все s-, р-, d-, /-орбитали будут иметь одинаковую форму, независимо от величины п (рис. ЮЛс^Л). Магнитное квантовое число т/ определяет ориентировку орбиталей. Угловая функция изображается в виде граничных поверхностей, охватывающих около 95% электронной плотности.
Значения комплексной и реальной составляющих функции Фт,










 |  |  |
 | ||
 | ||
 | ||
 | ||
 | ||
 |
Рис. 10.1. Угловое распределение электронной плотности и направление векторов механического момента электронов для s-, р-, d- и ^-состояний ([10], с. 202)
Большинство волновых функций являются комплексными, поэтому представить их графически невозможно. В комплексном виде они находят применение, например, при рассмотрении магнитных свойств. На практике чаще всего используются действительные волновые функции, обозначаемые рх, dxy и т.д., из которых с помощью линейных комбинаций волновых функций исключена комплексная часть и которые дают реальные изображения атомных орбиталей (табл. 10.4). Новые волновые функции привязаны к декартовой системе координат и имеют в ней определенную ориентировку (рис. 10.2). Каждая электронная оболочка характеризуется своим набором атомных орбиталей (табл. 10.5).
Атомные орбитали характеризуются некоторыми общими особенностями:
• s-орбитали обладают отличными от р-, d-, /-орбиталей особенностями. Во-первых, у 5-орбиталей отсутствует угловая зависимость, граничная поверхность имеет форму сферы, а волновая функция не зависит от углов 0 и ф и определяется только радиусом г (см. табл. 10.1). Во-вторых, электронная плотность в точке г = 0, т.е. на ядре, не равна нулю, что является свойством только 5-электронов, тогда как р-, d-, /-электроны не контактируют с ядром.
Рис. 10.2. Формы s-, р-, d-орбиталей
Вследствие того, что 5-электроны пронизывают ядро, возникает сверхтонкая структура спектров электронного парамагнитного резонанса, а также проявляется воздействие электронной оболочки на ядерные переходы в мессбауэровских спектрах, спектрах ядерного магнитного резонанса и др. Это относится не только к Is-, но и к 2s-, 35- и вообще «5-электронам. Таким образом, электронная оболочка атома взаимодействует с ядром через свои 5-электроны.







































Квантовые числа и атомные орбитали различных электронных оболочек атомов
Обозначение линейной комбинации атомных орбиталей




















На рис. 10.3 для 5-орбиталей показана зависимость радиальной части волновой функции Rnh электронной плотности R„i и функции радиального распределения электронной плотности Rnl4nr от радиуса г. Следует обратить внимание на то, что на рис. 10.3 граничная поверхность, охватывающая около 95% объема зарядового облака для Л15-орбитали атома водорода, имеет радиус порядка 2 А, тогда как максимальная плотность вероятности Rs^nr 2 соответствует rmax = 0,528 А, т.е. радиусу первой круговой боровской орбиты. В отличие от боровских орбит, согласно представлению о которых электрон может находиться только на этих орбитах с запрещенными промежутками между ними, в атомных орбиталях электронная плотность не равна нулю и на ядре (для 5-состояний), причем простирается она значительно далее rmax;
• р-орбитали — орбитали с / = 1, они могут существовать, начиная со значения главного квантового числа п = 2 (см. табл. 10.5). Их радиальная часть представлена на рис. 10.4.
Рис. 10.3. Зависимость радиальной части волновой функции электронной плотности Rni и функции радиального распределения электронной плотности R„i 4лт 2 от радиуса г для s-орбиталей ([45], с. 34)
Форма /?-орбиталей изображается либо с помощью волновой функции |fnlmi (или ее угловой части У,щ = 0//Я/(0)• Фщ (ф)) в виде двух соприкасающихся сфер с различными знаками (рис. 10.5), либо с помощью |//Ш/1 = |0/Ш/1 • ФОТ/1 в виде поверхностей с отличной от шаровой формой, а поскольку она представляет собой квадрат волновой функции, то без указания знака. Однако на практике не только р-, но и s- и ^-орбитали
нередко изображают в виде |v|/|
, при этом одновременно указывают знаки «+» и «—», подразумевая, что этот знак связан с самой волновой функцией;
Рис. 10.4. Зависимость радиальной части волновой функции /?п/, электронной плотности Rni и функции радиального распределения электронной плотности /? 2 ,4лг 2 от радиуса г для р-орбиталей ([47], с. 35)
Рис. 10.5. Изображение формы р-орбиталей в виде ур или у 2
• d-орбитали (угловая часть показана на рис. 10.2, радиальная — на рис. 10.6) характеризуются орбитальным квантовым числом / = 2 и могут существовать, начиная со значений главного квантового числа п = 3 (см. табл. 10.5). Можно заметить, что четыре ^-орбитали имеют одинаковую форму (см. рис. 10.2), но по-разному ориентированы относительно осей координат, и лишь форма dj -орбитали (или в полном ее обозначении
d^p_p —орбитали) отличается от них;
Рис. 10.6. Зависимость радиальной части волновой функции электронной плотности R„i и функции радиального распределения электронной плотности R„i 4кг 2 от радиуса г для Зс/-орбиталей ([47], с. 35)
• f-орбитали (/ = 3) возникают при значениях главного квантового числа я = 4и существуют в виде семи типов с mt = 3, 2, 1, 0, —1, —2, —3, которые записываются обычно с помощью линейных комбинаций (см. табл. 10.5).
На рис. 10.7 представлено распределение электронной плотности для различных орбиталей, получающихся в результате решения уравнения Шредингера. При решении уравнения (10.3) не учитывался спин электрона, поскольку спин — релятивистское свойство электрона, связанное с эффектами, рассматриваемыми теорией относительности. Уравнение Шредингера (10.3) не учитывает требований теории относительности. Но помимо шредин- геровской (нерелятивистской) квантовой механики существует релятивистская квантовая механика, развитая П. Дираком и сочетающая квантовую теорию с теорией относительности. Дирак предложил волновое уравнение, удовлетворяющее требованиям теории относительности. Вместо волновой функции |/ИЙЯ/, входящей в уравнение Шредингера, в уравнение Дирака входит более абстрактная функция, зависящая не от трех, а от четырех переменных в каждой точке пространства. Спиновое квантовое число s получается в результате решения уравнения Дирака так же, как квантовые числа п, I, т/ получились при решении уравнения Шредингера.
Рис. 10.7. Силуэты, графически изображающие распределения зарядов, которые должны осуществляться в электронном облаке по теории Шредингера ([12], фото 16)
Наличие у электрона спина привело к возникновению нового типа взаимодействия в атоме — спин-орбитального, которое также необходимо учитывать.
Сначала уравнение Шредингера решается без учета спина, затем спин учитывается в виде спин-орбитального взаимодействия, рассматриваемого как возмущение. Для этого к оператору гамильтони-
ана Н =—V“ + C(r) добавляется член, описывающий спин-ор-
битальное взаимодействие: Нсо = fys, где ?, — константа спин-орбитального взаимодействия. После чего оператор гамильтониана записывается в виде:
Спин 5-электрона равен 1 /2, магнитное спиновое число ms может принимать значения ±1/2 в зависимости от ориентации спина 5 относительно некоторого внешнего поля.
- Что характеризуют радиальная и угловая части волновой функции в уравнении шредингера
- 16.1 Приведённая масса
- 16.2. Новые параметры
- 16.3. Разделение сферических переменных
- 16.4. Свойства движения в кулоновском поле
- 16.5. Эффективный потенциал
- 16.6. Вычисление радиальной части волновой функции
- Особые точки
- Разложение в ряд
- Только конечная сумма даёт ограниченное решение
- Условие квантования энергии
- Нормированная волновая функция
- 16.7 Статистический вес энергетического уровня
- Что характеризуют радиальная и угловая части волновой функции в уравнении шредингера
- 4.1. Уравнение Шредингера
- Уравнение Шредингера
- 4.2. Частица в одномерной прямоугольной яме с бесконечными стенками
- 4.3. Гармонический осциллятор
- Частица в одномерной потенциальной яме
- 4.4. Частица в поле с центральной симметрией
- 4.5. Орбитальный момент количества движения
- 4.6. Спин
- 4.7. Полный момент количества движения
- 4.8. Квантовые числа
- Таблица квантовых чисел
- Задачи
- 🔥 Видео
Видео:Урок 455. Уравнение ШрёдингераСкачать

Что характеризуют радиальная и угловая части волновой функции в уравнении шредингера
В этой главе излагается решение уравнения Шредингера в рамках задачи Кеплера. Мы убедимся, что без учёта релятивистских эффектов положение энергетических уровней получается таким же, как и в теории Бора–Зоммерфельда, но определяемая волновой функцией форма орбиталей в квантовой теории отличается от классических траекторий. В случае кулоновского поля существуют аналитические выражения для волновых функций, что позволяет вычислить средние значения физических параметров и, например, получить представление о размерах атома в различных состояниях.
Анализ задачи с позиций квантовой механики позволяет выяснить природу основного состояния любого атома, понять причину сгущения уровней вблизи границы ионизации, а также дать ответ на вопрос о вырождении энергетических уровней. Квантовые числа углового момента, которые определяют структуру волновой функции, необходимы при классификации спектров сложных атомов, для которых аналитическое решение уравнения Шредингера невозможно.
Проблема атома водорода и, в особенности, водородоподобных ионов с большим зарядом ядра, требует учёта релятивистских эффектов. Один из них — зависимость массы электрона от скорости — в главе 13 рассмотрен в классическом приближении. Мы увидели, что при переходе к тяжёлым атомам этот эффект растёт быстро, пропорционально Z 4 , но, тем не менее, остаётся малым вплоть до элементов группы железа. Аналогичными свойствами обладает спин–орбитальное взаимодействие. Его роль заключается в снятии вырождения уровней, характерного для нерелятивистской модели атома. Задача о кулоновском поле имеет аналитическое решение и в релятивистском случае. Но для атомов вплоть до элементов группы железа оба упомянутых эффекта малы по сравнению с электростатическим взаимодействием и могут быть рассмотрены как малые поправки к полученным в этой главе формулам.
Видео:Волновая функция (видео 5) | Квантовая физика | ФизикаСкачать
16.1 Приведённая масса
Рассмотрим взаимодействие двух заряженных частиц по закону Кулона. С потенциальной энергией (13.3.3) стационарное уравнение Шредингера для волновой функции системы ψSYS имеет вид

Здесь re и rZ —радиус–векторы, соответственно, электрона и ядра, Etot — полная энергия системы. Введём положение центра инерции частиц

и электрона относительно ядра

Две последние формулы соответствуют определениям (13.2.3) и (13.2.4) классической механики. Выполним замену переменных в операторах дифференцирования в левой части (1.1):
Подставив (1.4) в (1.1), приходим к уравнению

Оно допускает разделение переменных. Представим волновую функцию в виде произведения

где первый множитель не зависит от R, а второй — от r. Разделим (1.5) на ψSYS и второе слагаемое слева перенесём в правую часть:

Левая и правая части последнего уравнения зависят от разных переменных, поэтому каждая из них должна быть равна константе. Полная энергия Etot системы складывается из её внутренней энергии E и энергии Emc движения центра масс электрона и ядра:

описывает равномерное прямолинейное движение центра масс, а уравнение
есть искомое уравнение Шредингера для относительного движения. Как и в классической механике, задача сводится к движению вокруг ядра частицы, занимающей место электрона, но масса её равна приведённой массе системы (13.2.6).
Видео:Л. 4. Уравнение Шредингера в произвольном базисе. Волновая функция.Скачать

16.2. Новые параметры
В связанном состоянии энергия частицы E, как известно, отрицательна. Вместо неё будем пользоваться «дебройлевским» волновым числом:

Введём масштаб длины

Напомним, что a0 — боровский радиус (1.2.7). В этих обозначениях уравнение (1.9) приобретает следующий вид:

Удобно перейти к сферическим координатам, в которых оператор Лапласа равен сумме

называются, соответственно, «радиальным» и «угловым» лапласианом. Напомним, что угловой лапласиан, согласно (12.5.1), с точностью до знака равен оператору квадрата момента количества движения l 2 . Перейдём к решению задачи.
Видео:Консультация по квантовой механике. Часть 5. "Волновая функция. Уравнение Шредингера"Скачать

16.3. Разделение сферических переменных
Покажем, что в сферических координатах задача допускает дальнейшее разделение переменных. Волновую функцию ищем в виде произведения

Подставим (3.1) в (2.3), разделим полученное уравнение на ψ(r) и перенесём в правую часть слагаемое с оператором, действующим на угловые переменные:

Слева и справа от знака равенства стоят функции от разных аргументов. Следовательно, обе они равны одной и той же константе:
Уравнение (3.3) совпадает с (12.5.3) и, таким образом, представляет собой задачу на собственные значения квадрата момента. Согласно (12.5.5) и (12.6.2), она имеет ограниченное и однозначное решение
Подставляя это значение λ в (3.2), получим обыкновенное дифференциальное уравнение для радиальной части волновой функции:

Прежде, чем приступить к его решению, проведём качественные исследования некоторых свойств радиального движения.
Видео:Урок 454. Понятие о волновой функцииСкачать

16.4. Свойства движения в кулоновском поле
Наличие основного состояния и сгущение уровней вблизи границы ионизации — оба этих свойства кулоновского поля являются следствием соотношения неопределённостей.
Рассмотрим волновую функцию электрона, локализованного внутри малой сферы радиуса r0. Неопределённость в значениях его координат приблизительно равна r0, неопределённость в значении импульса, соответственно, порядка ħ/r 0 , а среднее значение кинетической энергии T составляет ħ 2 /mr 0 2 . Полная энергия, равная сумме

не может неограниченно убывать по мере уменьшения r0. Следовательно, дискретный спектр начинается с некоторого отрицательного конечного значения. Иными словами, в кулоновском поле имеется основное состояние.
Этот результат отличается от движения в потенциальной яме бесконечной глубины, где отрицательная энергия дискретных уровней неограниченно растёт по абсолютной величине. Различие обусловлено степенью крутизны потенциальной функции. Если в (4.1) вместо кулоновского потенциала подставить, например
с достаточно большим показателем степени:
то энергия E при уменьшении r0 становится отрицательной, неограниченно увеличиваясь по абсолютной величине. Но если средняя энергия может принимать такие значения, то это означает, что существуют сколь угодно глубокие уровни. Потенциальная яма имеет стенки, более крутые, чем любаястепеннáя функция, следовательно, её уровни энергии действительно не должны иметь нижней границы.
Ещё раз обратим внимание на то, что существование основного состояния атома является чисто квантовым явлением. В классической механике при равном нулю моменте обязательно имеет место падение электрона на ядро.
Теперь исследуем характер энергетического спектра электрона, находящегося на больших расстояниях от ядра. Рассмотрим волновой пакет, «заполняющий» шаровой слой большого радиуса r0 и толщины Δr r0. Тогда порядок величины кинетической энергии будет ħ 2 / m( Δr ) 2 . Теперь увеличиваем r 0 и, пропорционально ему, Δr 0 . Для электрона в кулоновском потенциале при достаточно больших значениях r 0 сумма
(4.2)
станет отрицательной. Таким образом, существуют стационарные состояния с отрицательной энергией, в которых частица может находиться на больших расстояниях от ядра. Но это означает, что существуют сколь угодно малые по абсолютной величине уровни энергии. Иными словами, дискретный спектр содержит бесконечно много уровней, сгущающихся к границе ионизации. Снова мы видим кардинальное отличие от решения задачи о потенциальной яме. Причина та же: большая крутизна потенциальной функции. Из (4.2) легко убедиться, что в случае α>2 никакого сгущения уровней ожидать не приходится.
По сути дела, мы убедились, что у каждой атомной системы есть основное состояние с конечным значением энергии, и её уровни сгущаются по мере приближения к границе ионизации. Оба эти заключения следуют из того, что потенциальная функция любого иона и атома близка к закону Кулона как вблизи ядра, так и на очень больших расстояниях от него. Вблизи ядра можно пренебречь влиянием электронов, и потенциальную энергию (отрицательную) описывает формула Ze 2 / r. Вдали от него справедлива изложенная в разделе 13.8 модель атомного остатка. Потенциальная энергия оптического электрона в этой модели также описывается законом Кулона и пропорциональна отношению (Z–N+1)e 2 / r, где N — число электронов в ионе или атоме.
Видео:Лекция №4 "Волновая функция. Уравнение Шредингера" (Гавриков А.В.)Скачать

16.5. Эффективный потенциал
Покажем, что решение радиальной части (3.4) волнового уравнения не имеет вырождения. На время вернёмся к обозначениям первого раздела. Вынесем за скобки множитель 2m / ħ 2 и с учётом (2.1) и (2.2) получим:
(5.1) приводится к виду

Последнее уравнение описывает одномерное движение в поле с потенциальной энергией

На первом месте здесь стоит потенциальная энергия электрона. Числитель второго слагаемого равен собственному значению квадрата момента. В связи с этим величину
в квантовой теории, как и в классической механике, принято называть «центробежным потенциалом», а сумму (5.4) — «эффективным потенциалом». Профиль эффективного потенциала схематически изображён на рис.16.5.1.
На больших расстояниях от ядра превалирует кулоновский потенциал, а на малых — центробежный. Поэтому эффективный потенциал имеет минимум. Его зависимость от r напоминает яму конечной глубины, но в отличие от ямы здесь пологие края.
Уравнение (5.3) показывает, что задача о радиальном движении в кулоновском поле сводится к задаче об одномерном движении в области, ограниченной с одной стороны. Как показано во втором разделе девятой главы, ограниченное одномерное движение является невырожденным. Отсюда следует заключение об отсутствии вырождения по радиальной координате и в случае кулоновского поля. Таким образом, вырождение волновой функции кулоновского поля обусловлено исключительно её угловой частью.
Перейдём к определению энергетических уровней, поставив условие ограниченности волновой функции.
Видео:Квантовая механика 41 - Уравнение Шредингера. Гамильтониан.Скачать

16.6. Вычисление радиальной части волновой функции
Раскроем радиальную часть лапласиана Δr:

Подставив полученное выражение в (3.4), приходим к уравнению

Его, как и уравнение, описывающее линейный осциллятор, решаем методом разложения в ряд с предварительным выделением особых точек.
Особые точки
В рассматриваемой здесь задаче присутствуют две особые точки: бесконечно удалённая точка r→∞ и начало координат r=0 . Введём обозначения R∞ для волновой функции на больших расстояниях от ядра и R0 — вблизи него. Для выяснения зависимости R∞(r) опустим в (6.1) все слагаемые, содержащие в знаменателе r. Получающееся в результате уравнение

Из условия ограниченности волновой функции вытекает требование
и окончательно приходим к результату

Поведение волновой функции вблизи ядра определяется как раз теми слагаемыми, которые мы опустили при поиске R∞. Предположим, что орбитальный момент отличен от нуля: l>0 . Тогда в квадратных скобках (6.1) можно пренебречь первым и вторым членами по сравнению с центробежным потенциалом:

Решение последнего уравнения ищем в виде степеннóй функции

для которой надо найти значение показателя степени μ. После подстановки (6.4) в (6.3) приходим к квадратному уравнению для μ:

два корня которого равны:

Таким образом, решением уравнения (6.3) является линейная комбинация

Из требования ограниченности волновой функции следует


В случае l=0 уравнение (6.3) имеет решение
что формально не противоречит (6.5).
Итак, формулы (6.2) и (6.5) описывают поведение волновой функции, соответственно, в бесконечно удалённой точке и вблизи начала координат.
Разложение в ряд
Решение для произвольного диапазона радиальной координаты будем искать в виде

причём константы C 01 и C∞ 1 из (6.5) и (6.2) включены в искомую функцию f(r). Её мы представляем в виде ряда

Запишем выражение для радиальной функции:

Исключим из исходного уравнения (6.1) слагаемое с первой производной. Для этого выполним замену переменной:

Функция P(r) может быть разложена в ряд аналогично (6.8):
Оператор Лапласа, применённый к функции P(r), содержит только вторую производную:

Теперь перепишем уравнение (6.1) в виде:

Подставим в него P(r) из (6.10a) и получим уравнение для функции F(r):

Дважды дифференцируя ряд (6.10b): (6.10),
и подставляя его в (6.13), получим бесконечную систему уравнений для коэффициентов разложения:
Увеличим на единицу индекс суммирования в первом и последнем членах суммы, после чего вынесем за скобки общий множитель r ν+l :

Поскольку последнее равенство выполняется при произвольных значениях переменной r, коэффициенты при всех степенях r ν+l должны быть равны нулю. Отсюда следует рекуррентное соотношение:

Задав значение A 0 , мы можем вычислить коэффициент разложения с любым номером.
Только конечная сумма даёт ограниченное решение
Покажем, что, как и в случае линейного осциллятора (глава 11), условию ограниченности волновой функции R(r)удовлетворяет только конечная сумма, но не бесконечный ряд. Для этого достаточно убедиться, что такой ряд растёт быстрее, чем e kr . В самом деле, при неограниченном возрастании номера ν отношение коэффициентов ряда (6.16) стремится к пределу

А в разложении экспоненты:
отношение коэффициентов равно

Сравнение (6.17) и (6.18) показывает, что в случае бесконечного ряда волновая функция R(r) не стремится к нулю при неограниченном удалении от ядра. Физический смысл имеет только решение уравнения (6.13) в виде конечной суммы.
Условие квантования энергии
В конечной сумме существует номер ν=nr такой, что
Параметр nr называется радиальным квантовым числом. Он аналогичен введённой в предыдущей главе величине nr и, как мы увидим ниже, принимает тот же ряд значений (15.1.23). Согласно (6.16) и (6.19), решение существует только в том случае, если k удовлетворяет условию
Таким образом, волновое число электрона квантуется: оно определяется линейной комбинацией
называемой главным квантовым числом. Снова прослеживается аналогия с классической моделью атома: (6.20) получается из (15.1.11) заменой nφ на l+1. Эта замена обусловлена принципиально разной интерпретацией состояний с равным нулю моментом в квантовой теории и классической механике. Выпишем в явной форме правило квантования волнового числа:

Из соотношений (2.1) и (6.21) получим условие квантования энергии:
или, вспоминая определение ридберга (13.5.3):
Эта формула даёт собственные значения нашей задачи. Собственные функции (волновые функции) зависят от трёх координат (r, θ, φ) и трёх параметров (n, l, m):
где Ylm — угловая часть волновой функции, Rnl — радиальный множитель, равный

Коэффициенты суммы связаны друг с другом рекурренным соотношением

Сумма в (6.24) является знакопеременной. В этом легко убедиться, заметив, что числитель дроби (6.25) имеет отрицательный знак.
К радиальной волновой функции применима осцилляционная теорема, о которой шла речь в разделе 9.3. Число узлов функции Rnl равно квантовому числу nr.
Уточним диапазон изменения квантовых чисел n, nr и l. Согласно (12.1), параметр l должен быть неотрицательным. Нумерация слагаемых под знаком суммы в (6.24) начинается с нуля, поэтому nr принимает целые значения:
Энергетический уровень однозначно определяется главным квантовым числом n. Из (6.20) следует, что при заданном значении n орбитальное квантовое число может быть равно одному из чисел ряда:
Если в (6.20) равны нулю оба параметра: 
Обратим внимание на то, что орбитальное квантовое число выпало из окончательного результата (6.22), хотя в уравнении Шредингера (6.1) оно присутствует. Этот факт является следствием особо высокой степени симметрии кулоновского поля — более высокой, чем просто поле с центральной симметрией. В общем случае центрально-симметричного поля, потенциал которого падает по закону, отличному от 1/r, энергия зависит от квантового числаl.
Нормированная волновая функция
Разложение (6.23) волновой функции на множители, каждый из которых зависит либо от радиальной, либо от угловых координат, позволяет разбить общее условие нормировки
на два: по радиальной координате

Для справочных целей выпишем полные выражения для нормированных волновых функций. Сумма в (6.24) с рекуррентным соотношением (6.25) для коэффициентов может быть выражена через так называемую гипергеометрическую функцию. Радиальная часть волновой функции с учётом условия нормировки равна
Здесь F — вырожденная (конфлюэнтная) гипергеометрическая функция (функция Куммера):
которая сходится при всех конечных z ; параметр α произволен, а β предполагается не равным нулю или целому отрицательному числу. Если α есть целое отрицательное число (или нуль), то F( α , β , z ) сводится к полиному степени | α |. Радиальные волновые функции выражаются также через обобщённые полиномы Лагерра 
Угловая часть волновой функции описана в разделе (12.6).
В литературе можно увидеть различные формулы для волновой функции в кулоновском поле. Они отличаются друг от друга комплексной константой, квадрат модуля которой равен единице. Это различие не является существенным, так как в любом физическом эксперименте измеряется вероятность обнаружения частицы, равная именно квадрату модуля волновой функции.
Заметим, что размерность волновой функции равна см –d/2 , где d — размерность задачи. В нашем случае размерным множителем в (6.30) является комбинация ( 2kn ) 3/2 . Остальные множители являются безразмерными, включая сферическую функцию Yl,m.
Видео:Уравнение ШрёдингераСкачать

16.7 Статистический вес энергетического уровня
Соберём воедино основные результаты, полученные в этой главе. Уровни электрона с отрицательной энергией в кулоновском поле квантуются:

причём энергия зависит только от главного квантового числа n . Квадрат модуля момента определяется орбитальным квантовым числом l , которое при заданном уровне энергии может принимать n разных значений:
Напомним (раздел 13.5), что для краткости l часто называют абсолютной величиной момента. Существует специальная система обозначений для состояний с определённым значением l :
Видео:Урок 33. Разобьем волновую функцию на две части!Скачать

Что характеризуют радиальная и угловая части волновой функции в уравнении шредингера
Аналог классического волнового уравнения был предложен Э. Шредингером в 1925 г. Как и классическое уравнение, уравнение Шредингера связывает производные волновой функции по времени и координате. Уравнение Шредингера описывает поведение любых нерелятивистских систем. На примерах частицы, находящейся в бесконечно глубокой яме, и гармонического осциллятора рассмотрены простейшие квантовые системы, получены дискретные спектры состояний. Возможности описания динамики данных систем ограничены набором квантовых чисел, отражающих универсальные и внутренние симметрии квантовых систем.
4.1. Уравнение Шредингера
В квантовой физике изменение состояния частицы описывается уравнением Шредингера
 | (4.1) |
где 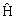
в которой 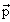




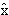
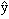
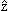
х → 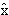
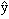
 | (4.2) |
Уравнение Шредингера
Зависящее от времени уравнение Шредингера:
где 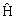
Разделение переменных. Запишем Ψ(

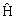
Левая часть является функцией только координат, а правая не зависит от переменной x. Поэтому обе части последнего уравнения должны быть равны одной и той же постоянной, которую обозначим E
θ(t) = exp(−iEt/ћ), 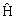




Уравнение 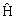



Для трехмерной системы с массой m в поле с потенциалом U(
−(ћ 2 /2m)Δψ(



где Δ – лапласиан.
Так как уравнение Шредингера является линейным уравнением первого порядка по времени, то с его помощью по заданному значению волновой функции Ψ(x, y, z, 0) в момент времени t = 0 можно найти её значение в произвольный момент времени t − Ψ(x, y, z, t).
Уравнение Шредингера для стационарного состояния, когда потенциальная энергия частицы не зависит от времени, имеет вид
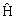 ψ( ψ( ) = Eψ( ) = Eψ( ). ). | (4.3) |
Это уравнение называют стационарным уравнением Шредингера.
Так как в стационарном состоянии
Ψ( ,t) = ψ( ,t) = ψ( )exp(−iEt/ћ) )exp(−iEt/ћ) | (4.4) |
и вероятность найти частицу в момент t в точке x, y, z пропорциональна |Ψ(
|ψ(x,y,z)| 2 , т.е. не зависит от времени. Аналогично, вероятность обнаружить значение физической величины, характеризующей систему, также не изменяется со временем, поскольку выражается через квадрат модуля волновой функции.
4.2. Частица в одномерной прямоугольной яме с бесконечными стенками
Потенциальная энергия U(x) в прямоугольной яме удовлетворяет следующим условиям:
 | (4.5) |

Рис.4.1. Прямоугольная яма с бесконечными стенками
Частица находится в области 0 ≤ x ≤ L. Вне этой области ψ(x) = 0. Уравнение Шредингера для частицы, находящейся в области 0 ≤ x ≤ L
 | (4.6) |
Волновая функция, являющаяся решением уравнения (4.9), имеет вид
| ψ(x)= Аsin kx + Bcos kx, | (4.7) |
где k = (2mE/ћ 2 ) 1/2 . Из граничных условий ψ(0) = 0, ψ(L) = 0 и условий непрерывности волновой функции следует
| Аsin kL = 0. | (4.8) |
kL = nπ, n = 1, 2, 3, … , то есть внутри потенциальной ямы с бесконечно высокими стенками устанавливаются стоячие волны, а энергия состояния частиц имеет дискретный спектр значений En
 n = 1, 2, 3, … n = 1, 2, 3, … | (4.9) |
Частица может находиться в каком-то одном из множества дискретных состояний, доступных для неё.
Каждому значению энергии En соответствует волновая функция ψn(x), которая с учетом условия нормировки
 | (4.10) |
В отличие от классической, квантовая частица в прямоугольной яме не может иметь энергию
E 2 π 2 /(2mL 2 ). Состояния частицы ψn в одномерном поле бесконечной потенциальной ямы полностью описывается с помощью одного квантового числа n. Спектр энергий дискретный.
Рис. 4.2. Уровни энергии и волновые функции частицы Ψ в бесконечной прямоугольной яме. Квадрат модуля волновой функции |Ψ| 2 определяет вероятность нахождения частицы в различных точках потенциальной ямы.
4.3. Гармонический осциллятор
Положение уровней частицы в потенциальной яме зависит от вида потенциальной ямы. В одномерной потенциальной яме гармонического осциллятора потенциальная энергия имеет вид
 | (4.11) |
В этом случае одномерное уравнение Шредингера имеет вид
 | (4.12) |
Допустимые значения полной энергии определяются формулой
| En = ћω0(n + 1/2), n = 0, 1, 2, | (4.13) |
В отличие от бесконечной прямоугольной ямы, спектр уровней гармонического осциллятора эквидистантный.
С увеличением массы частицы или размеров области ее локализации квантовое описание частицы переходит в классическое.
Частица в одномерной потенциальной яме
Одномерная прямоугольная яма шириной L:


Одномерный гармонический осциллятор:

4.4. Частица в поле с центральной симметрией
В сферических координатах стационарное уравнение Шредингера для частицы в центральном потенциале U(r) имеет вид
 | (4.14) |
Решение уравнения (4.14) записываются в виде произведения радиальной и угловой функций
| ψ(r,θ,φ) = Rnl(r)Ylm(θ,φ), | (4.15) |
где радиальная функция Rnl(r) и угловая функция Ylm(θ,φ), называемая сферической, удовлетворяют уравнениям
 2 Ylm(θ,φ) = ћ 2 l(l +1)Ylm(θ,φ) 2 Ylm(θ,φ) = ћ 2 l(l +1)Ylm(θ,φ) | (4.16) |
 Ylm(θ,φ) = ћ 2 l(l +1)Ylm(θ,φ) Ylm(θ,φ) = ћ 2 l(l +1)Ylm(θ,φ)  | (4.17) |
Уравнение (4.16) определяет возможные собственные значения l и собственные функции Ylm(θ,φ) оператора квадрата момента 
Схема уровней (последовательность и абсолютные значения энергий) зависит от радиальной функции Rnl(r), которая в свою очередь определяется потенциалом U(r), в котором находится частица.
Рис. 4.3. Радиальное распределение вероятности нахождения электрона в кулоновском поле протона (атом водорода). Расстояния даны в боровских радиусах
r0 = ћ 2 /mee 2 ≈ 0.529·10 8 cм.
| Решения уравнения |
существуют лишь при определенных значениях квантовых чисел n (радиальное квантовое число), l (орбитальное квантовое число) и m (магнитное квантовое число).
Возможные энергетические состояния системы (уровни энергии) определяются числами n и l и в случае сферически симметричных состояний не зависят от квантового числа m. Число n может быть только целым:
n = 1, 2, …, ∞. Число l может принимать значения 0, 1, 2, …, ∞.
4.5. Орбитальный момент количества движения
Собственные значения L 2 и Lz являются решением уравнений


Они имеют следующие дискретные значения
L 2 = ћ 2 l(l + 1), где l = 0, 1, 2, 3, …,
Lz = ћm, где m = 0, ± 1, ± 2, ± 3,…, ± l.
Для характеристики состояний с различными значениями орбитального момента l обычно используют следующие обозначения:
Спектроскопические названия орбитальных моментов l
| l = 0 | s-состояние |
| l = 1 | p-состояние |
| l = 2 | d-состояние |
| l = 3 | f-состояние |
| l = 4 | g-состояние |
| l = 5 | h-состояние |
| и. т. д. |
Состоянию с l = 0 отвечает сферически симметричная волновая функция. В тех случаях, когда l ≠ 0 волновая функция не имеет сферической симметрии. Симметрия волновой функции определяется симметрией сферических функций Ylm(θ,φ). Имеет место интересное квантовое явление, когда решение сферически симметричной задачи (потенциал описывает сферически симметричную систему) приводит к состояниям, не обладающим сферической симметрией. Таким образом, симметрия уравнений не обязательно должна отражаться в симметрии каждого отдельно взятого решения этих уравнений, а лишь во всей совокупности этих решений.
Для частицы, находящейся в сферически симметричном потенциале, величина орбитального момента количества движения L:
 | (4.18) |
Обычно, для упрощения, когда говорят о величине орбитального момента количества движения, называют этой величиной квантовое число l, имея в виду, что между l и L имеется однозначная связь (4.18).
Рис. 4.4 Возможные ориентации вектора 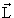
Так как величина l может принимать только целочисленные значения 0, 1, 2, 3,…, то и орбитальный момент количества движения L квантуется. Например, для частицы с l = 2 момент количества движения

= 6.58·10 -22 √6 МэВ·сек ≈ 2.6·10 — 34 Дж·сек.
Пространственное квантование. Орбитальный момент количества движения является векторной величиной. Так как величина орбитального момента количества движения квантуется, то и направление 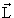
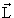
Состояние частицы, находящейся в сферически симметричном поле, полностью описывается тремя квантовыми числами: n, l и m.
Появление квантовых чисел связано со свойствами симметрии системы. Характер этой симметрии определяет возможные значения квантовых чисел. Очевидно, что система, описываемая функцией e im φ , примет прежнее значение только тогда, когда азимутальный угол φ в результате поворота вокруг оси z примет прежнее значение φ. Этому условию функция e im φ удовлетворяет только в случае, когда величина mφ кратна 2π. Т.е. величина m должна иметь целые значения. Так как необходимо учитывать вращение в двух противоположных направлениях и отсутствие вращения, единственно возможными значениями оказываются m = 0, ±1, ±2, … .
4.6. Спин
Спин − собственный момент количества движения частицы. Между значением вектора спина 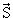
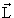
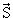 2 = ћ 2 s(s + 1) 2 = ћ 2 s(s + 1) | (4.19) |
В отличие от орбитального квантового числа l, которое может быть лишь целым числом или нулем, спиновое квантовое число s (в дальнейшем просто спин) может быть как целым (включая нуль), так и полуцелым, т. е. s = 0, 1/2, 1, 3/2, 2, 5/2, … , но при этом для каждой элементарной частицы спин может принимать единственное присущее этому типу частиц значение. Так, спины π-мезонов и К-мезонов равны 0. Спины электрона, протона, нейтрино, кварков и их античастиц равны 1/2. Спин фотона равен 1. Бозоны составляют класс частиц с целым значением спина, спин фермионов имеет полуцелое значение. Спин частицы невозможно изменить, также как её заряд или массу. Это её неизменная квантовая характеристика.
Как и в случае других квантовых векторов, проекция вектора спина 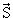
szћ = ±sћ, ±(s − 1)ћ, ±(s − 2)ћ. ±1/2ћ или 0.
Число sz − это квантовое число проекции спина. Максимальная величина sz совпадает с s. Так как спин электрона равен 1/2, то проекция этого спина может принимать лишь два значения sz = ±1/2. Если проекция +1/2, то говорят, что спин направлен вверх, если проекция -1/2, то говорят, что спин направлен вниз.
4.7. Полный момент количества движения
Полный момент количества движения частицы или системы частиц 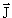
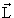
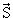
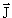
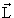
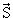
Квадрат полного момента имеет значение:
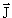
Квантовое число полного момента j, соответствующее сумме двух векторов 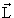
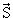
j = l + s, l + s −1. |l − s|
Проекция 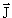
Число значений проекции Jz равно 2j + 1. Если для 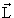
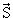
4.8. Квантовые числа
Квантовые числа – это целые или дробные числа, которые определяют все возможные значения физической величины, характеризующей различные квантовые системы – атомы, атомные ядра, кварки и другие частицы.
Таблица квантовых чисел
| n | Радиальное квантовое число. Определяет число узлов волновой функции и энергию системы. n = 1, 2, …, ∞. |
| J, j | Полный угловой момент J и его квантовое число j. Последнее никогда не бывает отрицательным и может быть целым или полуцелым в зависимости от свойств рассматриваемой системы. 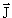 2 = ћ 2 j(j + 1). 2 = ћ 2 j(j + 1). |
| L, l | Орбитальный угловой момент L и его квантовое число l. Интерпретация l такая же, как j, но l может принимать только целые значения, включая нуль: l = 0, 1, 2,…. L 2 = ћ 2 l(l + 1). |
| m | Магнитное квантовое число. Проекция полного или орбитального углового момента на выделенную ось (обычно ось z) равна mћ. Для полного момента m = ±j, ±(j-1), …, ±1/2 или 0. Для орбитального m = ± l, ± (l-1), …, ±1, 0. |
| S, s | Спиновый угловой момент S и его квантовое число s. Оно может быть либо положительным целым (включая нуль), либо полуцелым. s – неизменная характеристика частицы определенного типа. S 2 = ћ 2 s(s + 1). |
| sz | Квантовое число проекции спинового момента частицы на выделенную ось. Эта проекция может принимать значения szћ, где sz = ± s, ± (s -1), …, ±1/2 или 0. |
| P или π | Пространственная четность. Характеризует поведение системы при пространственной инверсии  → — → —  (зеркальном отражении). Полная четность частицы Р = π(-1) l , где π – её внутренняя четность, а (-1) l – её орбитальная четность. Внутренние четности кварков положительные, антикварков — отрицательные. (зеркальном отражении). Полная четность частицы Р = π(-1) l , где π – её внутренняя четность, а (-1) l – её орбитальная четность. Внутренние четности кварков положительные, антикварков — отрицательные. |
| I | Изоспин. Характеризует свойство зарядовой инвариантности сильных взаимодействий |
Для обозначения спинового момента часто используют букву J.
Все состояния, в которых может находиться квантовая система, описываются с помощью полного набора квантовых чисел. Так в случае протона в ядре состояние протона описывается с помощью четырех квантовых чисел, соответствующих четырем степеням свободы – трем пространственным координатам и спину. Это
- Радиальное квантовое число n ( 1, 2, …, ∞),
- Орбитальное квантовое число l (0, 1, 2, …),
- Проекция орбитального момента m (± l, ± (l-1), …, ±1, 0),
- Спин протона s =1/2.
Для описания сферически-симметричных систем в квантовой физике используются различные сферически симметричные потенциалы с различной радиальной зависимостью:
- Кулоновский потенциал U = Q/r,
- Прямоугольная потенциальная яма
- Потенциал типа гармонического осциллятора U = kr 2 ,
- Потенциал Вудса-Саксона (с его помощью описываются внутриядерные взаимодействия):
где U0, а и R – положительные константы (R – радиус ядра). Во всех случаях сферически симметричные системы можно описать с помощью набора квантовых чисел n, l, j, jz, однако, в зависимости от радиального вида потенциала энергетический спектр состояний системы будет различным.
Существование сохраняющихся во времени физических величин тесно связано со свойствами симметрии гамильтониана системы. Например, в случае, если квантовая система обладает центральной симметрией U = U(r), то этой системе соответствует сохранение орбитального момента количества движения l и одной из его проекций m. При этом из-за сферической симметрии задачи энергия состояний не будет зависеть от величины m, т. е. состояния будут вырожденными по m.
Наряду с пространственными симметриями, связанными с непрерывными преобразованиями, в квантовой физике существуют и другие симметрии – дискретные. Одной из них является зеркальная симметрия волновой функции относительно инверсии координат (

Система тождественных частиц характеризуется еще одной симметрией – симметрией относительно перестановок тождественных частиц. Эта симметрия определяется свойствами частиц, образующих систему. Системы частиц с целым спином (бозонов) описываются симметричными волновыми функциями, системы частиц с полуцелым спином (фермионов) − антисимметричными волновыми функциями.
Задачи
4.1. Вычислите допустимые уровни энергии электрона, находящегося в одномерной прямоугольной потенциальной яме шириной 10 -8 см, протона, находящегося в потенциальной яме 5 Фм, и шарика массой 1 г, находящегося в потенциальной яме 1 см.
4.2. Рассчитать энергию перехода между состояниями 1s и 2s в атоме водорода.
4.3. Найти значение полного момента j для протона в d-состоянии. Каким будет результат измерения полного момента протона в состоянии 1d5/2?
4.4. Найти полный момент (квантовое число j) системы двух нуклонов в s‑состоянии (l = 0).
4.5. Какие значения может иметь полный момент системы j, если
А. Нейтрон и протон находятся в состояниях с |l,s:j>n = |1, 1 /2: 3 /2>, |l,s:j>p = |1, 1 /2: 3 /2>?
Б. Два нейтрона находятся в состояниях с |l,s:j>1 = |1, 1 /2: 3 /2> и |l,s:j>2 = |1, 1 /2: 3 /2>?
4.6. А) Нейтрон находится в p-состоянии. Найти значения полного момента j и возможные значения проекции момента jz. Каким будет результат измерения орбитального момента частицы в этом состоянии? Б) Рассмотрите задачу А) для протона в d-состоянии.
Ответ: А) j = 3/2, 1/2; jz = ±3/2, ±1/2; L = ћ√ l(l +1) = √ 2 ћ;
Б) j = 5/2, 3/2; jz = ±5/2, ±3/2, ±1/2; L = ћ√ l(l +1) = √ 6 ћ
4.7. А) Частица с собственным моментом s = 3/2 находится в состоянии с орбитальным моментом
l = 2. Найти полный момент частицы j.
Б) Частица с собственным моментом s = 1/2 находится в состоянии с орбитальным моментом
l = 3. Определите полный момент частицы j
Ответ: А) j = 7/2 ÷ 1/2; Б) j = 7/2, 5/2
4.8. Протон и нейтрон находятся в состоянии с относительным орбитальным моментом L = 1. Найти полный момент системы J.
Ответ: J = 0, 1, 2
4.9. На оболочке с квантовым числом n = 1, l = 2 находятся протон и нейтрон. Определить их суммарный полный момент J и его проекцию Jz. Изменится ли результат, если на оболочке n = 1,
l = 2 будут находиться два нейтрона?
4.10. Почему возникают вырожденные состояния?
4.11. Написать оператор Гамильтона 
4.12. Напишите стационарное уравнение Шредингера в сферической системе координат.
4.13. Какие квантовые числа характеризуют частицу в центрально-симметричной потенциальной яме?
4.14. Покажите, что волновые функции ψ = Aexp(kx −ωt) и ψ = Asin(kx −ωt) не удовлетворяют зависящему от времени уравнению Шредингера.
4.15. Покажите, что волновые функции ψ = Ae i(kx −ωt) и ψ = A(cos(kx −ωt) − sin(kx −ωt))удовлетворяют зависящему от времени уравнению Шредингера.
4.16. Частица находится в низшем состоянии n = 1 в бесконечно глубокой одномерной прямоугольной потенциальной яме размера L.
А) Рассчитайте вероятность обнаружить частицу в интервале Δx = 0.001L при x = 1 /2L, x = 2 /3L, x = L.
Б) Рассмотрите случай, когда частица находится в состоянии n = 2 при тех же значениях x.
Ответ: А) P(L/2) = 0.002; P(2L/3) = 0.0015; P(L) = 0; Б) P(L/2) = 0; P(2L/3) = 0.0015; P(L) = 0
4.17. Частица находится в состоянии n = 2 в бесконечно глубокой одномерной прямоугольной потенциальной яме размера L. Рассчитайте вероятность обнаружить частицу в интервале ( 1 /3L, 2 /3L).
Ответ: P(L/3, 2L/3) = 0.2
4.18. Электрон находится всостонии n = 5 в бесконечно глубокой одномерной прямоугольной потенциальной яме размера L. Рассчитайте вероятность обнаружить электрон в области x от 0.2L до 0.5L.
Ответ: P(0.2L, 0.5L) = 0.3
4.19. Электрон находится в бесконечно глубокой одномерной потенциальной яме. Рассчитайте ширину потенциальной ямы, если энергия состояния n = 1 равна 0.1 эВ.
Ответ: L = 1.9 нм
4.20. Рассчитайте средние значения и 2 > для состояний n = 1, 2, 3 в бесконечно глубокой прямоугольной потенциальной яме.
4.21. Что общего и в чем различие в описании атома водорода в теории Шредингера и в модели Бора?
4.22. Почему энергии атома водорода в теории Шредингера не зависят от орбитального квантового числа l?
4.23. Угловой момент характеризуется квантовым числом l = 3. Какие значения могут принимать Lz и L 2 ?
Ответ: Lz = -3ћ, -2ћ. 3ћ; L 2 = 12ћ 2
4.24. Угловой момент характеризуется квантовым числом l = 3. Какие значения могут принимать Lz и L 2 ?
🔥 Видео
Теория Бора. Гипотеза де Бройля. Принцип неопределенности. Уравнение Шрёдингера.Скачать

Структура материи 6: уравнение Шрёдингера. Зачем нужна квантовая механика – Виталий Бейлин | НаучпопСкачать

Классические уравнения | уравнение Шрёдингера (координатное представление) | простейший выводСкачать

Александр Чирцов — От Шредингера до ДиракаСкачать

Простое объяснение квантовой волновой функции с канала DoSСкачать
Урок 459. Обзор квантовой теории атома водородаСкачать

Лекции 5-6. Уравнение Шредингера и его приближенные решения. Межатомные.Скачать

Квантовая механика 49 - Реальна ли волновая функция?Скачать

Что такое волновая функция? Душкин объяснитСкачать

Сущёв И. - Квантовая теория. Ч.2 - 1. Численные методы решения уравнения ШрёдингераСкачать

ВОЛНОВАЯ функция. Уравнение ШРЁДИНГЕРА. КВАНТОВЫЕ ЧИСЛА | КОНДЕНСАТ - ХОХЛОВ Д. Р. ФизФак МГУСкачать























































