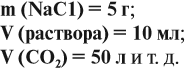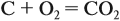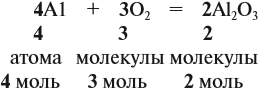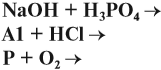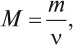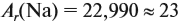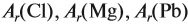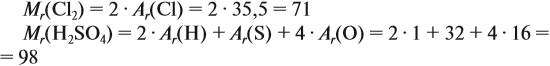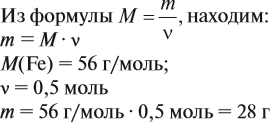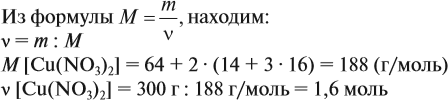Химия — наука, изучающая взаимодействие веществ на атомном и молекулярном уровнях. Эти процессы значительно отличаются от привычного нам макроуровня и поэтому требуют специфических подходов, в том числе к «подсчету» и «взвешиванию». Школьный курс химии включает понятия «моль» и «молярная масса». Они кажутся сложными, но если разобраться, то вы без труда поймете сущность этих понятий и научитесь ими пользоваться при решении задач.
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Моль
Понятие «моль» попытаемся разобрать и, самое главное, понять на примере всем знакомой реакции взаимодействия кислорода и водорода. Когда одна молекула O2 соединяется с двумя молекулами H2, получается две молекулы H2O:
То есть, чтобы максимально полно провести химическую реакцию, мы должны взять на каждую молекулу кислорода две молекулы водорода. Итак, у нас есть 100 г кислорода. Сколько понадобится водорода для протекания процесса? И тут возникает первый вопрос: сколько молекул в 100 г кислорода? Наверное, миллиарды или даже миллиарды миллиардов? И сколько их в 100 г водорода? Уж точно в не в 2 раза меньше. Как вообще подсчитать молекулы, ведь они бывают совершенно разными, «тяжелыми» и «легкими». Этими вопросами задавались и люди, закладывавшие основу современной химической науки.
Был найден простой выход, который помогает легко и изящно решить проблему. Химики решили взять за единицу измерения не одну молекулу, а определенное их количество, причем очень большое. Таким образом эта единица измерения приводит микроуровень к макроуровню. Она называется «моль».
Моль — это количество вещества из 6,02214076⋅10 23 атомов или молекул. Оно не имеет физического смысла и изначально было привязано к массе определенного количества (12 граммов) углерода-12, но позже переопределено, как и многие другие единицы системы СИ. В школьных расчетах количество структурных единиц в моле, которое также называется постоянной Авогадро, обычно округляют до 6,022⋅10 23 и обозначают NA.
С этой величиной связано другое химическое понятие — «количество вещества», то есть количество структурных единиц в определенной его порции. Оно обозначается буквой ν (ню).
Примеры
В стакане содержится 2 моль воды. Сколько молекул воды находится в стакане?
N = ν⋅ NA =2 ⋅ 6,022⋅10 23 = 12,044⋅10 23 молекул воды.
Также можно решить обратную задачу. Сколько молей вещества составляют 24,088⋅10 23 молекул воды?
ν⋅ = N / NA = 24,088⋅10 23 / 6,022⋅10 23 = 4 моля.
Моль и молярная масса: простое объяснение с примерами
Молярная масса
Итак, мы поняли, что моль — условное количество вещества, выбранное для удобства химиков. Это даже не миллиарды миллиардов, как мы предположили ранее, а миллиарды триллионов, что никак не облегчает задачу подсчета этих структурных единиц. Как же все-таки узнать, сколько атомов или молекул в 100 граммах того или иного вещества? Теперь хорошо бы связать количество вещества и его массу, ведь это не одно и то же. Нам поможет «молярная масса» — то есть масса 1 моль вещества или масса 6,022⋅10 23 структурных единиц этого вещества.
Итак, молярная масса равна массе порции вещества m к количеству молекул ν в его порции:
Вооружившись этим знанием, мы можем переводить граммы в число молекул и наоборот. При этом следует учесть, что молярная масса численно идентична молекулярной массе (то есть массе молекулы), выраженной в атомных единицах массы, и относительной молекулярной массе.
Пример
Найдем массу 5 моль воды.
Чтобы решить эту задачу, обратимся к формуле молярной массы и выразим из нее массу:
В этой формуле мы знаем количество вещества ν = 5 моль, а молярную массу сложной молекулы нужно определить, как сумму молярных масс составляющих ее химических элементов:
Моль и молярная масса: простое объяснение с примерами
Где взять молярные массы кислорода и водорода (в соединение входит два атома водорода, поэтому его молярную массу умножаем на 2)?
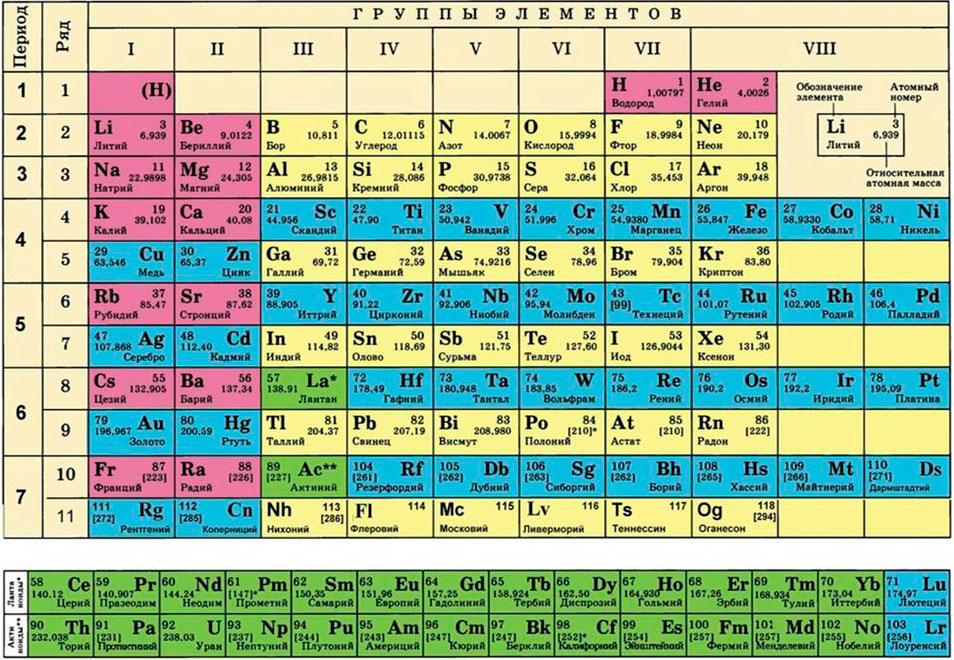
Для этого нам понадобится таблица Менделеева и значение «относительной атомной массы», которая, как мы уже знаем, идентична молекулярной. Это значение приведено для каждого химического элемента и для водорода равно 1,00797 (то есть близко к 1), для углерода — близко к 6, для кислорода — около 16. Подставим соответствующие значения в исходную формулу и получим:
M (H2O) = 2 ⋅M (H) + M (O) = 2 ⋅ 1 + 16 = 18 г/моль.
То есть масса 1 моль воды составляет 18 граммов. Теперь можем подсчитать массу 5 моль воды:
m = М ⋅ ν = 18 ⋅ 5 = 90 г.
Аналогичным образом мы можем подсчитать количество вещества, которое содержится в определенном образце заданной массы. Для примера возьмем оксид алюминия Al2O3 и узнаем, сколько моль в 400 граммах этого вещества. Для этого выразим количество вещества через молярную массу и подставим исходные данные:
ν = m / М = 400 / (2 ⋅ М (Al) + 3 ⋅ (O)) = 400 / (2 ⋅ 75 + 3 ⋅ 16) = 400 / (150 + 48) = 400 / 198 ≈ 2,02 моль.
Видео:ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать

Расчёты по уравнениям химических реакций.
Стехиометрия – количественные соотношения между вступающими в реакцию веществами.
Если реагенты вступают в химическое взаимодействие в строго определенных количествах, а в результате реакции образуются вещества, количество которых можно расчитать, то такие реакции называются стехиометрическими.
Законы стехиометрии:
Коэффициенты в химических уравнениях перед формулами химических соединений называются стехиометрическими.
Все расчёты по химическим уравнениям основаны на использовании стехиометрических коэффициентов и связаны с нахождением количеств вещества (чисел молей).
Количество вещества в уравнении реакции (число молей) = коэффициенту перед соответствующей молекулой.
Моль – это такое количество вещества, в котором содержится определённое число частиц (молекул, атомов, ионов), равное постоянной Авогадро:
Выход реакции η – отношение реальной массы продукта mp к теоретически возможной mт, выраженное в долях единицы или в процентах.
Если в условии выход продуктов реакции не указан, то в расчетах его принимают равным 100% (количественный выход).
Схема расчёта по уравнениям химических реакций:
- Составить уравнение химической реакции.
- Над химическими формулами веществ написать известные и неизвестные величины с единицами измерения.
- Под химическими формулами веществ с известными и неизвестными записать соответствующие значения этих величин, найденные по уравнению реакций.
- Составить и решить пропорцию.
Пример. Вычислить массу и количество вещества оксида магния, образовавшегося при полном сгорании 24 г магния.
1. Составим уравнение химической реакции:
2. Под формулами веществ укажем количество вещества (число молей), которое соответствует стехиометрическим коэффициентам:
3. Определим молярную массу магния:
Относительная атомная масса магния Ar(Mg) = 24.
Т.к. значение молярной массы равно относительной атомной или молекулярной массе, то M(Mg) = 24 г/моль.
4. По массе вещества, заданной в условии, вычислим количество вещества:
5. Над химической формулой оксида магния MgO, масса которого неизвестна, ставим x моль, над формулой магния Mg пишем его молярную массу:
6. Составим пропорцию:
По правилам решения пропорции:
Количество оксида магния ν(MgO) = 1 моль.
Видео:Как за 4 МИНУТЫ выучить Химию? Химическое Количество, Моль и Закон АвогадроСкачать

Урок 29. Основные расчетные понятия
Задачи по химии являются превосходной «гимнастикой» для ума, поскольку позволяют ученику развивать логическое мышление, составлять и реализовывать план решения задачи, а параллельно повторять те или иные разделы химической науки. Все задачи, которые предлагаются для решения, можно разделить на две группы:
- задачи, которые решаются по стандартной формуле;
- задачи, которые решаются по уравнению реакции.
Многие задачи содержат и то и другое. Поэтому сначала нужно изучить уроки 29, 30, 31, а затем переходить к решению более сложных заданий.
В начале каждого урока рассматривается, КАК решать задачи, и рассматривается подробно ход решения её и образец оформления решения. Такие задачи обозначены как Задача 1, далее идёт сквозная нумерация их: всего задач 35.
В конце каждого урока даны задачи для самостоятельного решения, для них также предусмотрена сквозная нумерация: всего задач 97. Почти все эти задачи «распределены» по урокам Самоучителя так, чтобы, изучая какую-либо тему, вы могли бы закрепить материал, решая задачи и выполняя упражнения. В случае затруднений найдите эту задачу среди задач для самостоятельного решения, а потом посмотрите, как решаются такие задачи.
Рассмотрим сначала основные расчётные понятия.
Как известно, количества реагирующих простых и сложных веществ и смесей обычно измеряют в граммах, литрах, миллилитрах. Данные в этих случаях записывают так:
Однако при расчётах по уравнениям реакций этих расчётных понятий оказывается недостаточно. Дело в том, что в каждой химической реакции участвуют определённые частицы (атомы, молекулы, ионы), масса которых, естественно, различна. И поэтому даже для простейших химических реакций типа:
нельзя утверждать, что 1 г углерода полностью прореагирует с 1 г кислорода. Посмотрите в таблицу Менделеева: атомные массы этих химических элементов разные! Каким же образом выполняется расчёт по химическим уравнениям?
Поскольку в химических реакциях участвуют частицы (молекулы, атомы, ионы), то основным расчётным понятием является моль — величина, при помощи которой можно определить число частиц.
1 моль любого вещества содержит 6 · 10 23 частиц (молекул, атомов, ионов).
- 1 моль Аl содержит 6 · 10 23 атомов алюминия;
- 1 моль НСl содержит 6 · 10 23 молекул хлороводорода.
Число молей (ν) реагирующих веществ определяют по коэффициентам в уравнении химической реакции:
Задание 29.1. Расставьте коэффициенты и подпишите под химическими формулами число молей реагирующих веществ:
Каким образом можно определить массу или объём реагирующих веществ, зная их количества (в молях)?
Для определения массы используют величину «молярная масса»:
где М — молярная масса, г/моль; m — масса, г; ν — количество вещества, моль*.
* ν — греческая буква «ню», которую не следует путать с латинской v.
Молярная масса равна массе вещества количеством 1 моль.
То есть молярная масса это масса всех 6 · 10 23 молекул (атомов, ионов). Молярная масса (М) совпадает по величине с относительной атомной (Аr) или молекулярной (Мr) массой вещества, которые легко определяются по таблице Менделеева.
Так, относительная атомная масса (Аr) химического элемента указана в таблице Менделеева:
Это безразмерная величина.
Задание 29.2. Определите по таблице Менделеева:
Относительная молекулярная масса (Мr) вещества равна сумме относительных атомных масс атомов всех элементов, входящих в состав этого вещества. При подсчёте значения относительных атомных масс их рекомендуется округлять (обычно до целых чисел):
Это безразмерные величины.
Задание 29.3. Рассчитайте относительные молекулярные массы веществ:
Теперь несложно определить массы реагирующих веществ.
Задача 1. Определить массу железа количеством 0,5 моль.
Задача 2. Определить количество вещества Сu(NO3)2 массой 300 г.
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Задачи для самостоятельного решения
1. Определить массу:
а) алюминия, количеством 0,1 моль;
б) серной кислоты, количеством 1,5 моль;
в) сульфата алюминия, количеством 0,2 моль.
2. Определить количество вещества (моль):
а) магния, массой 4,8 г;
б) азотной кислоты, массой 126 г;
в) нитрата аммония, массой 40 г.
📺 Видео
Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Химия ПростоСкачать

Расчеты по уравнениям химических реакций. 1 часть. 8 класс.Скачать

Количество вещества. Моль. Число Авогадро. 8 класс.Скачать

Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

ЧТО ТАКОЕ МОЛЬ И КОЛИЧЕСТВО ВЕЩЕСТВА В ХИМИИ?Скачать

8 класс.Ч.1.Решение задач по уравнению реакций.Скачать

Начинаем решать 10-й вариант сборника Добротина (номера 1-28)Скачать

МОЛЯРНАЯ МАССА ХИМИЯ // Урок Химии 8 класс: Относительная Молекулярная МассаСкачать

Как решать задачи по химии? Расчет по уравнениям химических реакций | TutorOnlineСкачать

Химия 8 класс (Урок№10 - Расчёты по уравнениям химических реакций.)Скачать

Решение задач на термохимические уравнения. 8 класс.Скачать

Закон Авогадро. Молярный объем. 8 класс.Скачать

Молярная масса. 8 класс.Скачать

Решение задач по уравнениям реакций, если одно из реагирующих веществ взято в избытке. 1 ч. 9 класс.Скачать

Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать