- Видео:
- Содержание:
- Главное отличие — реальный против идеального газа
- Ключевые области покрыты
- Что такое настоящий газ
- Что такое идеальный газ?
- Разница между реальным и идеальным газом
- Определение
- Межмолекулярные аттракционы
- Газовая частица
- Столкновения
- Кинетическая энергия
- Изменение в государстве
- Заключение
- Разница между идеальным и реальным газом
- Что представляет собой идеальный газ?
- Что представляет собой реальный газ?
- Сравнение
- Уравнение состояния вещества
- Что такое идеальный газ
- Что такое реальный газ
- Видео:
Видео:Идеальный и реальный газ | Газы.Молекулярно-кинетическая теория | Химия (видео 7)Скачать

Видео:
Видео:Уравнение Ван-дер-Ваальса | Газы.Молекулярно-кинетическая теория | Химия (видео 8)Скачать

Содержание:
Видео:Идеальный газ. Основное уравнение молекулярно-кинетической теории газов. 10 класс.Скачать

Главное отличие — реальный против идеального газа
Газ — это тип физического состояния, в котором может существовать материя. Когда частицы или молекулы соединения могут свободно перемещаться в любом месте внутри контейнера, это соединение называется газом. Газообразное состояние отличается от двух других физических состояний (твердое и жидкое состояние) в зависимости от способа упаковки частиц или молекул. Настоящий газ — это газообразное соединение, которое действительно существует. Идеальный газ — это газообразное соединение, которое в действительности не существует, но является гипотетическим газом. Тем не менее, некоторые газообразные соединения демонстрируют примерно такое же поведение, что и идеальные газы при определенных условиях температуры и давления. Следовательно, мы можем применять газовые законы для такого рода реальных газов, предполагая, что они являются идеальными газами. Даже если обеспечены надлежащие условия, реальный газ не может стать на 100% близким к поведению идеального газа из-за различий между реальным и идеальным газом. Основное различие между реальным и идеальным газом заключается в том, что молекулы реального газа имеют межмолекулярные силы, тогда как идеальный газ не имеет межмолекулярных сил.
Ключевые области покрыты
1. Что такое настоящий газ
— Определение, специфические свойства
2. Что такое идеальный газ
— Определение, специфические свойства
3. В чем разница между реальным и идеальным газом
— Сравнение основных различий
Ключевые слова: газ, идеальный газ, газовые законы, межмолекулярные силы, реальный газ
Видео:Реальные газы. Изотермы Эндрюса и Ван-Дер-Ваальса. Метастабильные состоянияСкачать

Что такое настоящий газ
Настоящий газ — это газообразное соединение, которое действительно существует в окружающей среде. Эти реальные газы состоят из разных атомов или молекул, которые называются частицами. Эти частицы газа находятся в постоянном движении. Частица газа имеет определенный объем и массу. Следовательно, газ имеет определенный объем и массу. Объем газа рассматривается как объем контейнера, в котором хранится газ.
Некоторые реальные газы состоят из атомов. Например, газ гелий состоит из атомов гелия. Но другие газы состоят из молекул. Например, газообразный азот состоит из N2 молекулы. Следовательно, эти газы имеют массу и объем.
Кроме того, реальные молекулы газа имеют межмолекулярные притяжения между ними. Эти силы притяжения называются ван-дер-ваальсовыми взаимодействиями. Эти силы притяжения слабы. Столкновения между реальными молекулами газа неэластичны. Это означает, что когда две настоящие частицы газа коллоидны друг с другом, можно наблюдать изменение энергии частицы и изменение направления ее движения.
Однако некоторые реальные газы могут вести себя как идеальные газы в условиях низкого давления и высокой температуры. При высоких температурах кинетическая энергия молекул газа увеличивается. Поэтому движение молекул газа ускоряется. Это приводит к меньшему или отсутствию межмолекулярных взаимодействий между реальными молекулами газа.
Поэтому в условиях низкого давления и высокой температуры мы можем применять газовые законы для реальных газов. Например, при низком давлении и высокой температуре;
PV / nRT ≈ 1
Где P — давление газа,
n — число молей газа,
R — идеальная газовая постоянная и
Т — температура системы.
Это значение называется коэффициент сжимаемости, Это значение, которое используется в качестве поправочного коэффициента для отклонения свойства реального газа от идеального газа. Но для реальных газов PV ≠ nRT.
Рисунок 1: Коэффициент сжимаемости для разных газов относительно идеального газа
Хотя значение PV / nRT точно не равно 1, оно приблизительно равно значению при условиях низкого давления и высокой температуры.
Видео:Реальный газ Уравнение Ван-Дер-ВаальсаСкачать

Что такое идеальный газ?
Идеальный газ — это гипотетический газ, которого на самом деле не существует в окружающей среде. Понятие идеального газа было введено, поскольку поведение реальных газов сложное и отличается друг от друга, а поведение реального газа можно описать в отношении свойств идеального газа.
Идеальные газы — это газообразные соединения, которые состоят из очень крошечных молекул, которые имеют незначительный объем и массу. Как мы уже знаем, все реальные газы состоят из атомов или молекул, которые имеют определенный объем и массу. Столкновения между молекулами идеального газа упругие. Это означает, что нет изменений кинетической энергии или направления движения газовой частицы.
Между частицами идеального газа нет сил притяжения. Поэтому частицы движутся здесь и там свободно. Однако идеальные газы могут стать настоящими газами при высоких давлениях и низких температурах, поскольку частицы газа сближаются друг с другом с уменьшенной кинетической энергией, которая приведет к образованию межмолекулярных сил.
Рисунок 2: Поведение идеального газа по отношению к газу He и газу CO2
Идеальный газ подчиняется всем газовым законам без каких-либо предположений. Значение PV / nRT для идеального газа равно 1. Поэтому значение для PV равно значению для nRT. Если это значение (коэффициент сжимаемости) равно 1 для конкретного газа, то это идеальный газ.
Видео:Почему некоторые газы называют благородными.Скачать

Разница между реальным и идеальным газом
Определение
Настоящий газ: Настоящий газ — это газообразное соединение, которое действительно существует в окружающей среде.
Идеальный газ: Идеальный газ — это гипотетический газ, которого на самом деле не существует в окружающей среде.
Межмолекулярные аттракционы
Настоящий газ: Между частицами реального газа существуют силы межмолекулярного притяжения.
Идеальный газ: Между частицами идеального газа нет сил межмолекулярного притяжения.
Газовая частица
Настоящий газ: Частицы в реальном газе имеют определенный объем и массу.
Идеальный газ: Частицы в идеальном газе не имеют определенного объема и массы.
Столкновения
Настоящий газ: Столкновения между реальными молекулами газа неэластичны.
Идеальный газ: Столкновения между молекулами идеального газа упругие.
Кинетическая энергия
Настоящий газ: Кинетическая энергия частиц реального газа изменяется при столкновениях.
Идеальный газ: Кинетическая энергия частиц идеального газа постоянна.
Изменение в государстве
Настоящий газ: Настоящий газ может вести себя как идеальный газ при низком давлении и высоких температурах.
Идеальный газ: Идеальный газ может вести себя как настоящий газ при высоком давлении и низких температурах.
Заключение
Настоящие газы — это газообразные соединения, которые действительно существуют в окружающей среде. Но идеальные газы — это гипотетические газы, которых на самом деле не существует. Эти идеальные газы могут быть использованы для понимания поведения реальных газов. Применяя закон о газе для реального газа, мы можем предположить, что реальные газы ведут себя как идеальные газы при условиях низкого давления и высокой температуры. Но точным способом является использование поправочных коэффициентов для расчетов, а не допущения. Поправочные коэффициенты получаются путем определения разницы между реальным и идеальным газом.
Рекомендации:
1. «Настоящие газы». Химия LibreTexts, Libretexts, 1 февраля 2016,
Видео:35. Реальные газыСкачать

Разница между идеальным и реальным газом
Исследователи выделяют модели газа идеального и реального. В чем их специфика?
Видео:Физика. МКТ: Идеальный газ. Центр онлайн-обучения «Фоксфорд»Скачать

Что представляет собой идеальный газ?
В науке распространена трактовка понятия «идеальный газ», соответствующая гипотетическому веществу (не существующему в реальности), свойства которого могут быть описаны посредством уравнения Клапейрона — Менделеева.
Под идеальным газом понимается математическая модель соответствующего вещества, которая характеризуется:
- возможностью пренебрежения потенциальной энергией, образующейся в процессе взаимодействия частиц газа — в сравнении с уровнем кинетической энергии данных частиц;
- крайне малым общим объемом составляющих газ частиц;
- очень малым присутствием или же отсутствием дистанционных сил притяжения частиц либо отталкивания их;
- очень малым временем взаимодействия частиц друг с другом.
к содержанию ↑
Видео:В чем отличия сжиженного газа от природногоСкачать

Что представляет собой реальный газ?
Под реальным газом, в свою очередь, понимается вещество, которое не может быть описано уравнением Клапейрона — Менделеева. Так, молекулы, присутствующие в нем, взаимодействуют друг с другом, формируют некоторый объем.
Нужно отметить, что во многих случаях характеристики потенциальной энергии, формирующейся в ходе взаимодействия молекул реального газа, существенно ниже кинетической энергии. Вследствие чего соответствующие газы по своим свойствам приближаются к тем, что характеризуют идеальный газ. Заметные различия между рассматриваемыми веществами начинают появляться, как правило, при повышении давления и снижении температуры.
Видео:КАК РАЗЛИЧАЮТ ГАЗОВЫЕ БАЛЛОНЫСкачать

Сравнение
Главное отличие идеального газа от реального заключается в том, что в модели первого вещества практически не учитывается объем молекул, а также энергия их взаимодействия. В реальном газе соответствующие показатели учитываются. Вместе с тем при невысоком давлении и большой температуре реальный газ по своим свойствам близок к идеальному.
Определив, в чем разница между идеальным и реальным газом, зафиксируем выводы в таблице.
Видео:Газ свойства и классыСкачать

Уравнение состояния вещества
Параметры состояния связаны друг с другом. Соотношение, при котором определяется данная связь, называют уравнением состояния данного тела. В самом простом случае равновесное состояние тела определяется значением следующих параметров: давления p , объема V и температуры (масса тела или системы, как правило, известна).
Видео:Как понять что вещество выпадает в осадок или образуется газСкачать

Что такое идеальный газ
Уравнение состояния так называемого идеального газа является простым, но достаточно информативным.
Идеальный газ – это газ, в котором пренебрегают взаимодействием молекул между собой.
Идеальными считают разреженные газы. Особенно близки к идеальным газы гелий и водород. Идеальный газ – это упрощенная математическая модель реального газа: молекулы движутся хаотически, а соударения между молекулами и удары молекул о стенки сосуда упругие, не приводящие к потерям энергии в системе. Подобная упрощенная модель весьма удобна, поскольку не требует учета силы взаимодействия между молекулами газа. Множество реальных газов не отличаются в своем поведении от идеального газа в условиях, когда суммарный объем молекул пренебрежимо мал в сравнении с объемом сосуда (то есть при атмосферном давлении и комнатной температуре). Это дает возможность применять уравнение состояния идеального газа для сложных расчетов.
Уравнение состояния идеального газа запишем несколько раз ( 2 ) , ( 3 ) , ( 5 ) :
p V = m μ R T = ν R T ( 2 ) .
Уравнение ( 2 ) – уравнение Менделеева-Клапейрона, где m – это масса газа, μ – это молярная масса газа, R = 8 , 31 Д ж м о л ь · К – это универсальная газовая постоянная, ν – это число молей вещества.
где N – это количество молекул газа в массе m , k = 1 , 38 · 10 — 23 Д ж К , постоянная Больцмана, определяющая «долю» газовой постоянной, которая приходится на 1 молекулу и
N A = 6 , 02 · 10 23 м о л ь — 1 – это постоянная Авогадро.
Если поделить в ( 4 ) обе части на V , то получаем следующий вид записи уравнения состояния идеального газа:
где n = N V – это количество частиц в единице объема или же концентрация частиц.
Видео:Разница между пропан - бутаном и метаномСкачать

Что такое реальный газ
Рассмотрим теперь более сложные системы: неидеальные газы и жидкости.
Реальный газ – это газ, между молекулами которого наблюдаются заметные силы взаимодействия.
Необходимо учитывать, что в неидеальных, плотных газах взаимодействие молекул высоко. Известно, что взаимодействие молекул очень сильно усложняет физическую картину, потому точную формулу уравнения состояния неидеального газа не получается записать в простом виде. В данном случае прибегают к приближенным формулам, найденным полу-эмпирическим путем. Самая удачная формула – это уравнение Ван-деp-Ваальса.
Взаимодействие молекул обладает сложным характером. На достаточно больших расстояниях между молекулами действуют силы притяжения. С уменьшением расстояния силы притяжения вначале растут, однако потом уменьшаются и преобразуются в силы отталкивания. Притяжение и отталкивание молекул будем рассматривать и учитывать отдельно. Уравнение Ван-дер-Ваальса, которое описывает состояние одного моля реального газа, имеет вид:
p + a V μ 2 V μ — b = R T ( 6 ) ,
где a V μ 2 – это внутреннее давление, обусловленное силами притяжения между молекулами, b – это поправка на собственный объем молекул, учитывающая действие сил отталкивания между молекулами, при этом:
b = N A 2 3 πd 3 ( 7 ) ,
где d – это диаметр молекулы. Значение a рассчитывается по формуле:
a = — 2 πN A 2 ∫ d ∞ W p ( r ) r 2 dr ( 8 ) ,
где W p ( r ) – это потенциальная энергия притяжения 2 -х молекул.
При увеличении объема значение поправок в уравнении ( 6 ) становится менее существенным. И в пределе уравнение ( 6 ) превращается в уравнение ( 2 ) . Это согласовано с тем фактом, что с уменьшением плотности реальные газы по своим характеристикам приближаются к идеальным.
Положительным в уравнении Ван-деp-Ваальса является тот факт, что данное равенство при очень больших плотностях приблизительно описывает также и свойства жидкости, в частности, плохую ее сжимаемость. Потому существует основание предполагать, что уравнение Ван-деp-Ваальса позволяет отразить и переход от жидкости к газу (либо от газа к жидкости).
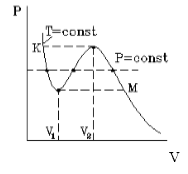
На рисунке 1 представлена изотерма Ван-дер-Ваальса для некоторого постоянного значения температуры T , которая построена из соответствующего уравнения.
В месте “извилины” (участок КМ) изотерма 3 раза пересекает изобару. На участке
V 1 , V 2 давление увеличивается с ростом объема.
Подобная зависимость невозможна. Это означает, что в этой области с веществом происходит что-то необыкновенное. Что именно, не видно в уравнении Ван-деp-Ваальса. Обратимся к опыту. В месте “извилины” на изотерме в состоянии равновесия вещество расслаивается на 2 фазы: жидкую и газообразную. Обе фазы существуют одновременно и находятся в фазовом равновесии. В таком состоянии происходит испарение жидкости и конденсация газа. Процессы протекают с такой интенсивностью, что полностью компенсируют друг друга: объем жидкости и газа со временем не изменяется.
Газ, который находится в фазовом равновесии со своей жидкостью, называется насыщенным паром. Если фазовое равновесие отсутствует, отсутствует также компенсация испарения и конденсации, тогда газ называется ненасыщенным паром.
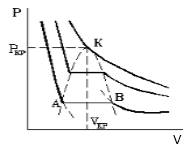
Что происходит с изотермой в области двухфазного состояния вещества (то есть в месте «извилины» изотермы Ван-деp-Ваальса)? Эксперимент показывает, что в этом месте при изменении объема давление остается неизменным. График изотермы идет параллельно оси V (рисунок 2 ).
С увеличением температуры участок двухфазных состояний на изотермах уменьшается до тех пор, пока не превращается в точку (рисунок 2 ). Это особая точка К , в которой исчезает разница между жидкостью и паром. Ее называют критической точкой.
Параметры, которые соответствуют критическому состоянию, являются критическими (критическая температура, критическое давление, критическая плотность вещества).
Необходимо найти величину n . В процессе, представленном на рисунке 3 , давление p
Из графика, приведенного на рисунке 3 , запишем уравнение процесса в параметрах p ( V ) :
С учетом уравнения Менделеева-Клайперона:
V вместо объема, получаем:
Моль кислорода охлаждают до — 100 ° C . Необходимо определить давление, которое оказывает газ на стенки сосуда, если занимаемый газом объем V = 0 , 1 л . Необходимо также сравнить p с давлением идеального газа p i d , если бы кислород вел себя как идеальный газ. Величина постоянных Ван-дер-Ваальса a и b , для кислорода a = 0 , 1358 П а · м 6 / м о л ь 2 , b = 3 , 167 · 10 — 5 м 3 / м о л ь .
Из уравнения Ван-Дер-Ваальса имеем:
p = R T V μ — b — a V μ 2
Переведем температуру в систему измерения: T = t + 273 , По условию T = 173 K , V = 0 , 1 л = 10 — 4 м 3 .
Произведем расчет: p = 8 , 31 · 173 ( 10 — 3 , 2 ) · 10 — 5 — 0 , 1358 ( 10 — 4 ) 2 = 75 , 61 · 10 5 ( П а ) .
Для идеального газа:
Рассчитаем: p i d = 1 · 8 , 31 · 173 10 — 4 = 143 · 10 5 ( П а ) .
💡 Видео
ГБО II, IV и V поколения. Отличия. Почему расход разный? Почему мощность разная?Скачать

Отличия ГБО 4 и 5 поколения - что такое жидкий впрыск?Скачать

Как это устроено? Путь газа: анатомия газового промыслаСкачать

Угарный газ. Жизненно важная информация.Скачать

Что такое сжиженный газ? | Разница сжиженного и природного газаСкачать

Что такое природный газ? Просто о сложномСкачать

Реология материалов. ВведениеСкачать