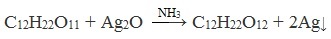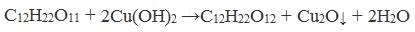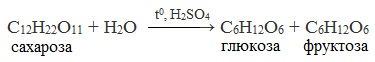Средняя оценка: 4.3
Всего получено оценок: 343.
Средняя оценка: 4.3
Всего получено оценок: 343.
Привычный сладкий сахар, используемый в быту, называется сахарозой. Это олигосахарид, относящийся к группе дисахаридов. Формула сахарозы – C12H22O11.
- Строение
- Получение
- Физические свойства
- Химические свойства
- Применение
- Что мы узнали?
- C12h22o11 cu oh 2 при нагревании уравнение
- Биологическая роль сахарозы
- Строение сахарозы
- Физические свойства сахарозы и нахождение в природе
- Химические свойства
- Получение сахарозы
- Применение сахарозы
- Основные сведения о сахарозе: строение, формула вещества
- Характеристика сахарозы
- Физические свойства сахарозы
- Химические свойства сахарозы. Химические реакции (уравнения) сахарозы
- Формула, молекула, строение сахарозы
- Получение и производство сахарозы
- Применение сахара в производстве
- 🌟 Видео
Видео:How to Balance C12H22O11 + O2 = CO2 + H2O (Sucrose + Oxygen gas)Скачать

Строение
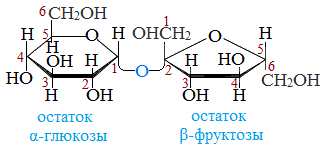
В состав молекулы входят остатки двух циклических моносахаридов – α-глюкоза и β-фруктоза. Структурная формула вещества состоит из циклических формул фруктозы и глюкозы, соединённых атомом кислорода. Структурные единицы связаны вместе гликозидной связью, образующейся между двумя гидроксилами.

Молекулы сахарозы образуют молекулярную кристаллическую решетку.
Видео:Качественная реакция с Cu(OH)2Скачать

Получение
Сахароза – наиболее распространённый в природе углевод. Соединение входит в состав фруктов, ягод, листьев растений. Большое количество готового вещества содержится в свёкле и сахарном тростнике. Поэтому сахарозу не синтезируют, а выделяют с помощью физического воздействия, вываривания и очищения.
Свёклу или сахарный тростник мелко натирают и помещают в большие котлы с горячей водой. Сахароза вымывается, образуя сахарный раствор. В нём присутствуют различные примеси – красящие пигменты, белки, кислоты. Чтобы отделить сахарозу, в раствор добавляют гидроксид кальция Ca(OH)2. В результате образуется осадок и сахарат кальция С12Н22О11·CaO·2Н2О, через который пропускают диоксид углерода (углекислый газ). В осадок выпадает карбонат кальция, а оставшийся раствор выпаривают до образования кристалликов сахара.
Видео:Разложение гидроксида меди II (Cu(OH)2 = CuO + H2O)Скачать

Физические свойства
Основные физические характеристики вещества:
- молекулярная масса – 342 г/моль;
- плотность – 1,6 г/см 3 ;
- температура плавления – 186°С.

Если расплавленное вещество продолжить нагревать, сахароза начнёт разлагаться с изменением окраски. При застывании расплавленной сахарозы образуется карамель – аморфное прозрачное вещество. В 100 мл воды при нормальных условиях можно растворить 211,5 г сахара, при 0°С – 176 г, при 100°С – 487 г. В 100 мл этанола при нормальных условиях сахар можно растворить только 0,9 г сахара.
Попадая в кишечник животных и человека, сахароза под действием ферментов быстро распадается на моносахариды.
Видео:Разбор, детальное объяснение цепочек превращений, Cu CuCl2 Cu(NO3)2 Cu(OH)2 CuO CuSO4 CuS SO2 H2SO3Скачать

Химические свойства
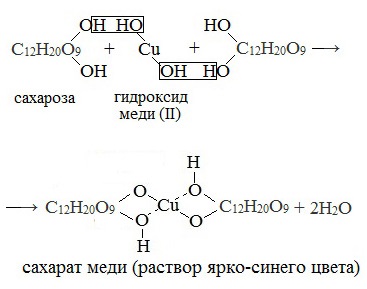
В отличие от глюкозы сахароза не проявляет свойства альдегида за счёт отсутствия альдегидной группы -CHO. Поэтому качественная реакция «серебряного зеркала» (взаимодействие с аммиачным раствором Ag2O) не идёт. При окислении гидроксидом меди (II) образуется не красный оксид меди (I), а ярко-синий раствор.
Основные химические свойства описаны в таблице.
Реакция
Описание
Уравнение
Качественная реакция на наличие гидроксильных групп
Реагирует с гидроксидом меди (II) с образованием сахарата меди ярко-синего цвета
Реакция идёт при нагревании в присутствии катализатора (серной или соляной кислоты). Сахароза разлагается на молекулы фруктозы и глюкозы
Сахароза не способна окисляться (не является восстановителем в реакциях) и называется невосстанавливающим сахаром.
Видео:Окисление метаналя HCHO + Cu(OH)2 → и муравьиной кислоты HCOOH + [Ag(NH3)2]OH → ХИМИЯ ЕГЭ 10 классСкачать
![Окисление метаналя HCHO + Cu(OH)2 → и муравьиной кислоты HCOOH + [Ag(NH3)2]OH → ХИМИЯ ЕГЭ 10 класс](https://i.ytimg.com/vi/JmXSmUSQZmU/0.jpg)
Применение
Сахар в чистом виде используется в пищевой промышленности для изготовления искусственного мёда, сладостей, кондитерских изделий, алкоголя. Сахарозу используют для получения различных веществ: лимонной кислоты, глицерина, бутанола.
В медицине сахарозу используют для изготовления микстур и порошков, чтобы скрыть неприятный вкус.
Видео:Cu(OH) - родственник Cu(OH)2Скачать

Что мы узнали?
Сахароза или сахар – дисахарид, состоящий из остатков глюкозы и фруктозы. Обладает сладким вкусом, легко растворяется в воде. Вещество выделяют из свёклы и сахарного тростника. Сахароза обладает меньшей активностью, чем глюкоза. Подвергается гидролизу, реагирует с гидроксидом меди (II), образуя сахарат меди, не окисляется. Сахар используют в пищевой, химической промышленности, медицине.
Видео:Качественная Реакция На Альдегиды С Гидроксидом Меди.Скачать

C12h22o11 cu oh 2 при нагревании уравнение
Примером наиболее распространенных в природе дисахаридов (олигосахаридом) является сахароза (свекловичный или тростниковый сахар).
Биологическая роль сахарозы
Наибольшее значение в питании человека имеет сахароза, которая в значительном количестве поступает в организм с пищей. Подобно глюкозе и фруктозе сахароза после расщепления ее в кишечнике быстро всасывается из желудочно-кишечного тракта в кровь и легко используется как источник энергии.
Важнейший пищевой источник сахарозы — сахар.
Строение сахарозы
Молекулярная формула сахарозы С12Н22О11 .
Сахароза имеет более сложное строение, чем глюкоза. Молекула сахарозы состоит из остатков молекул глюкозы и фруктозы в их циклической форме. Они соединены друг с другом за счет взаимодействия полуацетальных гидроксилов (1→2) -гликозидной связью, то есть свободный полуацетальный (гликозидный) гидроксил отсутствует:
Физические свойства сахарозы и нахождение в природе
Сахароза (обыкновенный сахар) – белое кристаллическое вещество, более сладкое, чем глюкоза, хорошо растворимое в воде.
Температура плавления сахарозы 160°C. При застывании расплавленной сахарозы образуется аморфная прозрачная масса – карамель.
Сахароза является весьма распространённым в природе дисахаридом, она встречается во многих фруктах, плодах и ягодах. Особенно много ее содержится в сахарной свёкле (16-21%) и сахарном тростнике (до 20%), которые и используются для промышленного производства пищевого сахара.
Содержание сахарозы в сахаре 99,5%. Сахар часто называют «носителем пустых калорий», так как сахар – это чистый углевод и не содержит других питательных веществ, таких, как, например, витамины, минеральные соли.
Химические свойства
Для сахарозы характерны реакции по гидроксильным группам.
1. Качественная реакция с гидроксидом меди (II)
Наличие гидроксильных групп в молекуле сахарозы легко подтверждается реакцией с гидроксидами металлов.
Видеоопыт «Доказательство наличия гидроксильных групп в сахарозе»
Если раствор сахарозы прилить к гидроксиду меди (II), образуется ярко-синий раствор сахарата меди (качественная реакция многоатомных спиртов):
2. Реакция окисления
Восстанавливающие дисахариды
Дисахариды, в молекулах которых сохраняется полуацетальный (гликозидный) гидроксил (мальтоза, лактозы), в растворах частично превращаются из циклических форм в открытые альдегидные формы и вступают в реакции, характерные для альдегидов: реагируют с аммиачным раствором оксида серебра и восстанавливают гидроксид меди (II) до оксида меди (I). Такие дисахариды называются восстанавливающими (восстанавливают Cu (OH)2 и Ag2O).
Реакция «серебряного зеркала»
Реакция с гидроксидом меди (II)
Невосстанавливающий дисахарид
Дисахариды, в молекулах которых нет полуацетального (гликозидного) гидроксила (сахароза) и которые не могут переходить в открытые карбонильные формы, называются невосстанавливающими (не восстанавливают Cu (OH)2 и Ag2O).
Сахароза, в отличие от глюкозы, не является альдегидом. Сахароза, находясь в растворе, не вступает в реакцию «серебряного зеркала» и при нагревании с гидроксидом меди (II) не образует красного оксида меди (I), так как не способна превращаться в открытую форму, содержащую альдегидную группу.
Видеоопыт «Отсутствие восстанавливающей способности сахарозы»
3. Реакция гидролиза
Для дисахаридов характерна реакция гидролиза (в кислой среде или под действием ферментов), в результате которой образуются моносахариды.
Сахароза способна подвергаться гидролизу (при нагревании в присутствии ионов водорода). При этом из одной молекулы сахарозы образуется молекула глюкозы и молекула фруктозы:
Видеоопыт «Кислотный гидролиз сахарозы»
Мальтоза и лактоза при гидролизе расщепляются на составляющие их моносахариды за счёт разрыва связей между ними (гликозидных связей):
Таким образом, реакция гидролиза дисахаридов является обратной процессу их образования из моносахаридов.
В живых организмах гидролиз дисахаридов происходит при участии ферментов.
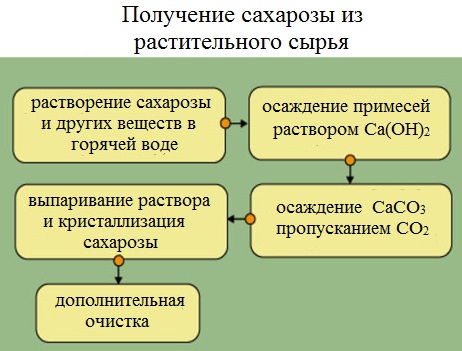
Получение сахарозы
Сахарную свеклу или сахарный тростник превращают в тонкую стружку и помещают в диффузоры (огромные котлы), в которых горячая вода вымывает сахарозу (сахар).
Вместе с сахарозой в водный раствор переходят и другие компоненты (различные органические кислоты, белки, красящие вещества и др.). чтобы отделить эти продукты от сахарозы, раствор обрабатывают известковым молоком (гидроксидом кальция). В результате этого образуются малорастворимые соли, которые выпадают в осадок. Сахароза образует с гидроксидом кальция растворимый сахарат кальция С12Н22О11·CaO·2Н2О.
Для разложения сахарата кальция и нейтрализации избытка гидроксида кальция через раствор пропускают оксид углерода ( IV).
Выпавший в осадок карбонат кальция отфильтровывают, а раствор упаривают в вакуумных аппаратах. По мере образования кристалликов сахара отделяют с помощью центрифуги. Оставшийся раствор – меласса – содержит до 50% сахарозы. Его используют для производства лимонной кислоты.
Выделенную сахарозу очищают и обесцвечивают. Для этого ее растворяют в воде и полученный раствор фильтруют через активированный уголь. Затем раствор снова упаривают и кристаллизуют.
Применение сахарозы
Сахароза в основном используется как самостоятельный продукт питания (сахар), а также при изготовлении кондитерских изделий, алкогольных напитков, соусов. Ее используют в высоких концентрациях в качестве консерванта. Путем гидролиза из нее получают искусственный мёд.
Сахароза находит применение в химической промышленности. С помощью ферментации из нее получают этанол, бутанол, глицерин, левулиновую и лимонную кислоты, декстран.
В медицине сахарозу используют при изготовлении порошков, микстур, сиропов, в том числе для новорожденных детей (для придания сладкого вкуса или консервации).
Видео:Получение гидроксида меди (II) и растворение его в кислотахСкачать

Основные сведения о сахарозе: строение, формула вещества
Видео:Получение и превращения гидроксидов железа Fe(OH)2 и Fe(OH)3Скачать

Характеристика сахарозы
Сахароза (сахар, sucrose или тростниковый сахар) — углевод, дисахарид природного происхождения. Углеводы — главный источник энергии в организме. Человек и животные не могут синтезировать их самостоятельно, поэтому запас пополняется за счет употребления растительных пищевых продуктов.
Сахароза в небольших количествах (менее 0,4 г на 100 г продукта) вместе с глюкозой присутствует в плодах и листьях многих зеленых растений. В результате обменных процессов, протекающих в клетках, остатки глюкозы образуют резервный полисахарид — крахмал. Когда основная часть глюкозы в крахмале израсходована, он переходит в сахарозу.
Высоким содержанием сахарозы отличаются:
- сок стеблей сахарного тростника 14-19 %; корни сахарной свеклы 16-21 %;
- фрукты: абрикосы до 11 %, слива до 8 %; апельсины до 6 %; яблоки, груши до 5 %;
- овощи: лук до 8 %, морковь 4-6 %;
- зародыши семян зерновых культур, например, маис до 14 % и сорго до 11 %;
- сок деревьев около 20 %, например, сахарный клен и различные виды пальм, в том числе кокосовая и финиковая.
Рисунок 1. Кристаллы сахарозы.
Физические свойства сахарозы
| Физическая характеристика | Простое вещество | Примечание |
| Цвет | белый кристаллический порошок | |
| Вкус, запах | сладкий, без запаха | |
| Растворимость в воде при 20 °С | 204 г в 100 мл | с ростом температуры растворимость увеличивается |
| Плотность | 1 , 59 г / с м 3 | |
| Т плавления | 186 °С | при застывании расплава образуется карамель |
| Т кипения раствора | 101 °С | |
| Молярная масса | 342,3 г/моль |
Таблица 1. Физические свойства сахарозы.
Из-за низкой температуры плавления быстро становится жидкой и тягучей.
Имеет изомеры с молекулярной формулой С 12 Н 22 О 11 — мальтозу и лактозу.
Видео:Реакция глюкозы с гидроксидом меди (II)Скачать

Химические свойства сахарозы. Химические реакции (уравнения) сахарозы
1. Как многоатомный спирт, к примеру, глицерин или глюкоза, сахароза имеет гидроксильные группы. Это проявляется в способности сахарозы реагировать с гидроксидами металлов.
Например, качественная реакция на сахарозу: бесцветный раствор сахарозы при реакции с C u ( O H ) 2 становится ярко-синим:
C 12 H 22 O 5 + C u ( O H ) 2 → ( C 12 H 20 O 5 ) C u ярко-синий сахарат меди (II) + 2 H 2 O .
2. Сахароза является невосстанавливающим дисахаридом и не обладает свойствами альдегидов, поэтому не идут реакции:
- «серебряного зеркала» при нагревании с аммиачным раствором оксида серебра (I);
- образования красного раствора оксида меди (I) при нагревании с гидроксидом меди (II);
- полного окисления.
3. Гидролиз сахарозы идет при кипячении с добавлением серной кислоты:
C 12 H 22 O 11 + H 2 O → t ° , H 2 S O 4 C 6 H 12 O 6 + C 6 H 12 O 6 .
В результате реакции образуется смесь двух моносахаридов — глюкозы и фруктозы.
В живых организмах гидролиз сахарозы происходит при участии ферментов.
4. Горение и обугливание сахарозы проходит в присутствии солей лития.
C 12 H 22 O 11 + 12 O 2 → с о л и L i 12 C O 2 + 11 H 2 O .
Видео:Качесвтная реакция ГЛЮКОЗЫ(C6H12O6) и ГИДРОКСИДА МЕДИ(Cu(OH)2) .Скачать

Формула, молекула, строение сахарозы
В химии сахароза имеет формулу C 12 H 22 O 11 .
Сахароза — это дисахарид, в состав которого входят остатки глюкозы и фруктозы, соединенные атомом кислорода O-глюкозидным типом связи.
Рисунок 2. Строение сахарозы.
Структура молекулы сахарозы: молекулярная кристаллическая решетка.
Видео:Получение КУПРАТА Натрия - Na2CuO2. Реакция Гидроксида Меди(2) и Гидроксида Натрия.Скачать

Получение и производство сахарозы
Способы производства сахарозы основаны на выделении сока из растений и получении из него сначала раствора, а затем кристаллической сахарозы.
Рассмотрим на схеме получения сахарозы из свеклы.
Продукт измельчают в тонкую стружку, помещают в большие котлы (диффузоры). Через них пропускают горячую воду, которая вымывает сахарозу в виде раствора.
В нем присутствуют различные примеси, в том числе органические кислоты с общей формулой R-COOH.
Чтобы отделить их от сахарозы, в раствор добавляют известковое молоко (гидроксид кальция) C a ( O H ) 2 . Параллельно идут две реакции:
- 2 R — C O O H + C a ( O H ) 2 → ( R — C O O ) 2 C a ↓ + 2 H 2 O и
- С 12 Н 22 О 11 + C a ( O H ) 2 → С 12 Н 22 О 11 C a сахарат кальция + 2 H 2 O .
Затем через раствор сахарата кальция пропускают диоксид углерода (углекислый газ):
С 12 Н 22 О 11 C a + C O 2 + H 2 O → С 12 Н 22 О 11 + C a C O 3 ↓ .
Осадок карбоната кальция отфильтровывают, а раствор сахарозы упаривают в вакуумных аппаратах до образования кристалликов сахара. Получается сахар-сырец желтого цвета.
Далее его очищают и обесцвечивают: растворяют в воде и полученный раствор фильтруют через активированный уголь. Затем раствор снова упаривают и кристаллизуют, получая на выходе очищенный сахар или рафинад.
Видео:Опыты по химии. Окисление муравьиного альдегида гидроксидом меди (II)Скачать

Применение сахара в производстве
- Пищевые производства: в качестве продукта питания; компонента кондитерских изделий, алкогольных напитков, соусов и искусственного меда. Растворы с высоким содержанием сахарозы — консервант при производстве фруктово-овощных заготовок.
- Химическая отрасль: как субстрат при ферментации этанола, глицерина, бутанола, левулиновой и лимонной кислот.
- Фармакология: тростниковый сахар используют при изготовлении лекарственных средств (сиропов, порошков), главным образом, для детей (как консервант, а также для маскировки горького или неприятного привкуса).
Биологическая функция в организме: сахароза — источник энергии. Она быстро расщепляется в пищеварительном тракте на глюкозу и фруктозу, легко проникает в кровь. Сахароза необходима для образования жира, гликогена, белково-углеродных соединений.
В умеренных количествах (до 40 грамм в день) оказывает благоприятное влияние на организм:
- активизирует работу головного мозга;
- снабжает клетки энергией;
- защищает печень от токсинов.
Однако чрезмерное употребление сахара, особенно в детском возрасте, повышает риск возникновения кариеса и диабета, ведет к ожирению.
🌟 Видео
Опыты по химии. Взаимодействие сахарозы с гидроксидом меди (II)Скачать

Реакция перхлората калия с сахаром | C12H22O11 + 6KClO4 = 12CO2 + 11H2O + 6KClСкачать

Качественная реакция на альдегиды с гидроксидом медиСкачать

Опыты по химии. Получение гидроксида меди (II) и изучение его свойствСкачать

🥶Гидроксид меди(II) - синий осадок,красотища какая!) #красотища #химия #эксперимент #опыт #реакцияСкачать

Взаим-вие многоатомных спиртов с гидроксидом медиСкачать

Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать