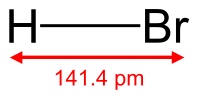
Бромоводородная кислота (другое название бромоводород) — это неорганическое соединение водорода (H) с бромом (Br). Это бесцветный газ, который во влажном воздухе образует густой туман.
Какие существуют способы получения бромоводорода
По причине высокой степени окисляемости бромоводороной кислоты, ее нельзя получить посредством воздействия серной кислоты концентрированной на бромиды металлов щелочных. Происходит следующая реакция:
2KBr (бромид калия) + 2Н2SO4 (кислота серная) = К2SO4 (калия сульфат) + SO2 (оксид серы) + Br2 (молекула брома) + 2Н2О (вода)
1. В промышленности получение кислот, таких как бромоводородная, осуществляется посредством реакции, в ходе которой взаимодействуют составляющие элементы. Например, рассматриваемое нами вещество можно получить следующим способом:
H2 (молекула водорода) + Br2 (молекула брома) = 2HBr (бромоводородная кислота)
Эта реакция осуществима при температуре от 200 до 400 градусов.
2. Также возможно получение бромоводородной кислоты и в лабораторных условиях несколькими способами.
— посредством гидролиза пентабромида фосфора или трибромида:
PBr3 (трибромид) + 3H2O (три молекулы воды) = H3PO3 (кислота фосфорная) + 3HBr (бромоводородная кислота, формула химическая)
PBr5 (пентабромид) + 4H2O (четыре молекулы воды) = H3PO4 (кислота фосфорная) + 5HBr (бромоводород)
— путем восстановления брома:
3Br2 (три молекулы брома) + S (сера) + 4H2O (вода) = (реакция возможна при температуре, равной 100-150 градусов) H2SO4 (серная кислота) + 6HBr (бромоводород)
3Br2 (три молекулы брома) + KNO2 (калия нитрит) + 4H2O (вода) = KNO3 (нитрат калия) + 2HBr (бромоводород)
— посредством вытеснения разбавленной кислотой щелочных металлов из бромидов:
KBr (бромистый калий) + H2SO4 (серная кислота) = KHSO4 (калия гидросульфат) + HBr (выделяется в виде газа)
3. Как побочный продукт бромистый водород можно получить при синтезе органических бромопроизводных соединений.
Физические свойства бромоводорода:
1. Бромоводородная кислота — это газ без цвета, имеющий неприятный и резкий запах. Сильно дымится на воздухе. Обладает высокой устойчивостью к температурам.
2. Хорошо растворяется в H2O (вода) и этаноле с образованием электролита. Водный раствор бромоводорода образует азеотропную смесь, которая кипит при температуре 124 градуса. В одном литре воды растворяется около полулитра бромводорода (при 0 градусов).
3. В процессе охлаждения водного раствора бромистого водорода можно получить следующие кристаллогидраты: HBr*H2O, HBr*2H2O, HBr*4H2O.
4. Чистый бромоводород образует кристаллы сингонии орторомбической, пространственной группы F mmm.
5. При температуре -66,8 градусов переходит в жидкое состояние, а при — 87 градусов затвердевает.
Химические свойства бромоводорода:
1. Бромоводородная кислота при взаимодействии с водой образует сильную кислоту одноосновную. Эта реакция выглядит так:
HBr + H2O (вода) = Br- (анион брома) + H3O+ (ион гидроксония)
2. Данное вещество устойчиво к высоким температурам, однако, при 1000 градусах около 0,5% всех молекул разлагаются:
2HBr (бромоводородная кислота) = H2 (молекула водорода) + Br2 (молекула брома)
3. Рассматриваемое нами химическое соединение реагирует с различными металлами, а также их основаниями и оксидами. Примеры реакций:
2HBr + Mg (магний) = MgBr2 (бромид магния) + H2 (выделяется в виде газа)
2HBr + CaO (кальция оксид) = CaBr2 (бромид кальция) + H2O (вода)
HBr + NaOH (натрия гидроксид) = NaBr (бромид натрия) + H2O (вода)
4. Бромоводород также является восстановителем. На воздухе медленно окисляется. По этой причине его водные растворы через некоторое время окрашиваются в бурый цвет. Реакция будет такая:
4HBr (бромоводородная кислота) + O2 (молекула кислорода) = 2Br2 (молекула брома) + 2H2O (вода)
Применение
Бромоводород используют для создания (синтеза) различных органических производных брома и для приготовления бромидов различных металлов. Особенное значение имеет бромид серебра, так как он используется в производстве кинофотоматериалов.
Как производится транспортировка
В баллонах емкостью 68 или 6,8 литров под давлением в 24 атмосферы.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Видео:Реакции металлов с кислородом и водой. 8 класс.Скачать  Бромоводород
Бромоводород (HBr) — соединение брома с водородом. Бесцветный тяжёлый токсичный газ, образует туман в сыром воздухе. Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать  Содержание
Видео:ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать  ПолучениеВ промышленности бромоводород получают непосредственным взаимодействием простых веществ: Также бромистый водород получается как побочный продукт при синтезе бромпроизводных органических соединений В лаборатории получают гидролизом трибромида или пентабромида фосфора: Восстановление брома несколькими способами: Вытеснение из бромидов щелочных металлов разбавленной кислотой: Видео:Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать  Физические свойстваБромистый водород — это бесцветный ядовитый газ с резким запахом, сильно дымящий на воздухе. Термически очень устойчив. Хорошо растворим в воде: 221 г/100 г воды при 0 °C (193 при 25°, 130 при 100 °C). Водный раствор образует азеотропную смесь с 47,63 % HBr, которая кипит при 124,3 °C. Растворяется в этаноле, образуя слабый электролит. При охлаждении водных растворов HBr можно получить кристаллогидраты:
Чистый HBr образует кристаллы орторомбической сингонии, пространственная группа F mmm, параметры при −173 °C a = 0,5640 нм, b = 0,6063 нм, c = 0,5555 нм, Z = 4. Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать  Химические свойстваВодный раствор бромистого водорода образует сильную одноосновную кислоту: Термически HBr очень устойчив, при температуре 1000 °C разлагаются около 0,5 % молекул: Как кислота реагирует с металлами, их оксидами, основаниями: Является восстановителем, медленно окисляется на воздухе, из-за чего водные растворы со временем окрашиваются в бурый цвет: Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать  ПрименениеПрименяют для приготовления бромидов, синтеза различных органических бромпроизводных и для реактивного ионного травления. Видео:Решение задач на термохимические уравнения. 8 класс.Скачать  ТранспортировкаБезводный HBr транспортируют в баллонах ёмкостью 6,8 и 68 кг под давлением 24 атм. Видео:Химия с нуля — Химические свойства АлкеновСкачать  ТоксичностьБромистый водород — едкое, весьма токсичное вещество, обладающее удушающим действием. Предельно допустимая концентрация = 10 мг/м³, поражающая токсодоза = 2,4 мг/л·мин. 📺 ВидеоРасстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать  ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать  Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать  8 класс. Массовая доля растворенного вещества. Решение задач.Скачать  Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Химия ПростоСкачать  ПОЛУЧЕНИЕ БРОМОВОДОРОДА. Реакция Бромида Натрия и Серной Кислоты. Реакция NaBr и H2SO4.Скачать  Экзо- и эндотермические реакции. Тепловой эффект химических реакций. 8 класс.Скачать  Химия | Тепловой эффект химической реакции (энтальпия)Скачать  Уравнивание реакций горения углеводородовСкачать  25. Схема реакции и химическое уравнениеСкачать  Гидролиз солей. 9 класс.Скачать  | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||