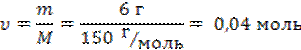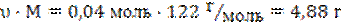Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Содержание
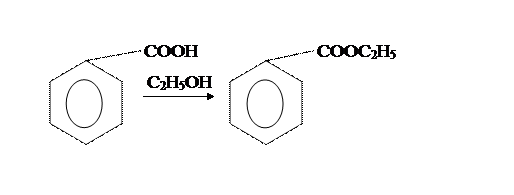
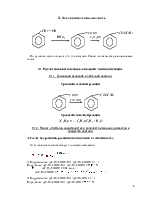
Видео:Химия, 11-й класс, Этанол. Получение, применение и биологическая рольСкачать  Этиловый эфир бензойной кислоты. Формула соединения и его названия. Основание выбора схемы синтеза соединенияСтраницы работыФрагмент текста работыМИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ РОССИЙСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ НЕФТИ И ГАЗА им. И.М. ГУБКИНА КАФЕДРА ОРГАНИЧЕСКОЙ ХИМИИ И ХИМИИ НЕФТИ по синтетическим методам органической химии «Этиловый эфир бензойной кислоты» Выполнил: студент группы ХТ-06-3 2.Теоретическая часть. 3 2.1. Формула соединения и его названия. 3 2.2. Физические свойства соединения. 3 2.3. Химические свойства соединения. 4 2.4. Применение соединения. 6 2.5. Методы получения этилбензоата. 6 2.6. Основание выбора схемы синтеза соединения. 7 3. Экспериментальная часть. 8 3.1. Расчет количеств исходных веществ по второй стадии. 8 3.1.1. Уравнение основной и побочной реакции. 8 3.1.2. Расчет и таблица характеристик и количеств исходных реагентов и продуктов реакции. 8 3.1.3. Описание синтеза [2] 9 3.1.4 Константы полученного соединения. 10 3.2. Расчет количеств исходных веществ по первой стадии. 10 3.2.1. Уравнение основной и побочной реакции. 10 3.2.2. Расчет и таблица характеристик и количеств исходных реагентов и продуктов реакции. 10 3.2.3. Описание синтеза [2] 11 3.2.5. Схема установки. 13 5. Используемая литература. 15 Видео:Бензойная кислотаСкачать  1. ВведениеПо окончанию лабораторного практикума по органической химии проводится литературный анализ. Целью литературного анализа является нахождение литературы по данному веществу, проведение синтеза вещества и анализ полученных результатов. Целью нашего синтеза является получение этилового эфира бензойной кислоты (6 г). Синтез проводится в две стадии (получение бензойной кислоты – первая стадия, получение этилового эфира бензойной кислоты – вторая стадия). Видео:Качественная реакция на этанолСкачать  2. Теоретическая частьВидео:Самый легкий способ уравнять ОВР в органике!Скачать  2.1. Формула соединения и его названияЭтиловый эфир бензойной кислоты (этилбензоат) Видео:НИТРОВАНИЕ БЕНЗОЛА, ТОЛУОЛА, БЕНЗОЙНОЙ КИСЛОТЫСкачать  2.2. Физические свойства соединения
Видео:Окисление Этанола Перманганатом Калия В Сернокислой Среде.Скачать  2.3. Химические свойства соединенияЭфиры – нейтральные и малоактивные соединения. Разбавленные кислоты, щелочи, металлический натрий и PCl5 на холоду на них не действует. [3] I. Реакции с участием эфирного кислорода: 1.1. Образование оксониевых соединений. Эфиры присоединяют кислоты к кислороду эфира за счет его неподеленных электронов: Образующиеся комплексные соли напоминают соли аммония. Оксониевые соли эфиров – обычные промежуточные продукты в их реакциях в присутствии кислот. [3] 1.2. Образование комплексных солей с различными солями:
II. Реакции сопровождающиеся гомолизом α- С-Н связи: 2.1. Взаимодействие с хлором:
2.2. Взаимодействие с нитрилами:
2.3. Взаимодействие с магний органическими соединениями:
2.4. Образование гидроперекиси:
III. Реакции расщепления по эфирному кислороду: 3.1. Металлический натрий при нагревании расщепляет эфиры: 3.2. Ацидолиз. Концентрированные кислоты (серная, йодистоводородная), а также некоторые другие реагенты (хлорное железо в уксусном ангидриде, ацетилтозилаты) расщепляют эфиры по механизму SN1 или SN2:
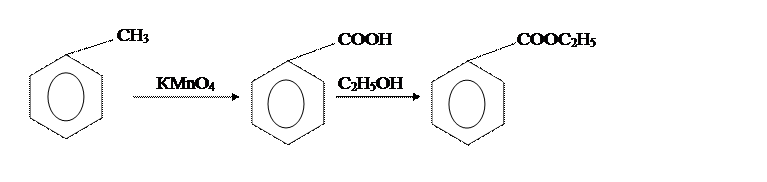
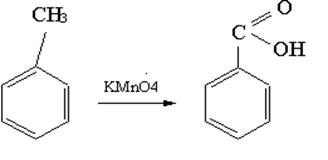
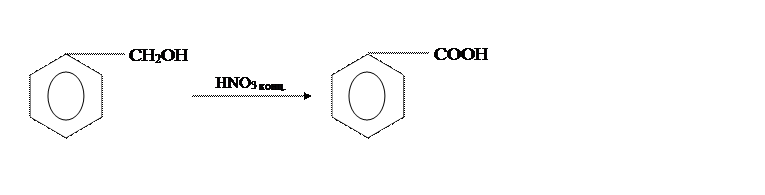
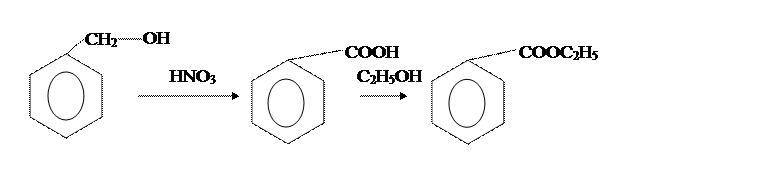
Видео:ПОЛУЧЕНИЕ Галогенпроизводных. Получение хлорэтана. Реакция Этанола, Хлорида Натрия и Серной КислотыСкачать  2.4. Применение соединенияЭтилбензоат применяют в парфюмерии. Используют как растворитель эфиров целлюлозы. В медицине его употребляют для усиления сердечной деятельности. [4] Видео:Ethanol Combustion Reaction Animation | Alcohols | Organic Chemistry | #shortsСкачать  2.5. Методы получения этилбензоатаВидео:Как решать ОРГАНИЧЕСКИЕ ЦЕПОЧКИ? Основные типы химических реакцийСкачать  Видео:Особенности проведения ЕГЭ 2020 по химии. Разбор типичных ошибокСкачать  Методы получения этилбензоата отличаются только различными способами получения бензойной кислоты и условиями провидения синтеза. Так, в [6] бензойную кислоту получают из толуола и КМnО4, по реакции:Видео:ГАЛОГЕНИРОВАНИЕ БЕНЗОЛА, ФЕНОЛА, БЕНЗОЙНОЙ КИСЛОТЫСкачать  В [2] бензойную кислоту получают из бензилового спирта и концентрированной НNO3, |
по реакции:
Вторая стадия отличается только способами провидения аппаративного оформления этерификации бензойной кислоты этиловым спиртом.
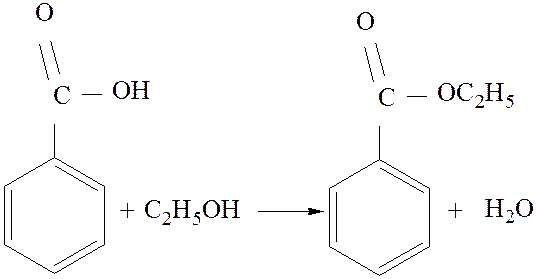 |
Видео:10 класс. Химия. Промышленное получение этилового спирта. 13.05.2020.Скачать

2.6. Основание выбора схемы синтеза соединения
Из приведенных методик наиболее оптимальна вторая. [2]
1) С учетом ограниченности времени, эта методика меньше времени занимает при ее проведении.
2) В лаборатории имеются все необходимые реактивы и приборы для проведения данной методики.
Видео:ЭтанолСкачать

3. Экспериментальная часть
Видео:increasing acid strength of #ethanol#phenol#water##benzoic acid with answer #viral #shortСкачать

По условию нужно получить 6 г этилбензоата. Расчет по обеим стадиям начинаем с конца.
Видео:Линия 3. От метана до бензойной кислоты или как решать органические цепочки?Скачать

3.1. Расчет количеств исходных веществ по второй стадии.
3.1.1. Уравнение основной и побочной реакции.
Уравнение основной реакции
Уравнение побочной реакции
Видео:РЕШАЕМ ВАРИАНТ УРОВНЯ ЕГЭ | ХИМИЯ ЕГЭ 2023Скачать

3.1.2. Расчет и таблица характеристик и количеств исходных реагентов и продуктов реакции.
А. Расчет по уравнению реакции (для получения 6 г этилбензоата):
6 г этилбензоата соответствует количество вещества:
По условию: υ(C6H5-COOC2H5) : υ(C6H5-COOH) = 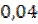
m(C6H5-COOH) =
По условию: υ(C6H5-COOC2H5) : υ(C2H5-OH) = 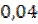
m(C2H5-OH) = 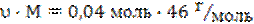
Б. Расчет количеств веществ по практикуму:
В практикуме Агрономова для получения 10 г этилбензоата используется 10 г бензойной кислоты, 26 г (33мл) этилового спирта, 1 мл H2SO4 (d=1,84):
Для синтеза 6 г этилбензоата требуется бензойной кислоты:
Для синтеза 6 г этилбензоата требуется этилового спирта:
Видео:Окисление этанола оксидом меди (II). Опыт 3Скачать

Бензойная кислота и этанол уравнение
Установите соответствие между реагирующими веществами и продуктом, который образуется при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТ ВЗАИМОДЕЙСТВИЯ | ||
| A | Б | В | Г |
A. Происходит реакция этерификации — продуктом является этилбензоат. (5)
Б. Метилфенилкетон можно получить действием бензола в присутствии кислоты Льюиса на ацетилхлорид (реакция Фриделя–Крафтса). (6)
В. Диизопропиловый эфир получают дегидратацией изопропилового спирта в присутствии серной кислоты (2)
Г. Хлорангидрид уксусной кислоты при взаимодействии с фенолом даст соответствующий сложный эфир — фенилацетат. (3)
📸 Видео
Ethanol into Formaldehyde#ethanol #formaldehyde #conversionСкачать

Выпадение осадка при перекристаллизации дибензилиденацетона в горячем этаноле.Скачать

Окисление ВСЕХ органических веществ за 4 часа | Химия ЕГЭ 2023 | УмскулСкачать




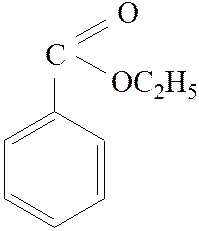
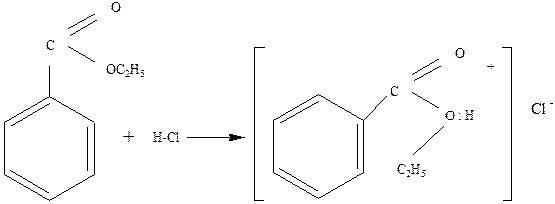
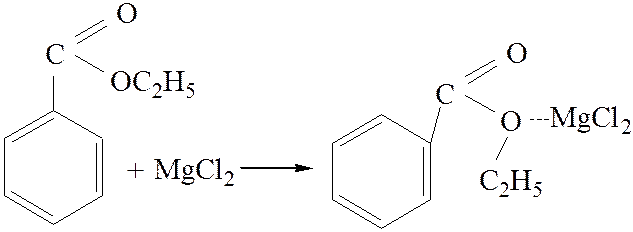 [4]
[4]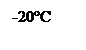
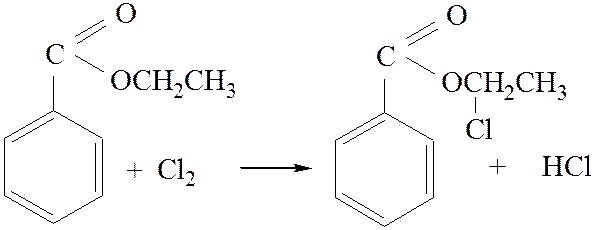 [4]
[4]
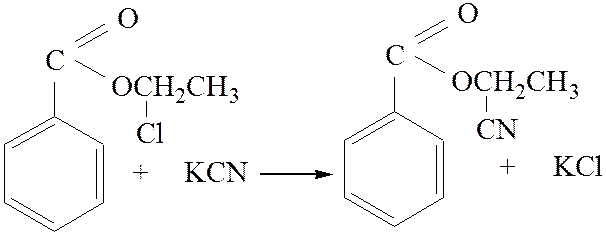 [4]
[4]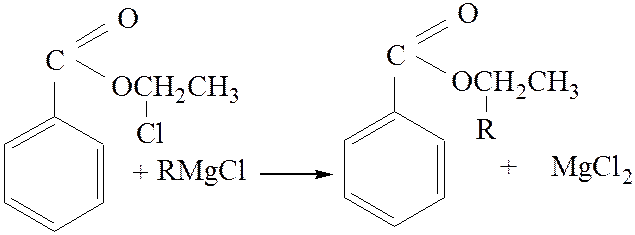 [4]
[4]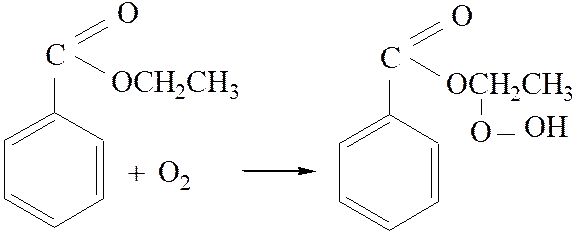 [4]
[4]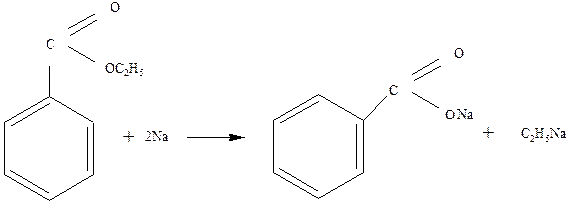
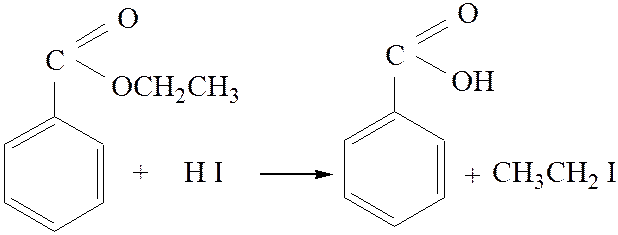 [3]
[3]