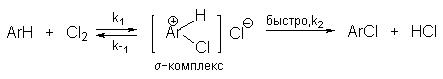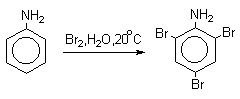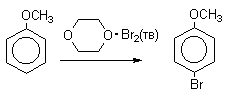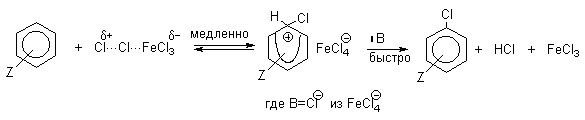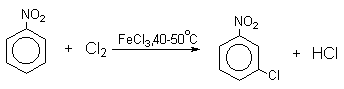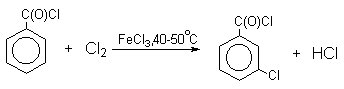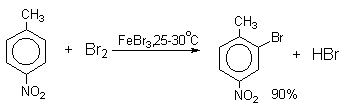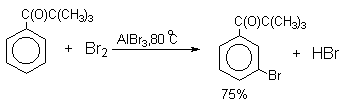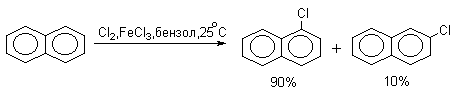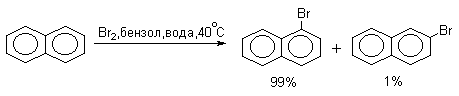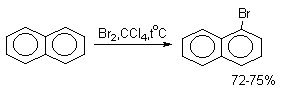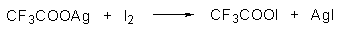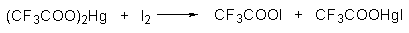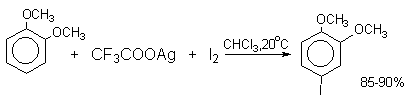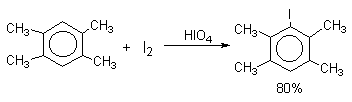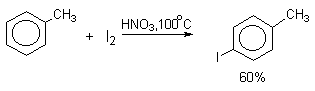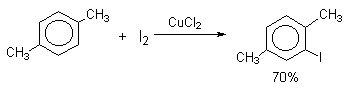Арены (ароматические углеводороды) – это непредельные (ненасыщенные) циклические углеводороды, молекулы которых содержат устойчивые циклические группы атомов (бензольные ядра) с замкнутой системой сопряженных связей.
Общая формула: CnH2n–6 при n ≥ 6.
- Химические свойства аренов
- 1. Реакции присоединения
- 1.1. Гидрирование
- 1.2. Хлорирование аренов
- 2. Реакции замещения
- 2.1. Галогенирование
- 2.2. Нитрование
- 2.3. Алкилирование ароматических углеводородов
- 2.4. Сульфирование ароматических углеводородов
- 3. Окисление аренов
- 3.1. Полное окисление – горение
- 3.2. О кисление гомологов бензола
- 4. Ориентирующее действие заместителей в бензольном кольце
- 5. Особенности свойств стирола
- Бензол br2 febr3 уравнение реакции
- Acetyl
- 🔥 Видео
Видео:Химические реакции #БЕНЗОЛ химические свойства, реакции.Скачать

Химические свойства аренов
Арены – непредельные углеводороды, молекулы которых содержат три двойных связи и цикл. Но из-за эффекта сопряжения свойства аренов отличаются от свойств других непредельных углеводородов.
Для ароматических углеводородов характерны реакции:
- присоединения,
- замещения,
- окисления (для гомологов бензола).
| Из-за наличия сопряженной π-электронной системы молекулы ароматических углеводородов вступают в реакции присоединения очень тяжело, только в жестких условиях — на свету или при сильном нагревании, как правило, по радикальному механизму |
| Бензольное кольцо представляет из себя скопление π-электронов, которое притягивает электрофилы. Поэтому для ароматических углеводородов характерны реакции электрофильного замещения атома водорода у бензольного кольца. |
Ароматическая система бензола устойчива к действию окислителей. Однако гомологи бензола окисляются под действием перманганата калия и других окислителей.
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

1. Реакции присоединения
Бензол присоединяет хлор на свету и водород при нагревании в присутствии катализатора.
1.1. Гидрирование
Бензол присоединяет водород при нагревании и под давлением в присутствии металлических катализаторов (Ni, Pt и др.).
При гидрировании бензола образуется циклогексан:
При гидрировании гомологов образуются производные циклоалканы. При нагревании толуола с водородом под давлением и в присутствии катализатора образуется метилциклогексан:
1.2. Хлорирование аренов
Присоединение хлора к бензолу протекает по радикальному механизму при высокой температуре, под действием ультрафиолетового излучения.
При хлорировании бензола на свету образуется 1,2,3,4,5,6-гексахлорциклогексан (гексахлоран).
Гексахлоран – пестицид, использовался для борьбы с вредными насекомыми. В настоящее время использование гексахлорана запрещено.
Гомологи бензола не присоединяют хлор. Если гомолог бензола реагирует с хлором или бромом на свету или при высокой температуре (300°C), то происходит замещение атомов водорода в боковом алкильном заместителе, а не в ароматическом кольце.
| Например, при хлорировании толуола на свету образуется бензилхлорид |
| Если у гомолога бензола боковая цепь содержит несколько атомов углерода – замещение происходит у атома, ближайшему к бензольному кольцу («альфа-положение»). |
| Например, этилбензол реагирует с хлором на свету |
Видео:Бензол. Механизм реакции электрофильного замещения. Нитрование бензола.Скачать

2. Реакции замещения
| Реакции замещения у ароматических углеводородов протекают по ионному механизму (электрофильное замещение). При этом атом водорода замещается на другую группу (галоген, нитро, алкил и др.). |
2.1. Галогенирование
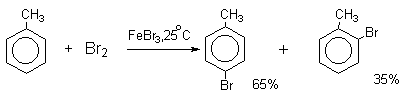
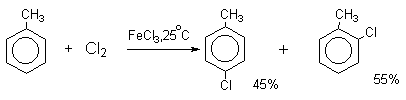
Бензол и его гомологи вступают в реакции замещения с галогенами (хлор, бром) в присутствии катализаторов (AlCl3, FeBr3).
При взаимодействии с хлором на катализаторе AlCl3 образуется хлорбензол:
Ароматические углеводороды взаимодействуют с бромом при нагревании и в присутствии катализатора – FeBr3 . Также в качестве катализатора можно использовать металлическое железо.
Бром реагирует с железом с образованием бромида железа (III), который катализирует процесс бромирования бензола:
| Гомологи бензола содержат алкильные заместители, которые обладают электронодонорным эффектом: из-за того, что электроотрицательность водорода меньше, чем углерода, электронная плотность связи С-Н смещена к углероду. На нём возникает избыток электронной плотности, который далее передается на бензольное кольцо. |
| Поэтому гомологи бензола легче вступают в реакции замещения в бензольном кольце. При этом гомологи бензола вступают в реакции замещения преимущественно в орто— и пара-положения |
| Например, при взаимодействии толуола с хлором образуется смесь продуктов, которая преимущественно состоит из орто-хлортолуола и пара-хлортолуола |
Мета-хлортолуол образуется в незначительном количестве.
При взаимодействии гомологов бензола с галогенами на свету или при высокой температуре (300 о С) происходит замещение водорода не в бензольном кольце, а в боковом углеводородном радикале.
| Если у гомолога бензола боковая цепь содержит несколько атомов углерода – замещение происходит у атома, ближайшему к бензольному кольцу («альфа-положение»). |
Например, при хлорировании этилбензола:
2.2. Нитрование
Бензол реагирует с концентрированной азотной кислотой в присутствии концентрированной серной кислоты (нитрующая смесь).
При этом образуется нитробензол:
| Серная кислота способствует образованию электрофила NO2 + : |
Толуол реагирует с концентрированной азотной кислотой в присутствии концентрированной серной кислоты.
В продуктах реакции мы указываем либо о-нитротолуол:
Нитрование толуола может протекать и с замещением трех атомов водорода. При этом образуется 2,4,6-тринитротолуол (тротил, тол):
2.3. Алкилирование ароматических углеводородов
- Арены взаимодействуют с галогеналканами в присутствии катализаторов (AlCl3, FeBr3 и др.) с образованием гомологов бензола.
| Например, бензол реагирует с хлорэтаном с образованием этилбензола |
- Ароматические углеводороды взаимодействуют с алкенами в присутствии хлорида алюминия, бромида железа (III), фосфорной кислоты и др.
| Например, бензол реагирует с этиленом с образованием этилбензола |
| Например, бензол реагирует с пропиленом с образованием изопропилбензола (кумола) |
- Алкилирование спиртами протекает в присутствии концентрированной серной кислоты.
| Например, бензол реагирует с этанолом с образованием этилбензола и воды |
2.4. Сульфирование ароматических углеводородов
Бензол реагирует при нагревании с концентрированной серной кислотой или раствором SO3 в серной кислоте (олеум) с образованием бензолсульфокислоты:
Видео:Бромирование БензолаСкачать

3. Окисление аренов
Бензол устойчив к действию даже сильных окислителей. Но гомологи бензола окисляются под действием сильных окислителей. Бензол и его гомологи горят.
3.1. Полное окисление – горение
При горении бензола и его гомологов образуются углекислый газ и вода. Реакция горения аренов сопровождается выделением большого количества теплоты.
Уравнение сгорания аренов в общем виде:
При горении ароматических углеводородов в недостатке кислорода может образоваться угарный газ СО или сажа С.
Бензол и его гомологи горят на воздухе коптящим пламенем. Бензол и его гомологи образуют с воздухом и кислородом взрывоопасные смеси.
3.2. О кисление гомологов бензола
Гомологи бензола легко окисляются перманганатом и дихроматом калия в кислой или нейтральной среде при нагревании.
При этом происходит окисление всех связей у атома углерода, соседнего с бензольным кольцом, кроме связи этого атома углерода с бензольным кольцом.
Толуол окисляется перманганатом калия в серной кислоте с образованием бензойной кислоты:
Если окисление толуола идёт в нейтральном растворе при нагревании, то образуется соль бензойной кислоты – бензоат калия:
Таким образом, толуол обесцвечивает подкисленный раствор перманганата калия при нагревании.
| При окислении других гомологов бензола всегда остаётся только один атом С в виде карбоксильной группы (одной или нескольких, если заместителей несколько), а все остальные атомы углерода радикала окисляются до углекислого газа или карбоновой кислоты. |
| Например, при окислении этилбензола перманганатом калия в серной кислоте образуются бензойная кислота и углекислый газ |
| Например, при окислении этилбензола перманганатом калия в нейтральной кислоте образуются соль бензойной кислоты и карбонат |
Более длинные радикалы окисляются до бензойной кислоты и карбоновой кислоты:
При окислении пропилбензола образуются бензойная и уксусная кислоты:
Изопропилбензол окисляется перманганатом калия в кислой среде до бензойной кислоты и углекислого газа:
Видео:Получение БЕНЗОЛАСкачать

4. Ориентирующее действие заместителей в бензольном кольце
Если в бензольном кольце имеются заместители, не только алкильные, но и содержащие другие атомы (гидроксил, аминогруппа, нитрогруппа и т.п.), то реакции замещения атомов водорода в ароматической системе протекают строго определенным образом, в соответствии с характером влияния заместителя на ароматическую π-систему.
| Заместители подразделяют на две группы в зависимости от их влияния на электронную плотность ароматической системы: электронодонорные (первого рода) и электроноакцепторные (второго рода). |
Типы заместителей в бензольном кольце
| Заместители первого рода | Заместители второго рода |
| Дальнейшее замещение происходит преимущественно в орто— и пара-положение | Дальнейшее замещение происходит преимущественно в мета-положение |
| Электронодонорные, повышают электронную плотность в бензольном кольце | Электроноакцепторные, снижают электронную плотность в сопряженной системе. |
|
|
| Например, толуол реагирует с хлором в присутствии катализатора с образованием смеси продуктов, в которой преимущественно содержатся орто-хлортолуол и пара-хлортолуол. Метильный радикал — заместитель первого рода. |
В уравнении реакции в качестве продукта записывается либо орто-толуол, либо пара-толуол.
| Например, при бромировании нитробензола в присутствии катализатора преимущественно образуется мета-хлортолуол. Нитро-группа — заместитель второго рода |

Видео:Как получить ХЛОРБЕНЗОЛ, не используя БЕНЗОЛ!Скачать

5. Особенности свойств стирола
Стирол (винилбензол, фенилэтилен) – это производное бензола, которое имеет в своем составе двойную связь в боковом заместителе.
Общая формула гомологического ряда стирола: CnH2n-8.
| Молекула стирола содержит заместитель с кратной связью у бензольного кольца, поэтому стирол проявляет все свойства, характерные для алкенов – вступает в реакции присоединения, окисления, полимеризации. |
Стирол присоединяет водород, кислород, галогены, галогеноводороды и воду в соответствии с правилом Марковникова.
| Например, при гидратации стирола образуется спирт: |
| Стирол присоединяет бром при обычных условиях, то есть обесцвечивает бромную воду |
При полимеризации стирола образуется полистирол:
Как и алкены, стирол окисляется водным раствором перманганата калия при обычных условиях. Обесцвечивание водного раствора перманганата калия — качественная реакция на стирол:
При жестком окислении стирола перманганатом калия в кислой среде (серная кислота) разрывается двойная связь и образуется бензойная кислота и углекислый газ:
При окислении стирола перманганатом калия в нейтральной среде при нагревании также разрывается двойная связь и образуется соль бензойной кислоты и карбонат:
Видео:Bromination of Benzene using FeBr3Скачать

Бензол br2 febr3 уравнение реакции
3.2. Галогенирование
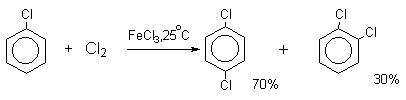
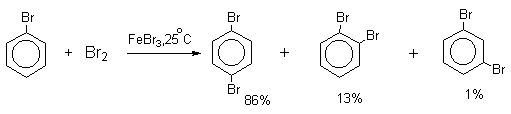
В реакциях замещения аренового водорода на галогены активность галогенов уменьшается в ряду Cl2>Br2>>I2. В качестве электрофильных галогенирующих агентов используются молекулярные галогены или комплексы галогенов с разнообразными кислотами Льюиса (FeCl3, FeBr3, AlCl3, AlBr3 галогениды Ga,Sb,Sn,TiCl4 и др.). Очень часто применяют растворы Сl2 и Br2 в уксусной кислоте.
Галогенирование аренов молекулярными галогенами в отсутствие кислот Льюиса или Бренстеда, поляризующих связь галоген-галоген, эффективно лишь для полиалкилбензолов, фенолов, простых эфиров одно- и многоатомных фенолов, и ароматических аминов. В других случаях необходим катализ кислотами Льюиса или Бренстеда. Активные субстраты хлорируются хлором в уксусной кислоте, где электрофилом является просто элементарный хлор. Реакция имеет второй кинетический порядок (скорость=k[ArH][Cl2]). На ее скорость не влияют добавки сильных кислот или оснований. При добавлении ионов Cl- (общий ион) и СH3COO- в обоих случаях проявляется лишь нормальный солевой эффект. На основании этого можно сделать вывод, что электрофилами в этом случае не являются ни Cl+ , ни CH3COОCl. Поэтому был предложен очень простой двухстадийный механизм:
Такой же механизм наблюдается и в других органических растворителях.
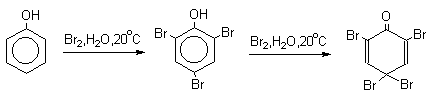
Бромирование происходит аналогично, однако при сохранении первого порядка по ArH, порядок по брому часто отличается от первого. Вероятно, это связано с более легкой обратимостью первой стадии. Галогенирование свободными галогенами активных ароматических субстратов протекает очень легко и часто приводит к полигалоидпроизводным. Например, анилин и фенол при действии бромной воды мгновенно превращаются в нерастворимые 2,4,6-трибромпроизводные, причем в случае фенола при избытке бромной воды реакция протекает более глубоко.
Поэтому, для получения моногалоидзамещенных производных фенола и анилина используют специальные приемы:
- Понижают активность галогена и увеличивают»объем» галогенирующей частицы (например, используют комплексы хлора и брома с уксусной кислотой, комплекс брома с диоксаном — диоксанбромид).
- Понижают активность субстрата и увеличивают «объем» ориентирующего заместителя (например, ацилируют NH2-группу в анилине).
Механизм галогенирования при катализе кислотами Льюиса или Бренстеда часто называют галогенированием «положительным бромом» или «положительным хлором», но эти названия чисто условны. При бромировании бромом в присутствии кислот Льюиса в этих реакциях участвует комплекс галогена с кислотой Льюиса, например, [Br + . Br-FeBr3 — ]. В качестве катализатора обычно берут FeCl3 или FeBr3, которые можно получать из металлического железа и Cl2 или Br2 прямо в реакционном сосуде. Более активные катализаторы AlCl3 или AlBr3 нередко приводят к образованию продуктов полигалогенирования. Так, например, при бромировании бензола в присутствии AlBr3 замещаются все шесть атомов водорода и образуется гексабромбензол. Поэтому AlHal3 мало пригодны для галогенирования бензола, моно- и диалкилбензолов, галогенбензолов. Сильные кислоты Льюиса эффективны при галогенировании нитробензола, бензойной кислоты и других соединений, содержащих электроноакцепторные заместители. Во всех случаях атакующим агентом, по-видимому, является комплекс Hal2 с кислотой Льюиса. До сих пор нет прямых доказательств участия в реакции катионов Cl + или Br + , как кинетически независимых частиц.
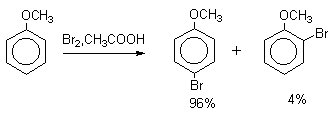
Толуол в присутствии FeBr3, бромируется существенно быстрее, чем бензол (kтолуол/kбензол=160). При этом получается смесь пара- и орто-изомеров в соотношении
2:1, и совсем не получается мета-изомера, а при хлорировании толуола орто- и пара-изомеры образуются в примерно равных количествах.
Следует также отметить, что введение хлора или брома в бензольное кольцо уменьшает скорость дальнейшего замещения не более чем в 7-8 раз в отличие от нитрования, где скорость реакции введения второго заместителя уменьшается в 10 7 раз. Поэтому хлорирование и бромирование бензола всегда приводит к смеси дигалогенпроизводных. При хлорировании хлорбензола сначала образуется смесь орто- и пара-дихлорбензолов в соотношении 3:7, а при дальнейшем хлорировании получается смесь 1,2,3- и 1,2,4-трихлорбензолов.
Напротив, каталитическое галогенирование соединений с электроноакцепторными заместителями протекает более селективно.
Нафталин галогенируется гораздо легче, чем бензол. Реакцию можно проводить как в присутствии кислоты Льюиса, так и без нее.
Бром реагирует еще более селективно, чем хлор:
Широкое применение в синтетической практике находят такие галогенирующие агенты, как трифторацетилгипобромит и особенно трифторацетилгипоиодит (CF3COOHal). Эти гипогалогениты образуются при действии соответствующего галогена на трифторацетаты серебра или ртути.
Можно использовать также ацетилгипогалогениты, однако трифторацетилгипогалогениты гораздо более реакционноспособны. Например, скорости бромирования при действии Br2, CH3COOBr и CF3COOBr составляют 1:10 6 :10 10 .
Молекулярный иод является слишком слабым электрофильным агентом. Только очень активные ароматические соединения, такие, как ароматические амины или фенолят-ион реагируют непосредственно с I2. В качестве более активного иодирующего агента иногда используют хлорид иода ICl. Удобным методом иодирования ароматических соединений является использование смеси молекулярного иода и окислителей (окислительное иодирование), лучшим из которых является, по-видимому, HIO4, но азотная кислота употребляется наиболее часто, как более дешевая.
Очень хорошие результаты получаются при иодировании ароматических соединений смесью I2 с хлоридом меди (II) CuCl2. Хлорная медь выполняет, вероятно, двоякую функцию и кислоты Льюиса и окислителя:
Ввиду чрезвычайной активности фтора, прямое фторирование практически не применяют для введения фтора в ароматическое кольцо. Арилфториды получают термическим разложением тетрафторборатов арилдиазониев (реакция Шимана).
Видео:НитрированиеСкачать

Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. 🔥 ВидеоАлкены. Ч.3-1. Химические свойства. Реакции присоединения + механизм электрофильного присоединения.Скачать  9.3. Фенол: Химические свойстваСкачать  Типы Химических Связей — Как определять Вид Химической Связи? Химия 9 классСкачать  4.3. Алкадиены (диены): Химические свойства. ЕГЭ по химииСкачать  Монохлорид Брома - BrCl. Реакция Брома и Хлора. Реакция Cl2 и Br2.Скачать  Redox balance Br2 = BrO3- + Br- || Ion electron method || Half reaction methodСкачать  Бромид Фосфора(3) - PBr3. Горение Фосфора в парах Брома. Реакция P и Br2.Скачать  Реакция восстановления Берча IСкачать  Окислительно-восстановительные реакции. Метод электронного баланса. ЕГЭСкачать  Галогены. 9 класс.Скачать  How to Balance Br2 + F2 = BrF5 (Bromine gas + Fluorine gas)Скачать  Химия | Тепловой эффект химической реакции (энтальпия)Скачать  |