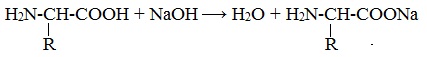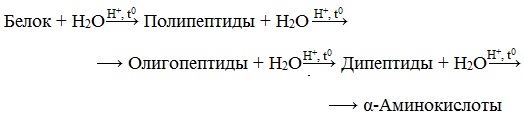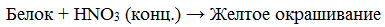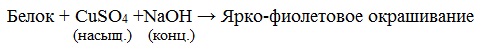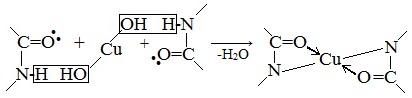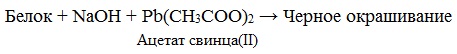По химическому составу белки делятся на две группы:
а) простые белки – протеины, которые при гидролизе распадаются только на аминокислоты;
б) сложные белки или протеиды, образующие при гидролизе аминокислоты и вещества небелковой природы (углеводы, нуклеиновые кислоты и др.) — соединения белковых веществ с небелковыми.
- 1. Амфотерные свойства белков
- 2. Денатурация белка (необратимое осаждение, свертывание)
- 3. Гидролиз белков
- 4. Цветные (качественные) реакции на белки
- 3.8.2. Белки
- Химические свойства белков
- Гидролиз
- Денатурация
- Качественные реакции на белки
- Биуретовая реакция
- Ксантопротеиновая реакция
- Лабораторная работа №2 Физико-химические свойства белков
- 💡 Видео
1. Амфотерные свойства белков
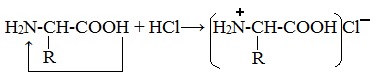
Как и аминокислоты, белки являются амфотерными соединениями, так как молекула любого белка содержит на одном конце группу -NH2, а на другом конце – группу -СООН.
Так, при действии щелочей белок реагирует в форме аниона – соединяется с катионом щелочи:
При действии же кислот он выступает в форме катиона:
Если в молекуле белка преобладают карбоксильные группы, то он проявляет свойства кислот, если же преобладают аминогруппы, — свойства оснований.
Очень важным для жизнедеятельности живых организмов является буферное свойство белков, т.е. способность связывать как кислоты, так и основания, и поддерживать постоянное значение рН различных систем живого организма.
Белки обладают и специфическими физико-химическими свойствами.
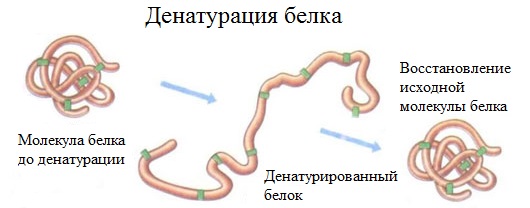
2. Денатурация белка (необратимое осаждение, свертывание)
Денатурация – это разрушение вторичной и третичной структуры белка (полное или частичное) и изменение его природных свойств с сохранением первичной структуры белка.
Сущность денатурации белка сводится к разрушению связей, обусловливающих вторичную и третичную структуры молекулы (водородных, солевых и других мостиков). А это приводит к дезориентации конфигурации белковой молекулы.
Денатурация бывает обратимой и необратимой.
Обратимая денатурация белка происходит при употреблении алкоголя, солёной пищи.
Необратимая денатурация может быть вызвана при действии таких реагентов, как концентрированные кислоты и щелочи, спирты, в результате воздействия высокой температуры, радиации, при отравлении организма солями тяжелых металлов (Hg 2+ , Pb 2+ , Си 2+ ).
Например, яичный белок альбумин осаждается из раствора (свертывается) при варке яиц (при температуре 60-70 0 С), теряя способность растворяться в воде.
Видеоопыт «Свертывание белков при нагревании»
Видеоопыт «Осаждение белков солями тяжелых металлов»
Видеоопыт «Осаждение белков спиртом»
3. Гидролиз белков
Гидролиз белков – это необратимое разрушение первичной структуры в кислом или щелочном растворе с образованием аминокислот.
Анализируя продукты гидролиза, можно установить количественный состав белков.
Переваривание белков в организме по своей сути представляет ферментативный гидролиз белковых молекул.
В лабораторных условиях и в промышленности проводится кислотный гидролиз.
В ходе гидролиза белков происходит разрушение пептидных связей. Гидролиз белка имеет ступенчатый характер:
4. Цветные (качественные) реакции на белки
Для белков известно несколько качественных реакций.
а) Ксантопротеиновая реакция (на остатки аминокислот, содержащих бензольные кольца)
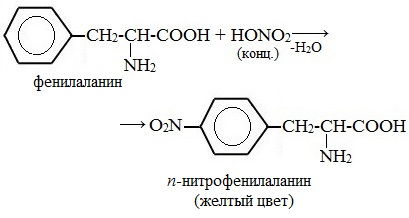
Белки, содержащие остатки ароматических аминокислот (фенилаланина, тирозина), дают желтое окрашивание при действии концентрированной азотной кислоты.
Причина появления окраски – образование нитропроизводных ароматических аминокислот, например, фенилаланина:
Видеоопыт «Ксантопротеиновая реакция на белки»
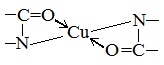
б) Биуретовая реакция (на пептидные связи)
Все соединения, содержащие пептидную связь, дают фиолетовое окрашивание при действии на них солей меди (II) в щелочном растворе.
Причина появления окраски – образование комплексных соединений с координационным узлом:
Видеоопыт «Биуретовая реакция белков»
Видеоопыт «Качественные реакции на белки: биуретовая и ксантопротеиновая»
в) Цистеиновая реакция (на остатки аминокислот, содержащих серу)
Причина появления окраски – образование черного осадка сульфида серебра (II) PbS.
Видеоопыт «Качественное определение азота в органических соединениях»
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

3.8.2. Белки
Белки — высокомолекулярные органические соединения, состоящие из остатков аминокислот, соединённых в длинную цепочку пептидной связью.
В состав белков живых организмов входит всего 20 типов аминокислот, все из которых относятся к альфа-аминокислотами, а аминокислотный состав белков и их порядок соединения друг с другом определяются индивидуальным генетическим кодом живого организма.
Одной из особенностей белков является их способность самопроизвольно формировать пространственные структуры характерные только для данного конкретного белка.
| первичная | последовательность соединения остатков аминокислот | |
| вторичная | ||
| третичная |
Из-за специфики своего строения белки могут обладать разнообразными свойствами. Например, белки, имеющие глобулярную четвертичную структуру, в частности белок куриного яйца, растворяются в воде с образованием коллоидных растворов. Белки, обладающие фибриллярной четвертичной структурой в воде не растворяются. Фибриллярными белками, в частности, образованы ногти, волосы, хрящи.
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Химические свойства белков
Гидролиз
Все белки способны вступать в реакцию гидролиза. В случае полного гидролиза белков образуется смесь из α -аминокислот:
Белок + nH2O => смесь из α-аминокислот
Денатурация
Разрушение вторичной, третичной и четвертичной структур белка без разрушения его первичной структуры называют денатурацией. Денатурация белка может протекать под действием растворов солей натрия, калия или аммония – такая денатурация является обратимой:
Денатурация же протекающая под действием излучения (например, нагрева) или обработке белка солями тяжелых металлов является необратимой:
Так, например, необратимая денатурация белка наблюдается при термической обработке яиц в процессе их приготовления. В результате денатурации яичного белка его способность растворяться в воде с образованием коллоидного раствора исчезает.
Качественные реакции на белки
Биуретовая реакция
Если к раствору, содержащему белок добавить 10%-й раствор гидроксида натрия, а затем небольшое количество 1 %-го раствора сульфата меди, то появится фиолетовое окрашивание.
раствор белка + NаОН(10%-ный р-р) + СuSO4 = фиолетовое окрашивание
Ксантопротеиновая реакция
растворы белка при кипячении с концентрированной азотной кислотой окрашиваются в желтый цвет:
раствор белка + HNO3(конц.) => желтое окрашивание
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Лабораторная работа №2 Физико-химические свойства белков
Лабораторная работа №2
ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА БЕЛКОВ
Работа 1. Растворимость альбуминов и глобулинов
Многие белки хорошо растворяются в воде, что обусловлено наличием на поверхности белковой молекулы свободных гидрофильных групп ( – OH, – NH2, – COOH и др.). Различные белки растворяются по-разному, белки опорных тканей (кератин, проколлаген, коллаген, эластин и др.) нерастворимы в воде. Растворимость белка в воде зависит от характера белка, реакции среды и присутствия электролитов. В кислой среде лучше растворяются белки, обладающие кислыми свойствами (альбумины, глобулины, проламины, глютелины). Щелочные белки (протамины, гистамины) лучше растворяются в щелочной среде. Различия в растворимости отмечаются как среди кисло-, так и среди щелочнореагирующих белков. Альбумины растворяются в дистиллированной воде, а глобулины растворяются в воде только в присутствии электролитов.
Исследуемый материал: яичный белок.
Реактивы: 5% раствор NaCl, дистиллированная вода.
Оборудование: пробирки, капельницы.
Ход работы. В первую пробирку вносят 2 капли неразведенного яичного белка, прибавляют 20 капель воды. Содержимое перемешивают. При этом альбумин растворяется, а глобулин выпадает в виде небольшого осадка.
В другую пробирку вносят 2 капли яичного белка и 20 капель 5% раствора хлорида натрия. В слабом солевом растворе растворяются как альбумины, так и глобулины.
В две другие пробирки помещают небольшое количество кератина (волосы). В одну пробирку вносят 20 капель воды, в другую – 20 капель раствора хлорида натрия. Кератин не растворяется ни в воде, ни в солевом растворе.
Оформление работы. Результаты работы оформляются в виде таблицы, где растворимость обозначают знаком «плюс» (+), а отсутствие растворимости – знаком «минус» (–)
Реакции осаждения белков
Для осаждения белка нужно лишить его факторов, удерживающих белок в растворе, используя различные агенты, снижающие заряд или разрушающие гидратную оболочку белковой частицы. Реакции осаждения могут быть обратимыми и необратимыми.
1. Обратимые реакции осаждения не приводят к глубоким изменениям структуры белка, поэтому получаемые осадки могут быть вновь растворены в первоначальном растворителе. Белки при этом сохраняют свои начальные нативные, включая биологические, свойства.
2. Необратимые реакции вызывают глубокие изменения структуры белка, поэтому получаемые осадки не могут быть растворены в первоначальных растворителях. Наступает денатурация белка. Денатурацией называют такое изменение белка, при котором он утрачивает свои естественные биологические и физико-химические свойства, становится менее гидрофильным и теряет способность растворяться в воде.
Практическое значение реакций осаждения белков состоит в том, что они дают возможность: 1) изучить свойства белков; 2) освободить жидкость от присутствия белка; 3) установить наличие белка в моче при патологических состояниях; 4) разделить отдельные белковые фракции на альбумины и глобулины.
Цель работ: Изучить характер реакций осаждения белков в растворах. Объяснить механизм действия осаждающих агентов на основании знания физико-химических свойств белка.
Работа 1. Осаждение белков при нагревании
Почти все белки денатурируют при нагревании (50–55 °С и выше). Механизм тепловой денатурации связан с перестройкой структуры белковой молекулы, в результате которой белок теряет свои нативные свойства, уменьшается его растворимость (уменьшение гидрофильных свойств ведет к нарушению гидратной оболочки). Присутствие солей и концентрация водородных ионов играют важную роль в выпадении в осадок денатурированного при нагревании белка. Наиболее полное и быстрое осаждение происходит в изоэлектрической точке белка, то есть при такой величине рН, при которой коллоидные частицы белка являются наименее устойчивыми. Поэтому для полного осаждения белка при нагревании следует создавать реакцию среды, соответствующую его изоэлектрической точке. Белки, обладающие кислыми свойствами, осаждают в слабокислой среде, белки, обладающие щелочными свойствами, – в слабощелочной. В сильнокислых и сильнощелочных растворах денатурированный при нагревании белок не выпадает в осадок, так как частицы белка перезаряжаются (или происходит усиление имеющегося заряда) и несут в первом случае положительный, во втором – отрицательный заряд. Это повышает их устойчивость в растворе в результате электростатических сил отталкивания. Поэтому в сильнокислых и сильнощелочных растворах белки обычно не выпадают в осадок при нагревании. Однако в сильно-кислых растворах белки могут коагулировать при добавлении достаточного количества какой-либо нейтральной соли. Степень влияния ионов нейтральных солей на осаждаемость белков зависит от их способности адсорбироваться на частицах белка. Адсорбированные ионы солей (если они противоположны по знаку заряду коллоидной частицы) нейтрализуют заряд частицы. Наступает момент, когда силы притяжения между молекулами превышают силы отталкивания – и белок выпадает в осадок.
Исследуемый материал: раствор яичного белка.
Реактивы: 1% раствор CH3COOH, 10% раствор NaOH, насыщенный раствор NaCl.
Оборудование: пробирки, капельницы, спиртовка.
Ход работы. В 5 пробирок наливают по 5 капель раствора яичного белка (без NaCl). В первой пробирке нейтральный раствор нагревают до кипения. Жидкость мутнеет, поскольку разрушаются водные оболочки вокруг молекул белка и происходит укрупнение его частиц. Мицеллы белка несут заряд и удерживаются во взвешенном состоянии. Во 2-й пробирке раствор белка нагревают до кипения и прибавляют 1 каплю 1-процентного раствора уксусной кислоты (для слабого подкисления). Через некоторое время выпадает хлопьевидный осадок белка. Частицы белка теряют заряд и приближаются к изоэлектрическому состоянию. В 3-ю пробирку добавляют 5 капель 1% раствора уксусной кислоты (для получения сильнокислой реакции среды). При кипячении жидкости осадка не образуется, поскольку белковые мицеллы перезаряжаются и несут положительный заряд, что повышает их устойчивость. В 4-ю пробирку добавляют 2 капли 10% раствора NaOH, создавая щелочную среду. При кипячении жидкости осадка не образуется, поскольку в щелочной среде отрицательный заряд на частицах белка увеличивается. В 5-ю пробирку наливают 5 капель 1% раствора уксусной кислоты и 2 капли насыщенного раствора NaCl и нагревают.
Выпадает белый хлопьевидный осадок белка, так как частицы белка теряют заряд вследствие взаимодействия белка с разноименно заряженными ионами хлористого натрия.
Оформление работы. Записать в таблицу результаты осаждения белков при кипячении в различных средах и в каждом случае указать причину появления или отсутствия осадка белка.
💡 Видео
Лабораторная работа №17. Денатурация белков. 9 класс.Скачать

10 класс Качественные реакции на белкиСкачать

Качественные реакции на белкиСкачать

Ксантопротеиновая реакция на белкиСкачать

Опыты по химии. Цветные реакции белка: биуретовая; ксантопротеиноваяСкачать

Уравнивание реакций горения углеводородовСкачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

25. Схема реакции и химическое уравнениеСкачать

Реакция белка на спирт Reaction of alcohol on the proteinСкачать

Опыты по химии. Денатурация белков: нагреванием; взаимодействие с кислотой, солями тяжелых металловСкачать

Биуретовая реакция белковСкачать

Видеоурок: Практическая работа № 4. Цветные реакции на белкиСкачать

Биосинтез белка за 3 минуты (даже меньше)Скачать

ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

Качественные реакции на белки в сравнении с реакциями на аминокислоты. Химический опытСкачать

Денатурация белка в спиртеСкачать

Денатурация БЕЛКА. Реакция со СПИРТОМ и АЦЕТОНОМ. Реакции с белком. Опыты по химии дома.Скачать