ЛАБОРАТОРНАЯ РАБОТА № 1
ЦВЕТНЫЕ РЕАКЦИИИ НА БЕЛКИ И АМИНОКИСЛОТЫ.
Теоретическая часть.
Значение цветных реакции состоит в том, что они дают возможность обнаружить присутствие белка в биологических жидкостях, растворах и установить аминокислотный состав различных природных белков. Эти реакции применяются как для качественного, так и для количественного определения белка и содержащихся в нём аминокислот.
Существует два типа цветных реакций: 1) универсальные — биуретовая (на все белки) и нингидриновая (на все α-аминокислоты и белки); 2) специфические — только на определенные аминокислоты как в молекуле белка, так и в растворах отдельных аминокислот (реакция Фоля на аминокислоты, содержащие слабосвязанную серу, реакция Миллона на тирозин, реакция Сакагучи на аргинин и т.д.).
При проведении цветных реакций на белки и аминокислоты необходимо предварительно составить следующую таблицу:
| № | Название реакции | Применяемые реактивы | Появление окрашивания | Что открывает данная реакция, её химизм |
Практическая часть.
Биуретовая реакция
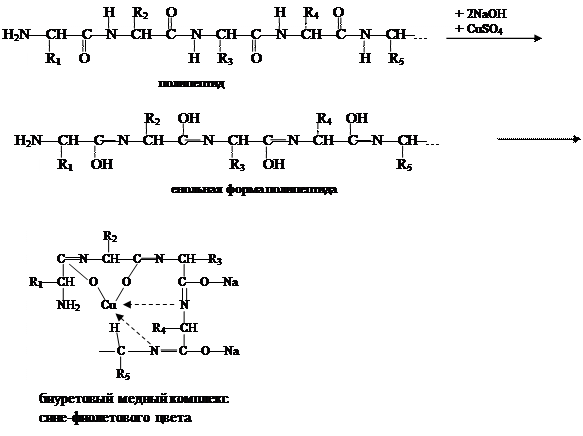 |
Принцип метода.Биуретовая реакция открывает пептидную связь в белке. В щелочной среде раствор белка при взаимодействии с ионами меди приобретает сине–фиолетовый цвет, а продукты неполного гидролиза его — пептоны — розовое окрашивание. Биуретовую реакцию способны давать вещества, которые содержат не менее двух пептидных связей. Биуретовая реакция схематично протекает так:
Енольная форма полипептида, образованная в сильно щелочной среде, дает отрицательный заряд, и кислород, взаимодействуя с медью, образует ковалентную связь, а, взаимодействуя с атомами азота, медь образует координационные связи. Степень окраски биуретового комплекса зависит от концентрации белка и количества медной соли в растворе. Нельзя добавлять избыток сульфата меди, так как синий осадок гидрата окиси меди маскирует характерное фиолетовое окрашивание биуретового комплекса белка.
Отдельные аминокислоты, такие как гистидин, серин, трионин, аспарагин дают положительную биуретовую реакцию при условии больших концентраций их в растворе.
 |
Примечание: биуретовая реакция получила свое название от производного мочевины — биурета. Биурет, имеющий группировку –CO-NH- образуется при нагревании мочевины с отщеплением от неё аммиака и дает то же окрашивание, что и белки.
|

 |
Как можно видеть из приведенной выше формулы, биурет в щелочной среде претерпевает полную енолизацию по схеме:
 |
Реактивы: раствор яичного белка (1—2 белка куриных яиц отделяют от желтков, взбалтывают с 1 л воды); едкий натр 10% раствор; сернокислая медь 1% раствор.
Ход работы: к 5 каплям раствора белка прибавляют 3 капли 10% раствора едкого натра и 1 каплю сернокислой меди, перемешивают; содержимое пробирки приобретает фиолетовый цвет.
Нингидриновая реакция.
Принцип метода.Нингидриновая реакция характерна для аминокислот, чья аминогруппа находится в α-положении, а также белков и полипептидов. Аминокислоты, полипептиды, белки при кипячении с водным раствором нингидрина дают синее или сине-фиолетовое окрашивание. В результате взаимодействия α-аминокислоты с нингидрином образуется шиффово основание, которое перегруппировывается, декарбоксилируется и расщепляется на альдегид и аминодикетогидринден. Химизм реакции с водным раствором нингидрина следующий:
 |
Аминодикетогидринден конденсируется ещё с одной молекулой нингидрина. Образовавшееся соединение, енолизируясь, переходит в окрашенную форму, получившую название «сине-фиолетовый комплекс Руэмана», формула которого
 |
Реактивы: раствор яичного белка, нингидрин, 0,1 % раствор.
Ход работы: к 5 каплям раствора белка приливают 5 капель раствора нингидрина, кипятят 1-2 минуты. Появляется сине-фиолетовое окрашивание. С течением времени раствор синеет.
Примечание: нингидриновая реакция со спиртовым раствором нингидрина широко используется для разделения аминокислот хроматографическим методом, для открытия отдельных аминокислот и определения их количества. В присутствии органических растворителей образовавшееся шиффово основание не распадается, поскольку в соединении нет воды. Конденсируясь с нингидрином, оно содержит в своем составе радикал исходной аминокислоты, который обусловливает различную окраску: синюю, фиолетовую, а в присутствии пролина — желтую.
Ксантопротеиновая реакция (Мульдера).
 |
Принцип метода.Ксантопротеиновая реакция доказывает присутствие в белке ароматических аминокислот: триптофана, фенилаланина, тирозина. При обработке раствора белка концентрированной азотной кислотой появляется желтое окрашивание (нитрование), которое при добавлении щелочи переходит в оранжевое. Химизм реакции нитрования с образованием нитросоединения следующий:
Реактивы: раствор яичного белка; раствор тирозина 0,05 %; раствор желатина; азотная кислота концентрированная; аммиак концентрированный.
Ход работы:Берут 3 пробирки. В первую вносят 4 капли раствора тирозина, во вторую — 4 капли раствора желатина, в третью — столько же раствора яичного белка. В каждую пробирку добавляют по 2 капли азотной кислоты. Нагревают пробирки и отмечают появление желтого окрашивания. После охлаждения добавляют в каждую пробирку по 5-7 капель водного раствора аммиака, при этом желтая окраска сменяется на оранжевую.
Примечание: реакция носит название ксантопротеиновой от греческого xanthos — желтый. Реакция обеспечивает появление желтого окрашивания при попадании конц. азотной кислоты на кожу, ногти и т.д. Такую реакцию дают более простые ароматические соединения, например, фенолы. Желатин, сальмин, клупеин (протамины) дают отрицательную реакцию, так как в них отсутствуют ароматические аминокислоты.
Реакция Фоля.
Принцип метода.Реакция Фоля указывает на присутствие в белке аминокислот цистеина и цистина, содержащих слабосвязанную серу. Метионин, хотя и является содержащей серу аминокислотой, данной реакции не дает, поскольку сера в нем связана прочно. Реакция состоит в том, что при кипячении белка со щелочью аминокислоты цистеин и цистин легко отщепляют серу в виде сульфида металла, который с плюмбитом дает черный или бурый осадок сернистого свинца.
Реактив Фоля состоит из 5 % раствора уксуснокислого свинца и избытка 10 % раствора едкого натрия. Реакция протекает в реактиве Фоля по следующим уравнениям:
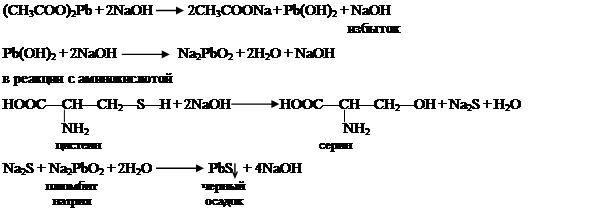 |
Реактивы: раствор яичного белка; реактив Фоля (к 5-10 % раствору уксуснокислого свинца добавляют раствор едкого натра до растворения).
Ход работы: к 5 каплям раствора белка добавляют 5 капель реактива Фоля. Интенсивно прокипятить и дать постоять 1-2 минуты. При этом появляется черный или бурый осадок сульфида свинца.
Видео:Реакции 16ти металлов с азотной кислотой разной концентрации Reactions of 16 metals with nitric acidСкачать

ЦВЕТНЫЕ И ИМЕННЫЕ КАЧЕСТВЕННЫЕ РЕАКЦИИ НА БЕЛКИ
История химии в школьном курсе
РЕАКЦИЯ ПИОТРОВСКОГО (БИУРЕТОВАЯ РЕАКЦИЯ)
В белках аминокислоты связаны друг с другом по типу полипептидов и дикетопиперазинов. Образование полипептидов из аминокислот происходит путем отщепления молекулы воды от аминогруппы одной молекулы аминокислоты и карбоксильной группы другой молекулы:
Образующаяся группа –С(О)–NН– называется пептидной группой, связь С–N, соединяющая остатки млекул аминокислот, – пептидной связью.
При взаимодействии дипептида с новой молекулой аминокислоты получается трипептид и т. д.
Дикетопиперазины образуются при взаимодействии двух молекул аминокислот с отщеплением двух молекул воды:
Дикетопиперазины были выделены из белков Н.Д.Зелинским и В.С.Садиковым в 1923 г.
Наличие в белке повторяющихся пептидных групп подтверждается тем, что белки дают фиолетовое окрашивание при действии небольшого количества раствора медного купороса в присутствии щелочи (биуретовая реакция).
Описание опыта. 2–3 мл раствора белка нагревают с 2–3 мл 20%-го раствора едкого кали или натра и несколькими каплями раствора медного купороса. Появляется фиолетовое окрашивание вследствие образования комплексных соединений меди с белками.
- РЕАКЦИЯ РУЭМАННА (НИНГИДРИНОВАЯ РЕАКЦИЯ (1911))
a -Аминокислоты реагируют с нингидрином, образуя сине-фиолетовый комплекс (пурпур Руэманна), интенсивность окраски которого пропорциональна количеству аминокислоты.
Реакция идет по схеме:
Реакция с нингидрином используется для визуального обнаружения a -аминокислот на хроматограммах (на бумаге, в тонком слое), а также для колориметрического определения концентрации аминокислот по интенсивности окраски продукта реакции.
Описание опыта. В пробирку наливают 1 мл 1%-го раствора глицина и 0,5 мл 1%-го раствора нингидрина. Содержимое пробирки осторожно нагревают до появления сине-фиолетового окрашивания.
- Реакция Сакагучи
Эта реакция на аминокислоту аргинин основана на взаимодействии аргинина с a -нафтолом в присутствии окислителя. Ее механизм еще полностью не выяснен. По-видимому, реакция осуществляется по следующему уравнению:
Поскольку производные хинониминов (в данном случае нафтохинона), у которых водород иминогруппы –NH– замещен на алкильный или арильный радикал, всегда окрашены в желто-красные тона, то, по-видимому, оранжево-красный цвет раствора при проведении реакции Сакагучи объясняется возникновением именно производного нафтохинонимина. Не исключена, однако, вероятность образования еще более сложного соединения за счет дальнейшего окисления оставшихся NH-групп аргининового остатка и бензольного ядра a -нафтола:
Описание опыта. В пробирку наливают 2 мл 0,01%-го раствора аргинина, затем добавляют 2 мл 10%-го раствора едкого натра и несколько капель 0,2% спиртового раствора a -нафтола. Содержимое пробирки хорошо перемешивают, приливают 0,5 мл раствора гипобромита и вновь перемешивают. Немедленно добавляют 1 мл 40%-го раствора мочевины для стабилизации быстро развивающегося оранжево-красного окрашивания.
- РЕАКЦИЯ ФОЛЯ
Это реакция на цистеин и цистин. При щелочном гидролизе «слабосвязанная сера» в цистеине и цистине достаточно легко отщепляется, в результате чего образуется сероводород, который, реагируя со щелочью, дает сульфиды натрия или калия. При добавлении ацетата свинца(II) образуется осадок сульфида свинца(II) серо-черного цвета.
Описание опыта. В пробирку наливают 1 мл раствора цистина, прибавляют 0,5 мл 20%-го раствора гидроксида натрия. Смесь нагревают до кипения, а затем добавляют 0,5 мл раствора ацетата свинца(II). Наблюдается выпадение серо-черного осадка сульфида свинца(II):
- РЕАКЦИЯ С ФОРМАЛЬДЕГИДОМ
При взаимодействии a -аминокислот с формальдегидом образуются относительно устойчивые карбиноламины – N-метилольные производные, содержащие свободную карбоксильную группу, которую затем титруют щелочью:
Эта реакция лежит в основе количественного определения a -аминокислот методом формального титрования (метод Сёренсена).
Описание опыта. В пробирку наливают 5 капель 1%-го раствора глицина и прибавляют 1 каплю индикатора метилового красного. Раствор окрашивается в желтый цвет (нейтральная среда). К полученной смеси добавляют равный объем 40%-го раствора формальдегида (формалин). Появляется красное окрашивание (кислая среда):
- РЕАКЦИЯ Циммермана
Это реакция на аминокислоту глицин.
Описание опыта. К 2 мл 0,1%-го раствора глицина, доведенного добавлением 10%-го раствора щелочи до рН = 8, приливают 0,5 мл водного раствора о-фталевого диальдегида. Реакционная смесь начинает медленно окрашиваться в ярко-зеленый цвет. Через несколько минут выпадает зеленый осадок.
- ОБРАЗОВАНИЕ КОМПЛЕКСОВ С МЕТАЛЛАМИ
a -Аминокислоты образуют с катионами тяжелых металлов внутрикомплексные соли. Со свежеприготовленным гидроксидом меди(II) все a -аминокислоты в мягких условиях дают хорошо кристаллизующиеся внутрикомплексные (хелатные) соли меди(II) синего цвета:
В таких солях ион меди координационными связями соединен с аминогруппами.
Описание опыта. В пробирку наливают 3 мл 3%-го раствора сульфата меди(II), добавляют несколько капель 10%-го раствора гидроксида натрия до образования голубого осадка. К полученному осадку гидроксида меди(II) приливают 0,5 мл концентрированного раствора глицина. При этом образуется темно-синий раствор глицината меди:
- КСАНТОПРОТЕИНОВАЯ РЕАКЦИЯ
Эта реакция используется для обнаружения a -аминокислот, содержащих ароматические радикалы. Тирозин, триптофан, фенилаланин при взаимодействии с концентрированной азотной кислотой образуют нитропроизводные, имеющие желтую окраску. В щелочной среде нитропроизводные этих a -аминокислот дают соли, окрашенные в оранжевый цвет.
Описание опыта. В пробирку наливают 1 мл раствора тирозина и добавляют 0,5 мл концентрированной азотной кислоты. Смесь нагревают до появления желтой окраски. После охлаждения добавляют 1–2 мл 20%-го раствора гидроксида натрия до появления оранжевой окраски раствора:
- ОСАЖДЕНИЕ БЕЛКА СОЛЯМИ ТЯЖеЛЫХ МЕТАЛЛОВ
Описание опыта. В две пробирки наливают по 1–2 мл раствора белка и медленно, при встряхивании, добавляют по каплям в одну пробирку насыщенный раствор сульфата меди, а в другую – 20%-й раствор ацетата свинца. Образуются осадки труднорастворимых солеобразных соединений белка. Опыт иллюстрирует применение белка как противоядия при отравлении солями тяжелых металлов.
- Открытие аминного азота в белках
Описание опыта. В сухую пробирку помещают немного сухого белка, например желатины. Прибавляют пятикратное количество натронной извести (смесь едкого натра и гидроксида кальция), перемешивают встряхиванием и подогревают. Выделяется аммиак, вызывающий посинение розовой лакмусовой бумажки, смоченной водой. Одновременно ощущается запах жженого волоса, что всегда наблюдается при сжигании белковых веществ.
- Открытие серы в белках
Описание опыта. В пробирку наливают около
0,5 мл раствора уксуснокислого свинца и прибавляют раствор едкого кали до растворения образовавшегося осадка гидроксида свинца. В другую пробирку наливают
2–3 мл раствора белка и приливают такой же объем полученного раствора плюмбита. Нагревают смесь до кипения в течение 2–3 мин. Появление темного окрашивания указывает на образование сульфида свинца.
- РЕАКЦИЯ НА ПРИСУТСТВИЕ СЕРОСОДЕРЖАЩИХ a -АМИНОКИСЛОТ В БЕЛКЕ
Качественной реакцией на серосодержащие a -аминокислоты является реакция Фоля. Белки, содержащие остатки цистеина или цистина, также дают эту реакцию.
Описание опыта. В пробирку наливают 10 капель раствора яичного белка и вдвое больший объем 20%-го раствора гидроксида натрия. Содержимое пробирки нагревают до кипения (1–2 мин). К полученному щелочному раствору добавляют 5 капель раствора ацетата свинца(II) и вновь кипятят реакционную смесь. Наблюдается появление серо-черного осадка.
- РЕАКЦИЯ НА ТРИПТОФАН
Триптофан, реагируя в кислой среде с альдегидами, образует окрашенные продукты конденсации. Например, с глиоксиловой кислотой (являющейся примесью к концентрированной уксусной кислоте) реакция протекает по уравнению:
По аналогичной схеме протекает и реакция триптофана с формальдегидом.
В ходе проведенного исследования мы выявили по литературным источникам имеющуюся информацию о цветных качественных реакциях на белковые аминокислоты; выполнили ряд перечисленных реакций и составили базу данных. Эта база может быть использована в школьной практике как в теоретическом плане, так и в практическом, т. к. мы приводим краткие, но подробные описания выполнения всех опытов.
Из предложенных 18 качественных реакций каждая практически осуществима в школьном курсе химии и имеет важное практическое значение. Сопровождение реакций химическими уравнениями конкретизирует и углубляет знания по биологической и органической химии, особенно знания учащихся специализированных биологических и химических классов.
Использованная литература
Ермаков А.Н., Арасимович В.В., Смирнова-Иконникова М.И., Мирри И.К. Методы биохимического исследования растений. М.,1952, 520 с.
Полянская А.С., Шевелева А.О. Методическая разработка по лабораторным работам: «Аминокислоты» и «Белки». Л., 1976, 37 с.
Пустовалова Л.М. Практикум по биохимии. 1999, 541 с.
Руководство к практическим занятиям по органической химии. Под ред. В.М.Родионова. М., 1954, 111 с.
Соловьев Н.А. Лабораторные работы по биологической химии. Методическая разработка. СПб., 1996, 70 с.
Филиппович Ю.Б., Егорова Т.А., Севастьянова Г.А. Практикум по общей биохимии. М., 1982, 311 с.
З.Саитов, С.В.Телешов, Б.Харитонцев,
секция «Юный химик» РХО им. Д.И.Менделеева (г. Тобольск)
Видео:Химия 9 класс (Урок№15 - Азотная кислота. Строение молекулы.Соли азотной кислоты.Азотные удобрения.)Скачать

Аммиак: получение и свойства
Аммиак
Строение молекулы и физические свойства
В молекуле аммиака NH3 атом азота соединен тремя одинарными ковалентными полярными связями с атомами водорода:
Геометрическая форма молекулы аммиака — правильная треугольная пирамида. Валентный угол H-N-H составляет 107,3 о :
У атома азота в аммиаке на внешнем энергетическом уровне остается одна неподеленная электронная пара. Эта электронная пара оказывает значительное влиение на свойства аммиака, а также на его структуру. Электронная структура аммиака — тетраэдр , с атомом азота в центре:
Аммиак – бесцветный газ с резким характерным запахом. Ядовит. Весит меньше воздуха. Связь N-H — сильно полярная, поэтому между молекулами аммиака в жидкой фазе возникают водородные связи. При этом аммиак очень хорошо растворим в воде, т.к. молекулы аммиака образуют водородные связи с молекулами воды.
Способы получения аммиака
В лаборатории аммиак получают при взаимодействии солей аммония с щелочами. Поск ольку аммиак очень хорошо растворим в воде, для получения чистого аммиака используют твердые вещества.
Например , аммиак можно получить нагреванием смеси хлорида аммония и гидроксида кальция. При нагревании смеси происходит образование соли, аммиака и воды:
Тщательно растирают ступкой смесь соли и основания и нагревают смесь. Выделяющийся газ собирают в пробирку (аммиак — легкий газ и пробирку нужно перевернуть вверх дном). Влажная лакмусовая бумажка синеет в присутствии аммиака.
Видеоопыт получения аммиака из хлорида аммония и гидроксида кальция можно посмотреть здесь.
Еще один лабораторный способ получения аммиака – гидролиз нитридов.
Например , гидролиз нитрида кальция:
В промышленности аммиак получают с помощью процесса Габера: прямым синтезом из водорода и азота.
Процесс проводят при температуре 500-550 о С и в присутствии катализатора. Для синтеза аммиака применяют давления 15-30 МПа. В качестве катализатора используют губчатое железо с добавками оксидов алюминия, калия, кальция, кремния. Для полного использования исходных веществ применяют метод циркуляции непровзаимодействовавших реагентов: не вступившие в реакцию азот и водород вновь возвращают в реактор.
Более подробно про технологию производства аммиака можно прочитать здесь.
Химические свойства аммиака
1. В водном растворе аммиак проявляет основные свойства (за счет неподеленной электронной пары). Принимая протон (ион H + ), он превращается в ион аммония. Реакция может протекать и в водном растворе, и в газовой фазе:
Таким образом, среда водного раствора аммиака – щелочная. Однако аммиак – слабое основание . При 20 градусах один объем воды поглощает до 700 объемов аммиака.
Видеоопыт растворения аммиака в воде можно посмотреть здесь.
2. Как основание, аммиак взаимодействует с кислотами в растворе и в газовой фазе с образованием солей аммония.
Например , аммиак реагирует с серной кислотой с образованием либо кислой соли – гидросульфата аммония (при избытке кислоты), либо средней соли – сульфата аммония (при избытке аммиака):
Еще один пример : аммиак взаимодействует с водным раствором углекислого газа с образованием карбонатов или гидрокарбонатов аммония:
Видеоопыт взаимодействия аммиака с концентрированными кислотами – азотной, серной и и соляной можно посмотреть здесь.
В газовой фазе аммиак реагирует с летучим хлороводородом. При этом образуется густой белый дым – это выделяется хлорид аммония.
NH3 + HCl → NH4Cl
Видеоопыт взаимодействия аммиака с хлороводородом в газовой фазе (дым без огня) можно посмотреть здесь.
3. В качестве основания, водный раствор аммиака реагирует с растворами солей тяжелых металлов , образуя нерастворимые гидроксиды.
Например , водный раствор аммиака реагирует с сульфатом железа (II) с образованием сульфата аммония и гидроксида железа (II):
4. Соли и гидроксиды меди, никеля, серебра растворяются в избытке аммиака, образуя комплексные соединения – аминокомплексы.
Например , хлорид меди (II) реагирует с избытком аммиака с образованием хлорида тетрамминомеди (II):
Гидроксид меди (II) растворяется в избытке аммиака:
5. Аммиак горит на воздухе , образуя азот и воду:
Если реакцию проводить в присутствии катализатора (Pt), то азот окисляется до NO:
6. За счет атомов водорода в степени окисления +1 аммиак может выступать в роли окислителя , например в реакциях с щелочными, щелочноземельными металлами, магнием и алюминием . С металлами реагирует только жидкий аммиак.
Например , жидкий аммиак реагирует с натрием с образованием амида натрия:
Также возможно образование Na2NH, Na3N.
При взаимодействии аммиака с алюминием образуется нитрид алюминия:
2NH3 + 2Al → 2AlN + 3H2
7. За счет азота в степени окисления -3 аммиак проявляет восстановительные свойства. Может взаимодействовать с сильными окислителями — хлором, бромом, пероксидом водорода, пероксидами и оксидами некоторых металлов. При этом азот окисляется, как правило, до простого вещества.
Например , аммиак окисляется хлором до молекулярного азота:
Пероксид водорода также окисляет аммиак до азота:
Оксиды металлов , которые в электрохимическом ряду напряжений металлов расположены справа — сильные окислители. Поэтому они также окисляют аммиак до азота.
Например , оксид меди (II) окисляет аммиак:
2NH3 + 3CuO → 3Cu + N2 + 3H2O
📸 Видео
Азотная кислота. Физические и химические свойства азотной кислоты. Подготовка к ЕГЭ по химии | ХимияСкачать

Азотная кислота. Химические свойства. Взаимодействие с металлами.Скачать

Азотная кислота и металлы за 13 минут | ХИМИЯ ЕГЭ | СОТКАСкачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Азотная кислота на ОГЭ по химии | ОГЭ 2023 | УмскулСкачать

Химия 9 класс (Урок№14 - Азот: свойства и применение. Аммиак. Физические и химические свойства.)Скачать

Азотная кислота. Физические и химические свойства. 9 класс.Скачать

Качественные реакции на белкиСкачать

Ксантопротеиновая реакция на белкиСкачать

10 класс Качественные реакции на белкиСкачать

Получение концентрированной азотной кислотыСкачать

Азотная кислота. Химические свойства. Реакции с НЕметаллами.Скачать

АЗОТНАЯ КИСЛОТА (HNO₃) 43 , ИЗ КАЛЬЦИЕВОЙ СЕЛИТРЫ!Скачать

Аммиак. 9 класс.Скачать

ЭТА КИСЛОТА РАЗЪЕДАЕТ КОСТИ!Скачать

Азотная кислота и нитраты | Химия ЕГЭ | УмскулСкачать

Как правильно писать ОВР с азотной кислотой? В интернете кто-то неправСкачать

Реакции металлов с азотной кислотой. Химический опытСкачать
















