Гидроксид бериллия Be(OH)2 — неорганическое соединение. Белый, при нагревании разлагается. Не растворяется в воде. Проявляет амфотерные свойства.
Относительная молекулярная масса Mr = 43,03; относительная плотность для тв. и ж. состояния d = 1,92.
Видео:Решение цепочек превращений по химииСкачать

Способы получения
1. Гидроксид бериллия получают в результате взаимодействия хлорида бериллия и разбавленного раствора гидроксида натрия , на выходе образуется хлорид натрия и гидроксид бериллия :
BeCl2 + 2NaOH = Be(OH)2↓ + 2NaCl
При избытке раствора щелочи образуется комплексная соль:
2 . При взаимодействии бериллия с водой в состоянии кипения образуется гидроксид бериллия или оксид бериллия и водород:
3. Хлорид бериллия при взаимодействии с концентрированным гидратом аммиака образует хлорид аммония и гидроксид бериллия:
4. Сульфат бериллия взаимодействует с разбавленным раствором гидроксида натрия, образуя гидроксид бериллия и сульфат натрия:
5. В результате реакции между сульфатом бериллия и концентрированным гидратом аммиака образуется гидроксид бериллия и сульфат аммония:
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Качественная реакция
Качественная реакция на гидроксид бериллия — окрашивание фенолфталеина в малиновый цвет .
Видео:Разложение гидроксида меди II (Cu(OH)2 = CuO + H2O)Скачать

Химические свойства
1. Гидроксид бериллия взаимодействует со сложными веществами :
1.1. Гидроксид бериллия реагирует с кислотами:
1.1.1. В результате реакции между гидроксидом бериллия и разбавленной соляной кислотой образуется хлорид бериллия и вода:
1.1.2. С разбавленной плавиковой кислотой гидроксид бериллия также может взаимодействовать. При этом образуются фторид бериллия и вода:
1.1.3. Гидроксид бериллия вступает в реакцию с концентрированной плавиковой кислотой, образуя на выходе тетрафторобериллат водорода и воду:
1.2. Гидроксид бериллия взаимодействует с оксидами:
1.2.1. В результате взаимодействия гидроксида бериллия и углекислого газа образуется дигидроксокарбонат бериллия и вода:
1.3. Гидроксид бериллия вступает в реакцию с основаниями :
1.3.1. Гидроксид бериллия взаимодействует с концентрированным раствором гидроксида натрия образуя тетрагидроксобериллат натрия:
1.3.2. При взаимодействии гидроксида бериллия и гидроксида натрия при 200 — 300º С с образованием бериллата натрия и воды:
2. Гидроксид бериллия разлагается при температуре 200 — 800º С, образуя на выходе оксид бериллия и воду:
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Оксид меди 2, химическая формула и свойства
Оксиды — широко распространённый в природе тип соединений, который можно наблюдать даже в повседневной жизни, в быту. Примером могут служить песок, вода, ржавчина, известь, углекислый газ, ряд природных красителей. Руда многих ценных металлов по своей природе является оксидом, вследствие чего представляет большой интерес для научных и производственных исследований.
Соединение химических элементов с кислородом называют оксидами. Как правило, образуются они при накаливании каких-либо веществ на воздухе. Различают кислотные и основные оксиды. Металлы образуют основные оксиды, в то время как неметаллы — кислотные. За исключением оксидов хрома и марганца, которые также являются кислотными. В данной статье рассматривается представитель основных оксидов — CuO (II).
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

CuO (II)
Медь, нагреваясь на воздухе при температуре 400–500 °C, постепенно покрывается налётом чёрного цвета, который химики называют оксид двухвалентной меди, или CuO(II). Описанное явление представлено в следующем уравнении:
2 Cu + О 2 → 2 CuO
Термин «двухвалентный» указывает на способность атома вступать в реакцию взаимодействия с другими элементами посредством двух химических связей.
Интересный факт! Медь, находясь в различных соединениях, может быть с разной валентностью и другим цветом. Например: оксиды меди имеют ярко-красную (Cu2O) и коричнево-чёрную (CuO) окраску. А гидроксиды меди приобретают жёлтый (CuOH) и синий (Cu(OH)2) цвета. Классический пример явления, когда количество переходит в качество.
Cu2O ещё иногда называют закись, оксид меди (I), а CuO — окись, оксид меди (II). Существует также оксид меди (III) — Cu2O3.
В геологии оксид двухвалентной (или бивалентной) меди принято называть тенорит, другое его название — мелаконит. Название тенорит произошло от фамилии выдающегося итальянского профессора ботаники Michele Tenore, (1780—1861). Мелаконит считается синонимом названия тенорит и переводится на русский язык, как медная чернь либо чёрная медная руда. В том или ином случае речь идёт о кристаллическом минерале коричнево-чёрного цвета, разлагающемся при прокаливании и плавящемся только при избыточном давлении кислорода, в воде нерастворимом, и не реагирующем с ней.
Акцентируем основные параметры названного минерала.
Видео:Разбор, детальное объяснение цепочек превращений, Cu CuCl2 Cu(NO3)2 Cu(OH)2 CuO CuSO4 CuS SO2 H2SO3Скачать

Химическая формула: CuO
Молекула его состоит из атома Cu с молекулярной массой 64 а. е. м. и атома O, молекулярная масса 16 а. е. м., где а. е. м. — атомная единица массы, она же дальтон, 1 а. е. м. = 1,660 540 2(10) × 10 −27 кг = 1,660 540 2(10) × 10 –24 г. Соответственно молекулярная масса соединения равняется: 64 + 16 = 80 а. е. м.
Кристаллическая решётка: моноклинная сингония. Что обозначает такой тип осей симметрии кристалла, когда две оси пересекаются под косым углом и имеют различную длину, а третья ось расположена по отношению к ним под углом 90°.
Плотность – 6,51 г/см 3 . Для сопоставления, плотность чистого золота равна 19,32 г/см³, а плотность поваренной соли составляет 2,16 г /см 3 .
Плавится при температуре 1447 °C, под давлением кислорода.
Разлагается при накаливании до 1100 °C и преобразуется в оксид меди (I):
4CuO = 2Cu2O + O 2.
С водой не реагирует и не растворяется в ней.
Зато вступает в реакцию с водным раствором аммиака, с образованием гидроксида тетраамминмеди (II): CuO + 4NH3 + H2O = [Cu (NH3)4](OH) 2.
В кислотной среде образует сульфат и воду: CuO + H2SO4 = CuSO4 + H2O.
Реагируя со щёлочью, создаёт купрат: CuO + 2 NaOH → Na2CuO2 + H2O.
Видео:Решение цепочек превращений по химии, Cu CuCl2 Cu(NO3)2 Cu(OH)2 CuO CuSO4 CuS SO2 H2SO3Скачать

Реакция CuO NaOH
Образуется:
- путём прокаливания гидроксида меди (II) при температуре 200 °C: Cu(OH)2 = CuO + H2O;
- при окислении металлической меди на воздухе при температуре 400–500 °C: 2Cu + O2 = 2CuO;
- при высокотемпературной обработке малахита: (CuOH)₂CO₃ —> 2CuO + CO₂ + H₂O.
Восстанавливается до металлической меди —
- в реакции с водородом: CuO + H2 = Cu + H2O;
- с угарным газом (монооксид углерода): CuO + CO = Cu + CO2;
- с активным металлом: CuO + Mg = Cu + MgO.
Токсичен. По степени неблагоприятного воздействия на человеческий организм причисляется к веществам второго класса опасности. Вызывает раздражение слизистых оболочек глаз, кожных покровов, дыхательных путей и желудочно-кишечной системы. При взаимодействии с ним обязательно использование таких средств защиты, как резиновые перчатки, респираторы, защитные очки, спецодежду.
Вещество взрывоопасно и легко воспламеняется.
Применяется в промышленности, как минеральная составляющая комбикормов, в пиротехнике, при получении катализаторов химических реакций, как красящий пигмент для стекла, эмалей, керамики.
Окислительные свойства оксида меди (II) наиболее часто применяются в лабораторных исследованиях, когда необходим элементарный анализ, связанный с изучением органических материалов на предмет наличия в них водорода и углерода.
Немаловажно, что CuO (II) достаточно широко распространён в природе, как минерал тенерит, другими словами — это природное соединение руды, из которого можно получить медь.
Латинское наименование Cuprum и соответствующий ему символ Cu происходит от названия острова Кипр. Именно оттуда, через Средиземное море вывозили этот ценный металл древние римляне и греки.
Медь входит в число семи наиболее распространённых в мире металлов и состоит на службе у человека с древних времён. Однако в первозданном, металлическом состоянии встречается довольно редко. Это мягкий, легко поддающийся обработке металл, отличающийся высокой плотностью, очень качественный проводник тока и тепла. По электрической проводимости уступает только серебру, в то время как является более дешёвым материалом. Широко используется в виде проволоки и тонкого листового проката.
Химические соединения меди отличаются повышенной биологической активностью. В животных и растительных организмах они участвуют в процессах синтеза хлорофилла, поэтому считаются очень ценным компонентом в составе минеральных удобрений.
Необходима медь и в рационе человека. Недостаток её в организме может привести к различным заболеваниям крови.
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Видео
Из видео вы узнаете, что такое оксид меди.
Видео:Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Be oh 2 cuo уравнение реакции
Помогите пожалик не разбираюсь в химии)))
2 вариант
1) распределите по классам следующие соединения и дайте им названия:
CO2, SnCl2, P2O5, FeCl2, ZnO, AgNO3, MgSO4, Ba(OH)2, H2CO3, FeS, H2SiO3, KOH, H2SO4, LiOH, HJ, Al(OH)3, HgO, CuSO4, H2O, CaCO3.
2) Даны вещества: гидроксид кальция, раствор серной кислоты, оксид меди(II), оксид кальция, оксид фосфора(V), гидроксид железа(III). Какие из этих веществ будут взаимодействовать между собой? Напишите уравнения реакций и назовите образующиеся вещества.
3) Как осуществить следующие превращения:
S→SO2→H2SO3→K2SO3
Напишите уравнения реакций и укажите, к какому типу реакций относится каждая из них.
4)Какое количество вещества(моль) и какая масса получится оксида меди(II) из 49г. гидроксида меди(II).
5)Перед практической работой лаборант соляной кислотой снял с железного гвоздя образовавшиеся ржавчина, которая состоит из оксида железа(III) и гидроксида железа(III). Запишите уравнения происходящих химических реакций.
3 вариант
1)Распределите по классам следующие соединения, дайте им названия:
H2S, Na2SiO3, SO2, CuO, HClO4, P2O3, Zn(OH)2, NaOH, Ca(NO3)2, KCl, Mg3(PO4)2, Cu(OH)2, Na2O, HBr, Cl2O7, Fe2(SO4)3, Ba(OH)2, H3BO3, HgCl2, ZnCO3.
2) Даны вещества: цинк, раствор серной кислоты, оксид меди(II), вода, гидроксид калия, оксид углерода(IV). Какие из них будут взаимодействовать между собой? Напишите уравнения реакций и назовите образующиеся вещества.
3)Как осуществить следующие превращения:
Mg→MgO→Mg(OH)2→Mg3(PO4)2
Напишиет уравнения реакций, укажите её тип.
4) Какое количество вещества(моль) и какая масса получится сульфата бария, если взято 9,8 г. серной кислоты реагирующей с барием.
5)Почему реакцию нейтрализации гидроксида калия проводят в присутствии индикатора, а нейтрализацию гидроксида меди(II)-без индикатора?
🎥 Видео
Кто с кем реагирует?Скачать

Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

Реакция оксида кальция с водой | CaO + H2O = Ca(OH)2Скачать

C6H12O6 + Cu(OH)2 (Glucose reacts with Copper(II) hydroxide)Скачать

ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

Вторая часть экзамена по химииСкачать
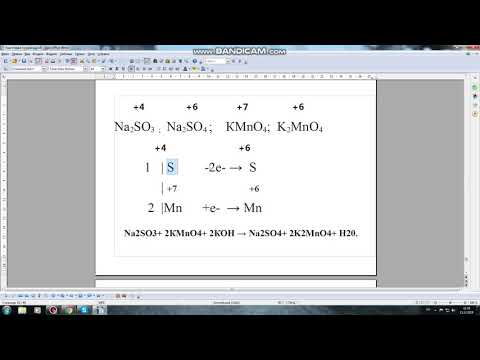
Качественные реакции с гидроксидами Cu(OH)2, Fe(OH)3, Fe(OH)2, Al(OH)3, Mg(OH)2, NH4OH, Ag2OСкачать

Цветные осадки и другие признаки протекания реакции.Скачать
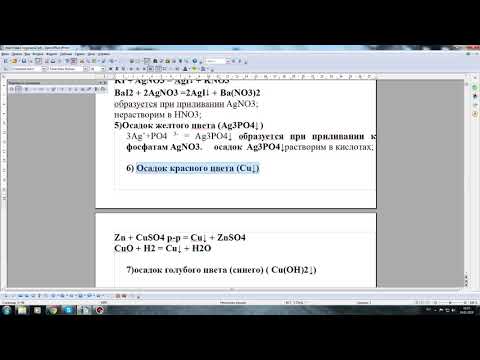
Making Cu(OH)2 (a precipitation reaction) #shortsСкачать

Ba(OH)2+Na2CO3=BaCO3+NaOH Ионное и молекулярное уравнения реакции, демонстрация.Скачать

Расстановка коэффициентов в химических реакциях: как просто это сделатьСкачать



