температуры. 
Больцмана (отношение универсальной газовой постоянной R к числу Авогадро NA), i — число степеней свободы молекул (i = 3 в большинстве задач про идеальные газы, где молекулы предполагаются сферами малого радиуса, физическим аналогом которых могут служить инертные газы), а T — абсолютная температура. Физический смысл температуры Т= t 0 С +273,15 К, Ек=⅔kТ, где k=R/NA, R – универсальная газовая постоянная, Температура является мерой кинетической енергии движения молекул вещества, чем больше скорость, тем больше температура и наоборот.
1. Основное уравнение МКТ связывает макроскопические параметры (давление, объём, температура) газовой системы с микроскопическими (масса молекул, средняя скорость их движения). Основные положения молекулярно-кинетической теории: — вещество состоит из частиц — молекул и атомов, разделенных промежутками, — эти частицы хаотически движутся, — частицы взаимодействуют друг с другом. Макроскопическое состояние характеризует всю систему в целом и описывается макроскопическими параметрами. Выделяют внутренние и внешние параметры. Внутренние:давление, температура, степень диссоциации, полный магнитный момент. Внешние: объем, характеристики внешних силовых полей (например: Е, В, g). Микроскопическое состояние задается набором параметров, характеризующих все частицы в системе. Для классической системы: набор координат, импульсов; для квантовой системы: набор квантовых чисел (n, l, m, s,…) В классической статистической механике теорема о равнораспределении кинетической энергии по степеням свободы позволяет связать температуру системы с её средней энергией. В первоначальном виде теорема равнораспределения утверждала, что при тепловом равновесии энергия разделена одинаково между её различными формами, например, средняя кинетическая энергия поступательного движения молекулы должна равняться средней кинетической энергии её вращательного движения. Основное уравнение МКТ:

к числу Авогадро, а i — число степеней свободы молекул. Основное уравнение МКТ связывает макроскопические параметры (давление, объём, температура) газовой системы с микроскопическими (масса молекул, средняя скорость их движения). Пусть имеется кубический сосуд с ребром длиной l и одна частица массой m в нём. Обозначим скорость движения vx, тогда перед столкновением со стенкой сосуда импульс частицы равен mvx, а после — − mvx, поэтому стенке передается импульс p = 2mvx. Время, через которое частица сталкивается
с одной и той же стенкой, равно 



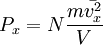




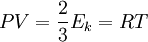

Уравнение состояния идеального газа (иногда уравнение Клапейрона или уравнение Клапейрона — Менделеева) — формула, устанавливающая зависимость между давлением, молярным объёмом и абсолютной температурой идеального газа. Уравнение имеет вид: 

21- Реальные газы. газ, который не описывается уравнением состояния идеального газа Клапейрона — Менделеева. Зависимости между его параметрами показывают, что молекулы в реальном газе взаимодействуют между собой и занимают определенный объём. Состояние реального газа часто на практике описывается обобщённым уравнением
Менделеева — Клапейрона:
где p — давление; V — объем T — температура; Zr = Zr (p,T) — коэффициент сжимаемости газа; m — масса; М — молярная масса; R — газовая постоянная.Жидкости мало сжимаемы. Поэтому дальше, даже при незначительном уменьшении объёма, давление быстро будет возрастать. Поскольку весь процесс происходит при постоянной температуре T, кривую, что изображает зависимость давления р от объёма V, называют изотермой. При объёме V1 начинается конденсация газа, а при объёме V2 она заканчивается. Если V > V1 то вещество будет в газообразном состоянии, а при V Зададимся вопросом: может ли тепловая машина превращать всю получаемую теплоту в работу, не отдавая части теплоты холодильнику? В этом случае, рассматриваемый процесс принимает вид: 1→2→3→2→1. Площадь, ограничиваемая такой кривой, а, следовательно, и совершаемая работа будут равны 0. Таким образом, отдача части теплоты холодильнику является необходимым условием совершения работы. Но тогда A 3 . Относительная влажность φ – это выраженное в процентах отношение абсолютной влажности ρ к тому количеству водяного пара ρ0, которое необходимо для насыщения 1 м 3 воздуха при данной температуре (или отношение давления водяного пара p к давлению насыщенного пара p0 при той же температуре)


важную роль в процессах влагооборота и теплообмена на земном шаре. При конденсации водяного пара образуются: роса, туман и облака. Человеческий организм за сутки испаряет до двух килограммов воды. Испарение пота с поверхности кожи предотвращает перегрев организма. Для замедления процесса испарения растения засушливых районов имеют обычно маленькие и немногочисленные листья.
31Электризация. Электрический заряд. электризация бывает двух видов. Один вид назвали положительной, второй – отрицательной. Причем одноименно наэлектризованные тела отталкиваются, а разноименно притягиваются. В 1881 году немецкий физик Гельмгольц выдвинул гипотезу о том, что электрические явления обусловлены существованием электрически заряженных элементарных частиц. Данная гипотеза подтвердилась открытием в 1897 году электрона, а затем протона и многих других электрически заряженных частиц. Говорят, что эти частицы несут электрический заряд, который обозначают буквой q и измеряют в кулонах (Кл). Заряд электрона отрицательный и равен qe= — 1,6·10 -19 Кл. Заряд протона положительный и равен по величине заряду электрона. Такой заряд называют элементарным электрическим зарядом и часто обозначают е. Это наименьший заряд, который может иметь частица или тело. Заряд любого тела кратен элементарному заряду q = ±ne где n = 1, 2, 3, … Все тела состоят из атомов. Атом в свою очередь состоит из положительно заряженного ядра (в состав которого входят положительно заряженные протоны и нейтральные нейтроны) и отрицательно заряженные электроны. В нормальном состоянии атом электрически нейтрален (суммарный заряд электронов и протонов равен 0). В результате внешнего воздействия атом может потерять один или несколько электронов и стать положительно заряженным (положительным ионом) или наоборот присоединить к себе один или несколько электронов и стать отрицательно заряженным (отрицательным ионом). Фактически положительный заряд какого-либо тела представляет собой недостаток электронов, а отрицательный – избыток электронов. Так при электризации трением часть электронов переходит от одного тела к другому. При этом электризуются оба тела: одно положительно, второе отрицательно.
32Закон сохранения электрического заряда. Закон Кулона. Электрические заряды могут перемещаться в пределах одного тела или от одного тел к другому, но не могут уничтожаться и создаваться. Иными словами в изолированной системе алгебраическая сумма электрических зарядов остается постоянной. Это положение называется законом сохранения электрического заряда. Тела, в которых электрические заряды могут свободно перемещаться, называются проводниками. К ним относятся металлы, электролиты и ионизированные газы. Тела, в которых возможность перемещения зарядов весьма ограничена (мало свободных электронов и практически нет ионов) называются диэлектриками. Промежуточное положение занимают полупроводники. Первые количественные исследования по взаимодействию электрически заряженных тел были проведены французским физиком Кулоном. Опытным путем было установлено, что два точечных заряда взаимодействуют с силой, пропорциональной величинам зарядов и обратно пропорциональной квадрату расстояния между ними и направленной вдоль прямой соединяющие эти
заряды. 
характеристика электрических свойств среды в которой находятся заряды. Для вакуума и воздуха ε = 1, для других веществ ε > 1. Коэффициент пропорциональности k в системе
СИ равен 
называемая электрическая постоянная. Она не имеет физического смысла и введена для упрощения формул электричества в системе СИ.
33. Электрическое поле и его напряженность. Электрическое поле. Для объяснения природы электрических взаимодействий заряженных тел необходимо допустить наличие в окружающем заряды пространстве физического агента, осуществляющего это взаимодействие. В соответствии с теорией близкодействия, утверждающей, что силовые взаимодействия между телами осуществляются через посредство особой материальной среды, окружающей взаимодействующие тела и передающей любые изменения таких взаимодействий в пространстве с конечной скоростью, таким агентом является электрическое поле.
Электрическое поле создается как неподвижными, так и движущимися зарядами. О наличии электрического поля можно судить, прежде всего, по его способности оказывать силовое действие на электрические заряды, движущиеся и неподвижные, а также по способности индуцировать электрические заряды на поверхности проводящих нейтральных тел.
Поле, создаваемое неподвижными электрическими зарядами, называют стационарным электрическим, или электростатическим полем. Оно представляет собой частный случай электромагнитного поля, посредством которого осуществляются силовые взаимодействия между электрически заряженными телами, движущимся в общем случае произвольным образом относительно системы отсчета.
Напряженность электрического поля. Количественной характеристикой силового действия электрического поля на заряженные тела служит векторная величина E, называемая напряжённостью электрического поля.
Она определяется отношением силы F, действующей со стороны поля на точечный пробный заряд qпр, помещенный в рассматриваемую точку поля, к величине этого заряда.
Понятие «пробный заряд» предполагает, что этот заряд не участвует в создании электрического поля и так мал, что не искажает его, т. е. не вызывает перераспределения в пространстве зарядов, создающих рассматриваемое поле. В системе СИ единицей напряженности служит 1 В / м, что эквивалентно 1 Н / Кл.
Видео:Идеальный газ. Основное уравнение молекулярно-кинетической теории газов. 10 класс.Скачать

БАРОМЕТРИ́ЧЕСКАЯ ФО́РМУЛА
В книжной версии
Том 3. Москва, 2005, стр. 62
Скопировать библиографическую ссылку:
БАРОМЕТРИ́ЧЕСКАЯ ФО́РМУЛА, формула, определяющая зависимость давления или плотности газа от высоты в поле тяжести. Б. ф. для газов в поле тяжести Земли следует из уравнения гидростатического равновесия и описывает уменьшение давления $p$ атмосферы с высотой $h$ по экспоненциальному закону: $p = p_0text(–h/H)$ , где $p_0$ – давление у по верхности Земли, $H$ представляет собой отношение ср. кинетич. энергии молекул газа $kT$ к их потенц. энергии $μg$ в поле тяжести и определяется темп-рой $T$ , ср. массой молекулы $μ$ , ускорением свободного падения $g$ и постоянной Больцмана $k$ . Приведённая формула справедлива лишь при условиях постоянства темп-ры газа $T$ и ускорения $g$ , поэтому в реальной атмосфере Б. ф. требует некоторого уточнения вследствие изменений темп-ры и ускорения свободного падения с высотой и географич. широтой. Кроме того, атмосферное давление увеличивается с ростом концентрации в атмосфере паров воды, т. к. при этом уменьшается ср. масса молекулы и, соответственно, возрастает $H$ .
Видео:Все формулы молекулярной физики, МКТ 10 класс, + преобразования и шпаргалкиСкачать

Идеальный газ в поле силы тяжести. Барометрическая формула.Распределение Больцмана.
Макроскопическая система, макроскопические параметры. Идеальный газ, уравнение состояния идеального газа.
Макроскопическая система — система, состоящая из большого числа частиц.
Макроскопические параметры – параметры значения, которых можно определить с помощью приборов, ничего не зная об атомно-молекулярном строении вещества (давление, объем, температура).
Идеальным называют газ, взаимодействием, между молекулами которого можно пренебречь.
Уравнения состояния идеального газа:
Законы идеальных газов: Бойля-Мариотта, Гей-Люссака, Авогадро, Дальтона.
Закон Бойля-Мариотта: При постоянной температуре и массе идеального газа произведение его давления и объёма постоянно. Формула: pV = const
Закон Гей-Люссака:при постоянном давлении объём постоянной массы газа пропорционален абсолютной температуре. Формула: V/T=const
Закон Авогадро: в равных объёмах различных газов, взятых при одинаковых температуре и давлении, содержится одно и то же число молекул.
Закон Дальтона: Давление смеси химически не взаимодействующих идеальных газов равно сумме парциальных давлений.
Внутренняя энергия идеального газа. Степени свободы. Теорема о равномерном распределении кинетической энергии по степеням свободы.
В теории идеального газа потенциальная энергия взаимодействия молекул считается равной нулю. Поэтому внутренняя энергия идеального газа определяется кинетической энергией движения всех его молекул. Формула:
Степени свободы — характеристики движения механической системы. Число степеней свободы определяет минимальное количество независимых переменных, необходимых для полного описания движения механической системы.
В состоянии термодинамического равновесия на каждую степень свободы движения частиц вещества приходится кинетическая энергия в среднем, равная kT/2.
Основное уравнение молекулярно-кинетической теории. Средняя кинетическая энергия молекул, молекулярно-кинетический смысл температуры.
Основное уравнение МКТ связывает макроскопические параметрыгазовой системы с микроскопическими.
Средняя кинетическая энергия молекул:
Температура определяется через микроскопические характеристики системы и служит мерой энергии неупорядоченного движения частиц.
5. Функция распределения молекул по скоростям. Распределение Максвелла.
Распределение Максвелла — распределение вероятности, встречающееся в физике и химии. Оно лежит в основании кинетической теории газов, которая объясняет многие фундаментальные свойства газов, включая давление и диффузию.
Идеальный газ в поле силы тяжести. Барометрическая формула.Распределение Больцмана.
В идеальном газе, находящемся во внешнем поле сил, каждая отдельная частица приобретает импульс в направлении силы, а также соответствующую потенциальную энергию. Однако в газе наряду с упорядоченным движением в направлении действия силы существует хаотическое тепловое движение. В результате конкуренции между этими двумя типами движений возникает неравномерное распределение макроскопических параметров: плотности частиц, давления, температуры по объему, занимаемому газом.
Барометрическая формула — зависимость давления или плотности газа от высоты в поле тяжести.
В присутствии гравитационного поля (или, в общем случае, любого потенциального поля) на молекулы газа действует сила тяжести. В результате, концентрация молекул газа оказывается зависящей от высоты в соответствии с законом распределения Больцмана:
🌟 Видео
Физика 10 класс (Урок№18 - Основное уравнение МКТ.)Скачать

Молекулярно-кинетическая теория | ЕГЭ по физике 2023 | Снежа Планк из ВебиумСкачать

Урок 147. Задачи на основное уравнение МКТ идеального газаСкачать

Идеальный газ в молекулярно-кинетической теории | Физика 10 класс #28 | ИнфоурокСкачать

Физика. МКТ: Основное уравнение МКТ. Центр онлайн-обучения «Фоксфорд»Скачать

Урок 145. Идеальный газ. Основное ур-ние МКТ ид. газа - 1Скачать

Свойства пределов функции | матан #015 | Борис Трушин |Скачать

Решение задач на основное уравнение МКТ идеального газа | Физика 10 класс #29 | ИнфоурокСкачать

Всё МКТ и термодинамика за 6 ЧАСОВ! | ЕГЭ физика 2022Скачать

Основы молекулярной физики | барометрическая формула | для взрослыхСкачать

Урок 146. Основное уравнение МКТ идеального газа - 2Скачать

Физика. МКТ: Основные положения МКТ и их опытное обоснование. Центр онлайн-обучения «Фоксфорд»Скачать

Основные положения молекулярно-кинетической теории | Физика 10 класс #24 | ИнфоурокСкачать

Вывод основного уравнения МКТ (самая убойная тема школы)Скачать

Основные положения молекулярно-кинетической теории газов и ее опытное обоснование. 10 класс.Скачать

Идеальный газ. Основное уравнение молекулярно-кинетической теории газов. Практическая часть.10 классСкачать

Распределение Максвелла — Больцмана (часть 6) | Термодинамика | ФизикаСкачать







