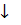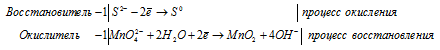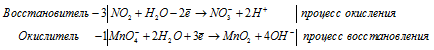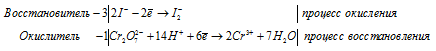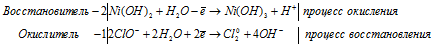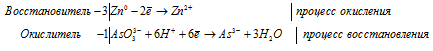Реакция с хроматом (или бихроматом) калия. Налейте в пробирку 1—2 капли раствора какой-либо соли бария, например BaCl2, и прибавьте несколько капель раствора K2CrO4 или КгСг207. Нагрейте пробирку на водяной бане. При этом выпадает желтый кристаллический осадок:
BaCl2 + K2CrO4 —> ^BaCrO4 + 2KCl
Ва++ +CrO4- —* ^BaCrO4 2BaCl2 + K2Cr2O7 + H2O |2BaCr04 + 2KCl + 2HCl
+ H2O —* ф2ВаСг04 + 2Н+
В присутствии ацетата натрия происходит количественное осаждение BaCrO4 бихроматом калия.
Объясним, для какой цели при отделении Ba++ действием K2Cr2O? прибавляют ацетат натрия. Чтобы понять различие в действии растворимых хроматов и бихроматов, рассмотрим следующие равновесия, существующие в растворах этих реактивов;
Cr2Op + H2O ^z± 2HCr07 (а)
2HCrO4- ^± 2H++ 2CrO4- (б)
Сг2°Г + Н2° ч=^ 2CrO4″» + 2H+
В водном растворе хромата концентрация CrO4″ достаточно высока для того, чтобы в надлежащих условиях осадить хроматы бария и даже стронция из концентрированных растворов его солей. С повышением концентрации ионов водорода равновесие указанных реакций сдвигается в сторону образования HCrO4 и Cr2Oz». Хромат бария, однако, настолько плохо растворяется, что концентрация CrO4″ в уксуснокислом растворе все же оказывается достаточной для его осаждения, но недостаточной для осаждения хроматов стронция и кальция.
Полному осаждению Ва++ в виде хромата мешает относительно большая концентрация ионов водорода, увеличивающаяся по мере связывания CrO4″ в BaCrO4.
Для того чтобы достигнуть полноты осаждения BaCrO4, необходимо уменьшить концентрацию ионов водорода. Для этого добавляют
раствор ацетата натрия, который связывает ионы водорода, образуя молекулы слабодиссоциированной уксусной кислоты:
В результате получается буферная смесь, состоящая из уксусной кислоты и ее натриевой соли (см. гл. I, § 17).
Если реакцию проводят со смесью Са++, Sr++ и Ва++, то в кислом растворе хроматы щелочноземельных металлов не осаждаются, но при добавлении ацетата натрия, вследствие сильного понижения концентрации ионов водорода, выпадает BaCrO4.
Вычислим, при какой величине рН раствора растворяется BaCrO4. Соединение считается практически нерастворимым, если величина его растворимости Рклап = [Kt+4″] = 10
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Частные реакции катионов третьей аналитической группы
Реакции катиона бария Ba 2+
1. Реакция окрашивания пламени. Летучие соли бария окрашивают пламя газовой горелки в желто-зеленый цвет. Реакция является фармакопейной.
Выполнение реакции. Соль бария (лучше BaCl2 ) смачивают хлороводородной кислотой и вносят в основание пламени на тонкой платиновой проволоке или на грифеле, а затем переводят в зону пламени с наивысшей температурой.
2. Разбавленная серная кислота H2SO4 и растворимые сульфаты выделяют даже из очень разбавленных растворов осадок сульфата бария:
BaCl2 + H2SO4 
Ba 2+ + SO4 2- 
Осадок не растворяется в кислотах и щелочах. Реакция является фармакопейной.
Выполнение реакции. К одной капле раствора соли бария добавляют одну каплю разбавленной серной кислоты.
3. Карбонат аммония (NH4)2CO3 или другой растворимый карбонат с солями бария дает белый осадок карбоната бария:
BaCl2 + (NH4)2CO3 
Ba 2+ + CO3 2- 
Осадок растворим в разбавленных минеральных кислотах и в уксусной кислоте (но не в серной, так как в этом случае образуется нерастворимый сульфат бария). Осаждение следует вести в слабощелочной среде, лучше в аммиачной.
Выполнение реакции. В пробирку помещают 2 капли раствора BaCl2 или Ba(NO3)2, добавляют 1 каплю разбавленного раствора аммиака и 2 капли раствора карбоната аммония.
4. Хромат калия K2CrO4 или натрия Na2CrO4 осаждает из нейтральных или уксуснокислых растворов бариевой соли хромат бария желтого цвета:
BaCl2 + K2CrO4 
Ba 2+ + CrO4 2- 
Выполнение реакции. К одной капле раствора бариевой соли добавляют 1 каплю раствора хромата калия.
5. Дихромат калия K2Cr2O7 осаждает из растворов солей бария также желтый осадок BaCrO4:
2BaCl2 + K2Cr2O7 + H2O 

2Ba 2+ + Cr2O7 2- + H2O 

Осадок BaCrO4 растворим в сильных кислотах, поэтому реакция не доходит до конца (сильная кислота HCl образуется в результате самой реакции). Если к раствору добавить ацетат натрия, хлороводородная кислота будет замещена слабой уксусной кислотой
CH3COONa + HCl 
И реакция практически дойдет до конца.
Выполнение реакции. К 1-2 каплям раствора бариевой соли добавляют 2 капли раствора ацетата натрия и 2 капли раствора дихромата калия.
6. Оксалат аммония (NH4)2C2O4 образует с солями бария белый осадок, растворимый в хлороводородной и азотной кислотах, а в уксусной кислоте только при кипячении:
BaCl2 + (NH4)2C2O4 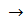
Ba 2+ + C2O4 2- 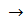
Выполнение реакции. К 2 каплям раствора соли бария добавляют 2 капли раствора оксалата аммония.
Реакции катиона Ca 2+
1. Реакция окрашивания пламени. Летучие соли кальция окрашивают бесцветное газовое пламя в кирпично-красный цвет. Реакция является фармакопейной.
Выполнение реакции. Реакция выполняется так же, как описано для катиона бария.
2. Разбавленная серная кислота H2SO4 образует с ионом кальция белый осадок сульфата кальция:
CaCl2 + H2SO4 
Ca 2+ + SO4 2- 
Вследствие достаточно высокой растворимости сульфата кальция (2 г/л) осаждение возможно только из достаточно концентрированных растворов солей кальция. Более полное осаждение сульфата происходит при добавлении к раствору этилового спирта.
Выполнение реакции. К 3 каплям раствора соли кальция добавляют 3-4 капли разбавленной серной кислоты. К помутневшему раствору приливают 8-10 капель этилового спирта. Наблюдают выделение осадка.
3. Карбонат аммония (NH4)2CO3 осаждает карбонат кальция в виде осадка белого цвета:
CaCl2 + (NH4)2CO3 
Ca 2+ + CO3 2- 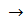
Для полного осаждения кальция необходим достаточный избыток осадителя. Осадок растворим в разбавленных минеральных кислотах и в уксусной кислоте. Осаждение следует проводить в аммиачной среде.
Выполнение реакции. В пробирку помещают 2 капли раствора соли кальция, добавляют 1 каплю разбавленного раствора аммиака и 2 капли раствора карбоната аммония.
4. Оксалат аммония (NH4)2C2O4 дает на холоду в нейтральных и слабощелочных растворах белый мелкокристаллический осадок оксалата кальция:
CaCl2 + (NH4)2C2O4 
Ca 2+ + C2O4 2- 
Осадок не растворим в уксусной кислоте, но легко растворим в минеральных кислотах. Реакцию с оксалатом аммония нельзя проводить в присутствии солей бария, так как ион Ba 2+ образует с оксалатом аммония белый осадок ВaC2O4.
Это наиболее важная качественная реакция иона Са 2+ . Она является фармакопейной.
Выполнение реакции. К 2 каплям раствора хлорида кальция добавляют 2 капли раствора оксалата аммония.
5. Гексацианоферрат (II) калия (желтая кровяная соль К4[Fe(CN)6]) с солями кальция образует в слабощелочной среде белый кристаллический осадок, нерастворимый в уксусной кислоте:
CaCl2 + К4[Fe(CN)6] + NH4Cl 
Ca 2+ + K + + NH4 + + [Fe(CN)6] 3- 
В присутствии значительных количеств иона Ba 2+ не рекомендуется применять эту реакцию для открытия ионов Ca 2+ , так как ион Ba 2+ при достаточном количестве может дать осадок с К4[Fe(CN)6].
Выполнение реакции. В пробирку помещают 2 капли раствора хлорида кальция, добавляют 1 каплю раствора хлорида аммония и 2 капли раствора аммиака до щелочной реакции и нагревают 1-2 минуты на водяной бане. К горячему раствору прибавляют 5-6 капель 0,5 М раствора желтой кровяной соли. Вновь нагревают 2-3 минуты на водяной бане. Реакция менее чувствительна, чем с оксалатом аммония.
6. Микрокристаллоскопическая реакция. Разбавленная серная кислота образует с солями кальция иглообразные кристаллы СaSO4*2H2O.
Выполнение реакции. На предметное стекло помещают одну каплю раствора соли кальция и рядом одну каплю разбавленной серной кислоты. Соединяют стеклянной палочкой обе капли и слегка подсушивают (но не высушивают досуха!) над огнем до появления каемки по краям капли. Образующиеся кристаллы рассматривают под микроскопом.
Задания для самостоятельной работы
учащихся по теме:
«Катионы 3 аналитической группы, анализ смеси катионов 1,2,3 аналитических групп»
1.Какие катионы относятся к третьей аналитической группе . Назовите групповой реагент третьей аналитической группы.
2.Какую роль в организме человека играют ионы Ca 2+ ,Ba 2+ . Какие соли этих катионов используются в медицине.
3.Напишите в молекулярном и ионном виде реакции обнаружения на катион Ba 2+ .
4.Допишите реакцию взаимодействия:
а) Pb(NO3)2 + 2KOH
б) Pb(NO3)2 + K2CrO4
в) CaCl2 + H2SO4
г) CaCl2 + (NH4)2CO3
д) CaCl2 + (NH4)2C2O4
е) CaCl2 + К4[Fe(CN)6] + NH4Cl
5.На какой из катионов 3 аналитической группы проводится микроскопическая реакция. Опишите ее выполнение.
6.Какой катион второй группы при систематическом анализе смеси катионов 1,2,3 групп может оказаться вместе с катионами третьей группы
7.Почему сульфаты катионов третьей аналитической группы необходимо превращать в карбонаты
8.Какой реактив в качестве катализатора следует добавить в реакционную среду при взаимодействии серной кислоты и Са 2+ для полного осаждения продукта реакции?
9. В какой цвет окрашивают пламя горелки соли бария?
а) зеленый в) кирпично-красный
б) фиолетовый г) желто-зеленый
10.В каком реактиве растворяется осадок, образующийся в реакции хромата калия с солями бария?
Видео:Oxidation of ethanol (CH3CH2OH + K2Cr2O7)Скачать

Составление уравнений в ионно-молекулярной форме
S 2 — + MnO4 2- + 2H2O = MnO2 + S 0 + 4OH —
После приведения членов обеих частей уравнения, получим:
Уравнение в ионно-молекулярной форме:
4K + + S 2- + MnO4 2- + 2H2O = S + MnO2 + 4K + + 4OH — .
После приведения членов обеих частей уравнения, получим:
Уравнение в ионно-молекулярной форме:
После приведения членов обеих частей уравнения, получим:
Для уравнивания добавим в уравнение 1 моль K2SO4, получим:
Уравнение в ионно-молекулярной форме:
После приведения членов обеих частей уравнения, получим:
Уравнение в ионно-молекулярной форме:
3Zn 0 + AsO3 3- + 6H + = 3Zn 2+ + As 3- + 3H2O.
После приведения членов обеих частей уравнения, получим:
📽️ Видео
valoración de sulfato con BaCl2 y K2Cr2O7 como indicadorСкачать

Проклятая химическая реакция 😜 #shortsСкачать

Ba(NO3)2+Na2SiO3=BaSiO3+NaNO3 Ионное и молекулярное уравнения реакции, демонстрация.Скачать

Ионные уравнения реакций. Составляем полные и сокращенные ионные уравнения. Часть 1.Скачать

Na2S+Na2Cr2O7+H2SO4=S+Cr2(SO4)3+Na2SO4+H2O расстановка коэффициентов методом электронного балансаСкачать

Oxidation Number method. K2Cr2O7+HCl=KCl+CrCl3+Cl2+H2O. Balance the equation by oxidation NumberСкачать

How to Write the Net Ionic Equation for BaCl2 + K2S = BaS + KClСкачать

Reacciones de Precipitación. Experimento de Química.Скачать

BaCl2 + Na2SO4 → BaSO4↓ + 2 NaClСкачать

HCl+KMnO4=MnCl2+Cl2+KCl+H2O Расстановка коэффициентов методом электронного баланса в ОВР 10.47бСкачать

How to Balance BaCl2 + (NH4)2CO3 = BaCO3 + NH4ClСкачать

How to Balance Ba(ClO3)2 = BaCl2 + O2 (Decomposition of Barium chlorate)Скачать

Окисление иодида калия KI + H2O2, KI + CuSO4, KI + Fe(NO3)3, KI + KMnO4Скачать

#132 | Thí nghiệm về BaCl2 💚Скачать

How to Balance Ba + Cl2 = BaCl2 (Barium + Chlorine gas)Скачать

How to Write the Net Ionic Equation for Ba(OH)2 + NH4Cl = BaCl2 + NH3 + H2OСкачать

Разложение гидроксида меди II (Cu(OH)2 = CuO + H2O)Скачать

How to Balance BaCl2 + NaOH = Ba(OH)2 + NaCl (Barium chloride + Sodium hydroxide)Скачать