- Ваш ответ
- решение вопроса
- Похожие вопросы
- Ацетат свинца гидролиз ионно молекулярное уравнение
- ПРИМЕР 2
- ПРИМЕР 3
- Для воды и ее растворов произведение концентрации ионов Н + и О Н — величина постоянная при данной температуре и называется ионным произведением воды Кв. При 25 о С Кв = [ H + ] · [ OH — ] = 1·10 -14 . Постоянство ионного произведения воды дает возможность вычислить концентрацию одного вида ионов, если известна концентрация другого вида ионов, а именно:
- Гидролиз солей
- 📹 Видео
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Ваш ответ
Видео:Гидролиз солей. 9 класс.Скачать

решение вопроса
Видео:Химия | Молекулярные и ионные уравненияСкачать

Похожие вопросы
- Все категории
- экономические 43,289
- гуманитарные 33,621
- юридические 17,900
- школьный раздел 607,151
- разное 16,830
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Видео:Гидролиз солей. Классификация солей. Решение примеров.Скачать

Ацетат свинца гидролиз ионно молекулярное уравнение
Лабораторная работа № 8
Цель работы: исследование процесса гидролиза солей и установление факторов, влияющих на гидролиз.
1. ТЕОРЕТИЧЕСКОЕ ВВЕДЕНИЕ
При растворении некоторых солей в воде нарушается равновесие диссоциации воды. Это является результатом обменных реакций растворенного вещества с растворителем, приводящих к образованию труднорастворимых , газообразных и малодиссоциирующих соединений. Такое обменное взаимодействие растворенного вещества с водой называется гидролизом.
В зависимости от природы растворенного вещества, его гидролиз может происходить по-разному. Так если соль образована сильной кислотой и основанием равной силы, то она полностью распадается в воде на свои составные части, а ее катионы и анионы, сталкиваясь с ионами Н + и О Н — , практически ими не связываются. Происходит это по тому, что получающиеся в результате такого столкновения сильные кислота и основание, вновь моментально распадаются на ионы. Поэтому равновесие электролитической диссоциации воды не смещается, концентрац ия ио нов водорода и гидроксида остается постоянной, равной 10 -7 моль/литр.
Гидролизу подвергаются все остальные соли:
· образованные катионом сольного основания и анионом слабой кислоты – происходит гидролиз по аниону;
· образованные катионом слабого основания и анионом сильной кислоты – происходит гидролиз по катиону;
· образованные катионом слабого основания и анионом слабой кислоты – происходит гидролиз и по катиону и по аниону.
Процесс гидролиза количественно характеризуется степенью гидролиза ( h ) и константой гидролиза ( Кг). Степенью гидролиза называется отношение числа молекул, подвергшихся гидролизу ( Сгидр .), к общему числу растворенных молекул ( Собщ .):

Степень гидролиза зависит от следующих факторов:
2. ее концентрации;
3. температуры раствора.
Разбавление раствора равноценно увеличению концентрации одного из реагирующих веществ (воды) и приводит к усилению гидролиза. Гидролиз концентрированных растворов происходит слабее. Процесс гидролиза эндотермичен, по этому с повышением температуры протекает полнее. Следовательно при гидролизе соблюдается принцип Ле-Шателье . Константой гидролиза (Кг) называется — отношение произведения концентрации продуктов гидролиза к концентрации негидролизованной соли (определяется обычно по таблицам). Величина Кг, в отличие от степени гидролиза, не зависит от концентрации раствора, поэтому является более удобной характеристикой процесса. Обе величины связаны между собой отношением аналогичным закону разбавления:

где С – исходная концентрация соли в растворе, (моль/литр).
Если степень гидролиза мала ( h Кг = h 2 * С ,

Составьте молекулярн ое и ио нно-молекулярное уравнение гидролиза солей: а) NaCN , б) К2СО3
а) Цианид натрия Na С N – соль слабой одноосновной кислоты HCN и сильного основания NaOH . При растворении в воде молекулы NaCN полностью диссоциируют на катионы Na + и анионы CN . Катионы Na + не могут связывать ионы О Н — воды , так как NaOH – сильный электролит . Анионы же CN — связывают ионы Н + воды , образуя молекулы слабого электролита HCN . Соль гидролизуется , как говорят , по аниону. Ионно-молекулярное уравнение гидролиза:
CN — + H 2 O ⇄ HCN + OH —
или в молекулярной форме:
NaCN + H 2 O ⇄ HCN + NaOH
В результате гидролиза в растворе появляется некоторый избыток ионов О Н — , поэтому раствор NaCN имеет щелочную реакцию ( рН > 7).
б) Карбонат калия K 2 CO 3 – соль слабой многоосновной кислоты и сильного основания. В этом случае анионы соли СО3 2- , связывая водородн ые ио ны воды, образуют анионы кислой соли НСО3 — , а не молекулы Н2СО3. В обычных условиях гидролиз идет по первой ступени, соль гидролизуется по аниону. Ионно-молекулярное уравнение гидролиза:
или в молекулярной форме:
В растворе появляется избыток ионов О Н — ,поэтому раствор К2СО3 имеет щелочную реакцию рН >7.
ПРИМЕР 2
Составьте молекулярн ое и ио нно-молекулярное уравнение реакции гидролиза соли CuCl 2 .
Хлорид меди – соль слабого многокислотного основания Cu ( OH )2 и сильной кислоты HCl . В данном случае катионы Cu 2+ связывают гидроксильные ионы воды, образуя катионы основной соли CuOH + . Образование молекул С u ( OH )2 не происходит, так как ионы CuOH + диссоциируют гораздо треднее , чем молекулы Cu ( OH )2.
В обычных условиях гидролиз идет по первой ступени.
Соль гидролизуется по катиону. Ионно-молекулярное уравнение гидролиза:
Cu 2+ + H 2 O ⇄ CuOH + + H +
или в молекулярной форме:
CuCl 2 + H 2 O ⇄ CuOHCl + HCl
В растворе появляется избыток ионов водорода, поэтому раствор ZnCl 2 имеет кислую реакцию ( рН > 7) .
ПРИМЕР 3
Составьте молекулярн ое и ио нно-молекулярное уравнение реакции гидролиза соли Pb ( CH 3 COO )2 .
Ацетат свинца – соль слабого многокислотного основания Pb ( OH )2 и слабой одноосновной кислоты CH 3 COOH . В данном случае параллельно протекают два процесса:
Pb +2 + H 2 O ⇄ PbOH + + H +
Ионно — молекулярное уравнение:
или в молекулярной форме:
Реакция раствора при этом зависит от относительной силы кислоты и основания, образующих соль. Если Ккисл . = Косн ., то катион и анион гидролизуются в равной степени и реакция раствора будет нейтральной ( рН = 7). Если Ккисл . > Косн ., то катион соли гидролизуется в большей степени, чем анион, и концентрации О Н — — ионов. В данном случае реакция раствора слабокислая. Наконец, если Ккисл . Косн ., то гидролизу преимущественно подвергается анион соли, и реакция раствора будет слабощелочной.
Какие продукты образуются при смешивании растворов солей Fe ( NO 3 )3 и Na 2 CO 3 ? Составьте ионно-молекулярное и молекулярное уравнение реакции.
Решение: Соль Fe ( NO 3 )3 гидролизуется по катиону, а Na 2 CO 3 – по аниону.
Fe 3+ + Н2О ⇄ Fe ОН 2+ + Н +
Гидролиз этих солей обычно ограничивается первой ступенью. При смешивании растворов этих солей ионы Н + и ОН ־ взаимодействуют, образуя молекулы слабого электролита. Это приводит к тому, что усиливается гидролиз каждой из солей до образования осадка и газа: Fe ( ОН)3 и СО2
Для воды и ее растворов произведение концентрации ионов Н + и О Н — величина постоянная при данной температуре и называется ионным произведением воды Кв. При 25 о С Кв = [ H + ] · [ OH — ] = 1·10 -14 . Постоянство ионного произведения воды дает возможность вычислить концентрацию одного вида ионов, если известна концентрация другого вида ионов, а именно:


В чистой воде [H + ] = [OH — ] = 
Концентрац ия ио нов водорода указывает на характер среды:
[ H + ] = [ OH — ] = 10 -7 моль/ л , нейтральная среда;
[ H + ] > 10 -7 моль/ л , кислая среда;
[ H + ] -7 моль/ л , щелочная среда.
Для удобства оценки кислотности и щелочности среды пользуются не концентрацией водородных ионов, а величиной водородного показателя рН , он равен отрицательному десятичному логарифму концентрации водородных ионов рН = — lg [ H + ], следовательно, в щелочной среде рН > 7; в нейтральной среде рН = 7, в кислой среде рН
Вычислить рН раствора, если [ H + ] = 0,0001 = 10 -4 моль/ л .
Решение : [ H + ]= 0,0001 = 10 -4 моль/ л .
рН = — lg 10 -4 = 4; рН = 4
2. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
ОПЫТ 1. РЕАКЦИЯ СРЕДЫ В РАСТВОРАХ РАЗЛИЧНЫХ СОЛЕЙ.
В пять пробирок до 1/3 их объема налить нейтральный раствор лакмуса. Одну пробирку оставить в качестве контрольной, а в остальные добавить по одному микрошпателю кристаллов следующих солей: в первую – хлорида алюминия, во вторую – карбоната натрия, в третью – хлорида калия, в четвертую – ацетата аммония.
По изменению окраски лакмуса сделать вывод о реакции среды в растворе каждой соли. Полученные результаты внести в таблицу.
Видео:ГИДРОЛИЗ СОЛЕЙ | 9 класс | Кратко и понятноСкачать

Гидролиз солей
Водные растворы солей имеют разные значения рН и показывают различную реакцию среды — кислую, щелочную, нейтральную.
Например, водный раствор хлорида алюминия AlCl3 имеет кислую среду (рН 7), растворы хлорида натрия NaCl и нитрита свинца Pb(NO2)2 — нейтральную среду (pН = 7). Эти соли не содержат в своем составе ионы водорода Н + или гидроксид-ионы ОН — , которые определяют среду раствора. Чем же можно объяснить различные среды водных растворов солей? Это объясняется тем, что в водных растворах соли подвергаются гидролизу.
Слово «гидролиз» означает разложение водой («гидро» — вода, «лизис» — разложение).
Гидролиз — одно из важнейших химических свойств солей.
Гидролизом соли называется взаимодействие ионов соли с водой, в результате которого образуются слабые электролиты.
Сущность гидролиза сводится к химическому взаимодействию катионов или анионов соли с гидроксид-ионами ОН — или ионами водорода Н + из молекул воды. В результате этого взаимодействия образуется малодиссоциирующее соединение (слабый электролит). Химическое равновесие процесса диссоциации воды смещается вправо.
Поэтому в водном растворе соли появляется избыток свободных ионов Н + или ОН — , и раствор соли показывает кислую или щелочную среду.
Гидролиз — процесс обратимый для большинства солей. В состоянии равновесия только небольшая часть ионов соли гидролизуется.
Любую соль можно представить как продукт взаимодействия кислоты с основанием. Например, соль NaClO образована слабой кислотой HClO и сильным основанием NaOH.
В зависимости от силы исходной кислоты и исходного основания соли можно разделить на 4 типа:
Соли I, II, III типов подвергаются гидролизу, соли IV типа не подвергаются гидролизу
Рассмотрим примеры гидролиза различных типов солей.
I. Соли, образованные сильным основанием и слабой кислотой, подвергаются гидролизу по аниону. Эти соли образованы катионом сильного основания и анионом слабой кислоты, который связывает катион водорода Н + молекулы воды, образуя слабый электролит (кислоту).
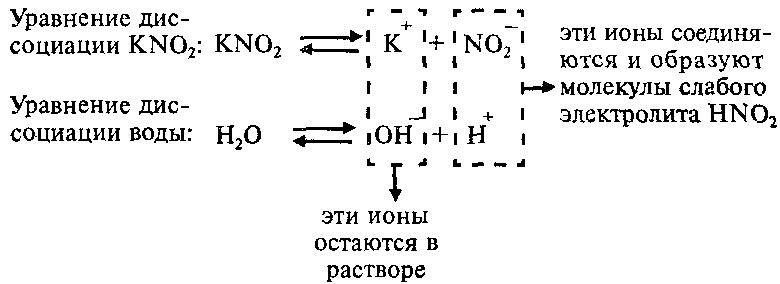
Пример: Составим молекулярное и ионные уравнения гидролиза нитрита калия KNO2.
Соль KNO2 образована слабой одноосновной кислотой HNO2 и сильным основанием KОН, что можно изобразить схематически так:
Напишем уравнение гидролиза соли KNO2:
Каков механизм гидролиза этой соли?
Так как ионы Н + соединяются в молекулы слабого электролита HNО2, их концентрация уменьшается и равновесие процесса диссоциации воды по принципу Ле-Шателье смещается вправо. В растворе увеличивается концентрация свободных гидроксид-ионов ОН — . Поэтому раствор соли KNO2 имеет щелочную реакцию (pН > 7).
Вывод: Соли, образованные сильным основанием и слабой кислотой, при растворении в воде показывают щелочную реакцию среды, pН > 7.
II. Соли, образованные слабым основанием и сильной кислотой, гидролизуются по катиону. Эти соли образованы катионом слабого основания и анионом сильной кислоты. Катион соли связывает гидроксид-ион ОН — воды, образуя слабый электролит (основание).
Пример: Составим молекулярное и ионное уравнения гидролиза йодида аммония NH4I.
Соль NH4I образована слабым однокислотным основанием NH4OH и сильной кислотой НI:
При растворении в воде соли NH4I катионы аммония NH4 + связываются с гидроксид-ионами ОН — воды, образуя слабый электролит – гидроксид аммония NH4OH. В растворе появляется избыток ионов водорода Н + . Среда раствора соли NH4I – кислая, рН — из молекулы воды и образует слабое основание, и анионом слабой кислоты, который связывает ионы Н + из молекулы воды и образует слабую кислоту. Реакция растворов этих солей может быть нейтральной, слабокислой или слабощелочной. Это зависит от констант диссоциации слабой кислоты и слабого основания, которые образуются в результате гидролиза.
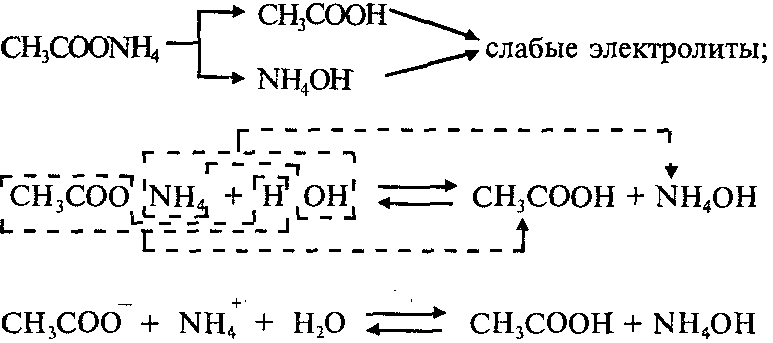
Пример 1: Составим уравнения гидролиза ацетата аммония CH3COONH4. Эта соль образована слабой уксусной кислотой СН3СООН и слабым основанием NH4ОH:
Реакция раствора соли CH3COONH4 – нейтральная (рН=7), потому что Kд(СН3СООН)=Kд(NH4ОH).
Пример 2: Составим уравнения гидролиза цианида аммония NH4CN. Эта соль образована слабой кислотой HCN и слабым основанием NH4ОH:
Реакция раствора соли NH4CN — слабощелочная (pН > 7), потому что Kд(NH4ОH)> Kд(HCN).
Как уже было отмечено, для большинства солей гидролиз является обратимым процессом. В состоянии равновесия гидролизуется только небольшая часть соли. Однако некоторые соли полностью разлагаются водой, т. е. для них гидролиз является необратимым.
Необратимому (полному) гидролизу подвергаются соли, которые образованы слабым нерастворимым или летучим основанием и слабой летучей или нерастворимой кислотой. Такие соли не могут существовать в водных растворах, К ним, например, относятся:
Пример: Составим уравнение гидролиза сульфида алюминия Al2S3:
Гидролиз сульфида алюминия протекает практически полностью до образования гидроксида алюминия Al(OH)3 и сероводорода H2S.
Поэтому в результате обменных реакций между водными растворами некоторых солей не всегда образуются две новые соли. Одна из этих солей может подвергаться необратимому гидролизу с образованием соответствующего нерастворимого основания и слабой летучей (нераствориой) кислоты. Например:
Суммируя эти уравнения, получаем:
или в ионном виде:
IV. Соли, образованные сильной кислотой и сильным основанием, не гидролизуются, потому что катионы и анионы этих солей не связываются с ионами Н + или ОН — воды, т. е. не образуют с ними молекул слабых электролитов. Равновесие диссоциации воды не смещается. Среда растворов этих солей — нейтральная (рН = 7,0), так как концентрации ионов Н + и ОН — в их растворах равны, как в чистой воде.
Вывод: Соли, образованные сильной кислотой и сильным основанием, при растворении в воде гидролизу не подвергаются и показывают нейтральную реакцию среды (рН = 7,0).
Ступенчатый гидролиз
Гидролиз солей может протекать ступенчато. Рассмотрим случаи ступенчатого гидролиза.
Если соль образована слабой многоосновной кислотой и сильным основанием, число ступеней гидролиза зависит от основности слабой кислоты. В водном растворе таких солей на первых ступенях гидролиза образуются кислая соль вместо кислоты и сильное основание. Ступенчато гидролизуюгся соли Na2SO3, Rb2CО3, K2SiO3, Li3PO4 и др.
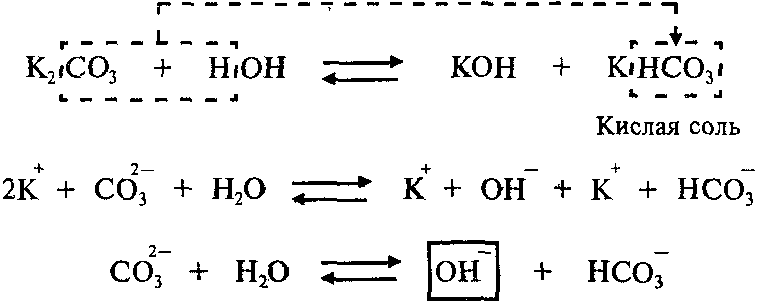
Пример: Составим молекулярное и ионное уравнения гидролиза карбоната калия K2СО3.
Гидролиз соли K2СО3 протекает по аниону, потому что соль карбонат калия образована слабой кислотой Н2СО3 и сильным основанием KОН:
Так как Н2СО3 – двухосновная кислота, гидролиз K2СО3 протекает по двум ступеням.
Продуктами первой ступени гидролиза K2СО3 являются кислая соль KHCO3 и гидроксид калия KОН.
Вторая ступень (гидролиз кислой соли, которая образовалась в результате первой ступени):
Продуктами второй ступени гидролиза K2СО3 являются гидроксид калия и слабая угольная кислота Н2СО3. Гидролиз по второй ступени протекает в значительно меньшей степени, чем по первой ступени.
Среда раствора соли K2СО3 — щелочная (рН > 7), потому что в растворе увеличивается концентрация ионов ОН — .
Если соль образована слабым многокислотным основанием и сильной кислотой, то число ступеней гидролиза зависит от кислотности слабого основания. В водных растворах таких солей на первых ступенях образуется основная соль вместо основания и сильная кислота. Ступенчато гидролизуются соли MgSО4, CoI2, Al2(SO4)3, ZnBr2 и др.
Пример: Составим молекулярное и ионное уравнения гидролиза хлорида никеля (II) NiCl2.
Гидролиз соли NiCl2 протекает по катиону, так как соль образована слабым основанием Ni(OH)2 и сильной кислотой НСl. Катион Ni 2+ связывает гидроксид-ионы ОН — воды. Ni(OH)2 — двухкислотное основание, поэтому гидролиз протекает по двум ступеням.
Продуктами первой ступени гидролиза NiCl2 являются основная соль NiOHCl и сильная кислота HCl.
Вторая ступень (гидролиз основной соли, которая образовалась в результате первой ступени гидролиза):
Продуктами второй ступени гидролиза являются слабое основание гидроксид никеля (II) и сильная хлороводородная кислота НCl. Однако степень гидролиза по второй ступени намного меньше, чем по первой ступени.
Среда раствора NiCl2 — кислая, рН + .
Гидролизу подвергаются не только соли, но и другие неорганические соединения. Гидролизуются также жиры, углеводы, белки и другие вещества, свойства которых изучаются в курсе органической химии. Поэтому можно дать более общее определение процесса гидролиза:
Гидролиз — это реакция обменного разложения веществ водой.
📹 Видео
Гидролиз солей. Практическая часть. 10 класс.Скачать

Гидролиз солей. 1 часть. 11 класс.Скачать

Гидролиз солей. Теория для задания 23 ЕГЭ по химии.Скачать

РТ по химии 2 этап | 2023-2024 | Полный разборСкачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Химия 9 класс (Урок№8 - Гидролиз солей.)Скачать

Ступенчатый гидролиз солей по аниону. Решаем примеры.Скачать

Все типы 6 задания ЕГЭ по химии 2023 | Екатерина СтрогановаСкачать

Амфотерные гидроксиды | Химия ОГЭ 2022 | УмскулСкачать

Совместный гидролиз | Химия ЕГЭ – Екатерина СтрогановаСкачать

Константа гидролиза и pH водного раствора солиСкачать

11 класс. Гидролиз солей.Скачать

Химия | ГидролизСкачать

Примеры решения задач на водородный показатель pH растворов. 11 класс.Скачать

ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать