Бинарные соединения алюминия
- Алюминий
- Положение в периодической системе химических элементов
- Электронное строение алюминия и свойства
- Физические свойства
- Нахождение в природе
- Способы получения
- Качественные реакции
- Химические свойства
- Амфотерные свойства оксида и гидроксида алюминия
- Описание презентации по отдельным слайдам:
- Краткое описание документа:
- Амфотерные оксиды и гидроксиды
- 💥 Видео
Алюминий
Положение в периодической системе химических элементов
Алюминий расположен в главной подгруппе III группы (или в 13 группе в современной форме ПСХЭ) и в третьем периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение алюминия и свойства
Электронная конфигурация алюминия в основном состоянии :
+13Al 1s 2 2s 2 2p 6 3s 2 3p 1 1s 2s 2p 3s 3p
Электронная конфигурация алюминия в возбужденном состоянии :
+13Al * 1s 2 2s 2 2p 6 3s 1 3p 2 1s 2s 2p 3s 3p
Алюминий проявляет парамагнитные свойства. Алюминий на воздухе быстро образует прочные оксидные плёнки, защищающие поверхность от дальнейшего взаимодействия, поэтому устойчив к коррозии.
Физические свойства
Алюминий – лёгкий металл серебристо-белого цвета, легко поддающийся формовке, литью, механической обработке. Обладает высокой тепло- и электропроводностью.
Температура плавления 660 о С, температура кипения 1450 о С, плотность алюминия 2,7 г/см 3 .
Алюминий — один из наиболее ценных цветных металлов для вторичной переработки. На протяжении последних лет, цена на лом алюминия в пунктах приема непреклонно растет. По ссылке можно узнать о том, как сдать лом алюминия.
Нахождение в природе
Алюминий — самый распространенный металл в природе, и 3-й по распространенности среди всех элементов (после кислорода и кремния). Содержание в земной коре — около 8%.
В природе алюминий встречается в виде соединений:
Корунд Al2O3. Красный корунд называют рубином, синий корунд называют сапфиром.
Способы получения
Алюминий образует прочную химическую связь с кислородом. Поэтому традиционные способы получения алюминия восстановлением из оксида протекают требуют больших затрат энергии. Для промышленного получения алюминия используют процесс Холла-Эру. Для понижения температуры плавления оксид алюминия растворяют в расплавленном криолите (при температуре 960-970 о С) Na3AlF6, а затем подвергают электролизу с углеродными электродами. При растворении в расплаве криолита оксид алюминия распадается на ионы:
На катоде происходит восстановление ионов алюминия:
Катод: Al 3+ +3e → Al 0
На аноде происходит окисление алюминат-ионов:
Суммарное уравнение электролиза расплава оксида алюминия:
Лабораторный способ получения алюминия заключается в восстановлении алюминия из безводного хлорида алюминия металлическим калием:
AlCl3 + 3K → Al + 3KCl
Качественные реакции
Качественная реакция на ионы алюминия — взаимодействие избытка солей алюминия с щелочами . При этом образуется белый аморфный осадок гидроксида алюминия.
Например , хлорид алюминия взаимодействует с гидроксидом натрия:
AlCl3 + 3NaOH → Al(OH)3 + 3NaCl
При дальнейшем добавлении щелочи амфотерный гидроксид алюминия растворяется с образованием тетрагидроксоалюмината:
Обратите внимание , если мы поместим соль алюминия в избыток раствора щелочи, то белый осадок гидроксида алюминия не образуется, т.к. в избытке щелочи соединения алюминия сразу переходят в комплекс:
AlCl3 + 4NaOH = Na[Al(OH)4] + 3NaCl
Соли алюминия можно обнаружить с помощью водного раствора аммиака. При взаимодействии растворимых солей алюминия с водным раствором аммиака также в ыпадает полупрозрачный студенистый осадок гидроксида алюминия.
AlCl3 + 3NH3·H2O = Al(OH)3 ↓ + 3NH4Cl
Al 3+ + 3NH3·H2O = Al(OH)3 ↓ + 3NH4 +
Видеоопыт взаимодействия раствора хлорида алюминия с раствором аммиака можно посмотреть здесь.
Химические свойства
1. Алюминий – сильный восстановитель . Поэтому он реагирует со многими неметаллами .
1.1. Алюминий реагируют с галогенами с образованием галогенидов:
1.2. Алюминий реагирует с серой с образованием сульфидов:
1.3. Алюминий реагируют с фосфором . При этом образуются бинарные соединения — фосфиды:
Al + P → AlP
1.4. С азотом алюминий реагирует при нагревании до 1000 о С с образованием нитрида:
2Al + N2 → 2AlN
1.5. Алюминий реагирует с углеродом с образованием карбида алюминия:
1.6. Алюминий взаимодействует с кислородом с образованием оксида:
Видеоопыт взаимодействия алюминия с кислородом воздуха (горение алюминия на воздухе) можно посмотреть здесь.
2. Алюминий взаимодействует со сложными веществами:
2.1. Реагирует ли алюминий с водой? Ответ на этот вопрос вы без труда найдете, если покопаетесь немного в своей памяти. Наверняка хотя бы раз в жизни вы встречались с алюминиевыми кастрюлями или алюминиевыми столовыми приборами. Такой вопрос я любил задавать студентам на экзаменах. Что самое удивительное, ответы я получал разные — у кого-то алюминий таки реагировал с водой. И очень, очень многие сдавались после вопроса: «Может быть, алюминий реагирует с водой при нагревании?» При нагревании алюминий реагировал с водой уже у половины респондентов))
Тем не менее, несложно понять, что алюминий все-таки с водой в обычных условиях (да и при нагревании) не взаимодействует. И мы уже упоминали, почему: из-за образования оксидной пленки . А вот если алюминий очистить от оксидной пленки (например, амальгамировать), то он будет взаимодействовать с водой очень активно с образованием гидроксида алюминия и водорода:
2Al 0 + 6 H2 + O → 2 Al +3 ( OH)3 + 3 H2 0
Амальгаму алюминия можно получить, выдержав кусочки алюминия в растворе хлорида ртути ( II ):
3HgCl2 + 2Al → 2AlCl3 + 3Hg
Видеоопыт взаимодействия амальгамы алюминия с водой можно посмотреть здесь.
2.2. Алюминий взаимодействуют с минеральными кислотами (с соляной, фосфорной и разбавленной серной кислотой). При этом образуются соль и водород.
Например , алюминий бурно реагирует с соляной кислотой :
2Al + 6HCl = 2AlCl3 + 3H2↑
2.3. При обычных условиях алюминий не реагирует с концентрированной серной кислотой из-за пассивации – образования плотной оксидной пленки. При нагревании реакция идет, образуются оксид серы (IV), сульфат алюминия и вода:
2.4. Алюминий не реагирует с концентрированной азотной кислотой также из-за пассивации.
С разбавленной азотной кислотой алюминий реагирует с образованием молекулярного азота:
При взаимодействии алюминия в виде порошка с очень разбавленной азотной кислотой может образоваться нитрат аммония:
2.5. Алюминий – амфотерный металл, поэтому он взаимодействует с щелочами . При взаимодействии алюминия с раствором щелочи образуется тетрагидроксоалюминат и водород:
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2 ↑
Видеоопыт взаимодействия алюминия со щелочью и водой можно посмотреть здесь.
Алюминий реагирует с расплавом щелочи с образованием алюмината и водорода:
2Al + 6NaOH → 2Na3AlO3 + 3H2 ↑
Эту же реакцию можно записать в другом виде (в ЕГЭ рекомендую записывать реакцию именно в таком виде):
2Al + 6NaOH → 2NaAlO2 + 3H2↑ + 2Na2O
2.6. Алюминий восстанавливает менее активные металлы из оксидов . Процесс восстановления металлов из оксидов называется алюмотермия .
Например , алюминий вытесняет медь из оксида меди (II). Реакция очень экзотермическая:
2Al + 3CuO → 3Cu + Al2O3
Еще пример : алюминий восстанавливает железо из железной окалины, оксида железа (II, III):
Восстановительные свойства алюминия также проявляются при взаимодействии его с сильными окислителями: пероксидом натрия, нитратами и нитритами в щелочной среде, перманганатами, соединениями хрома (VI):
Видео:Химия 9 класс (Урок№25 - Алюминий. Свойства алюминия. Амфотерность оксида и гидроксида алюминия.)Скачать

Амфотерные свойства оксида и гидроксида алюминия
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
Рабочие листы и материалы для учителей и воспитателей
Более 300 дидактических материалов для школьного и домашнего обучения
Описание презентации по отдельным слайдам:
Амфотерность оксида и гидроксида алюминия
Дать понятие об амфотерности; Рассмотреть свойства амфотерного оксида и гидроксида алюминия; Повторить, закрепить и развить знания о классификации и свойствах гидроксидов и о генетической связи между классами веществ. Цели урока:
Изучение нового материала: Алюминий в природе:
Повторение изученного материала: Применение алюминия
Оксид алюминия Al2O3 Бокситы Корунд Глинозём горная порода минерал драгоценные камни рубины сапфиры
В очищенном виде Al2O3 — белый тугоплавкий порошок, температура плавления 2044°С, температура кипения 3530°С, плотность 4 г/см3, по твердости близок к алмазу. Получают: 1) 4Al + 3O2 = 2 Al2O3 2) 2Al(OH)3 = Al2O3 + 3H2O Химические свойства: Al2O3 + 6HCl = 2AlCl3 + 3H2O; Al2O3 + 2NaOH + 3H2O = 2Na[Al(OH)4] Al2O3 + 2NaOH = 2NaAlO2 + H2O; Проявляет амфотерные свойства
Гидроксид алюминия Al(OH)3 белое гелеобразное вещество, нерастворимое в воде, входит в состав многих бокситов. типичное амфотерное соединение, свежеполученный гидроксид растворяется в кислотах и щелочах:
Получение гидроксида алюминия В 2 пробирки налейте по 1 мл раствора соли алюминия В обе пробирки прилейте по каплям раствор щелочи до появления белого осадка гидроксида алюминия: AlCl3 + 3NaOH Al(OH)3 + 3NaCl Лабораторный опыт:
Доказательство амфотерности: 1.Взаимодействие с кислотами В одну пробирку с осадком прилейте раствор соляной кислоты. 2.Взаимодействие со щелочами В другую пробирку с осадком прилейте избыток раствора щелочи Лабораторный опыт:
Что наблюдали? Осадки гидроксида алюминия в обеих пробирках растворяются. Вывод: гидроксид алюминия проявляет свойства оснований, взаимодействуя с кислотой, но он также ведет себя и как нерастворимая кислота, взаимодействуя со щелочью. Он проявляет амфотерные свойства.
Al(OH)3 + 3HCl = AlCl3 +3H2O Al(OH)3 + NaOH = Na[Al(OH)4] Запишите уравнения реакций:
Лабораторный опыт От перемены мест слагаемых сумма …. изменяется. 1. В одну пробирку налейте 1 мл соли хлорида алюминия AlCl3 и добавьте 3-4 капли раствора натриевой щелочи NaOH. 2. Во вторую пробирку налейте наоборот- 1 мл натриевой щелочи NaOH и добаьте 3-4 капли соли хлорида алюминия AlCl3.
Что наблюдали? В первой пробирке образовывался осадок, а во второй НЕТ . Вывод: для амфотерных соединений имеет большое значение, в какой последовательности проводить эксперимент! Во втором случае изначально щелочь была в избытке: AlCl3 + 4NaOH = Na[Al(OH)4] + 3NaCl
Генетический ряд алюминия. Осуществите превращения: Na[Al(OH)4] Al Al2O3 AlCl3 Al(OH)3 Al2(SO4)3
Краткое описание документа:
Амфотерность оксида и гидроксида алюминия Дать понятие об амфотерности; Рассмотреть свойства амфотерного оксида и гидроксида алюминия; Повторить, закрепить и развить знания о классификации и свойствах гидроксидов и о генетической связи между классами веществ. Цели урока: Изучение нового материала: Алюминий в природе: Повторение изученного материала: Применение алюминия Оксид алюминия Al2O3 Бокситы Корунд Глинозём горная порода минерал драгоценные камни рубины сапфиры В очищенном виде Al2O3 — белый тугоплавкий порошок, температура плавления 2044°С, температура кипения 3530°С, плотность 4 г/см3, по твердости близок к алмазу. Получают: 1) 4Al + 3O2 = 2 Al2O3 2) 2Al(OH)3 = Al2O3 + 3H2O Химические свойства: Al2O3 + 6HCl = 2AlCl3 + 3H2O; Al2O3 + 2NaOH + 3H2O = 2Na[Al(OH)4] Al2O3 + 2NaOH = 2NaAlO2 + H2O; Проявляет амфотерные свойства Гидроксид алюминия Al(OH)3 белое гелеобразное вещество, нерастворимое в воде, входит в состав многих бокситов. типичное амфотерное соединение, свежеполученный гидроксид растворяется в кислотах и щелочах: Получение гидроксида алюминия В 2 пробирки налейте по 1 мл раствора соли алюминия В обе пробирки прилейте по каплям раствор щелочи до появления белого осадка гидроксида алюминия: AlCl3 + 3NaOH Al(OH)3 + 3NaCl Лабораторный опыт: Доказательство амфотерности: 1.Взаимодействие с кислотами В одну пробирку с осадком прилейте раствор соляной кислоты. 2.Взаимодействие со щелочами В другую пробирку с осадком прилейте избыток раствора щелочи Лабораторный опыт: Что наблюдали? Осадки гидроксида алюминия в обеих пробирках растворяются. Вывод: гидроксид алюминия проявляет свойства оснований, взаимодействуя с кислотой, но он также ведет себя и как нерастворимая кислота, взаимодействуя со щелочью. Он проявляет амфотерные свойства. Al(OH)3 + 3HCl = AlCl3 +3H2O Al(OH)3 + NaOH = Na[Al(OH)4] Запишите уравнения реакций: Лабораторный опыт От перемены мест слагаемых сумма …. изменяется. 1. В одну пробирку налейте 1 мл соли хлорида алюминия AlCl3 и добавьте 3-4 капли раствора натриевой щелочи NaOH. 2. Во вторую пробирку налейте наоборот- 1 мл натриевой щелочи NaOH и добаьте 3-4 капли соли хлорида алюминия AlCl3. Что наблюдали? В первой пробирке образовывался осадок, а во второй НЕТ . Вывод: для амфотерных соединений имеет большое значение, в какой последовательности проводить эксперимент! Во втором случае изначально щелочь была в избытке: AlCl3 + 4NaOH = Na[Al(OH)4] + 3NaCl Генетический ряд алюминия. Осуществите превращения: Na[Al(OH)4] Al Al2O3 AlCl3 Al(OH)3 Al2(SO4)3
Видео:Это Самый Простой Урок Химии. Химия с нуля — АмфотерностьСкачать

Амфотерные оксиды и гидроксиды
Этот видеоурок доступен по абонементу
У вас уже есть абонемент? Войти
Это занятие мы посвятим изучению амфотерных оксидов и гидроксидов. На нем мы поговорим о веществах, имеющих амфотерные (двойственные) свойства, и особенностях химических реакций, которые протекают с ними. Но сначала повторим, с чем реагируют кислотные и основные оксиды. После рассмотрим примеры амфотерных оксидов и гидроксидов.
💥 Видео
ВСЕ СВОЙСТВА АМФОТЕРНЫХ ОКСИДОВ ДЛЯ ЕГЭ ПО ХИМИИ 2024! | Химический сериал, 2 выпускСкачать

Опыты по химии. Получение и исследование амфотерных свойств гидроксида алюминияСкачать

Амфотерные оксиды и гидроксиды, химические свойства | ЕГЭ по химии 2024Скачать

Химия 8 класс (Урок 23 - Амфотерность. Амфотерные оксиды и гидроксиды.)Скачать

15. Химические свойства оксида и гидроксида алюминия. Способы полученияСкачать

8 класс. Химия. Амфотерные свойства гидроксида алюминия.Скачать

Амфотерные гидроксиды. Химия ОГЭ 2023 | TutorOnlineСкачать

Al(OH)3 + NaOH → Na[Al(OH)4] | Получение гидроксида алюминия и растворение его в избытке щёлочиСкачать
![Al(OH)3 + NaOH → Na[Al(OH)4] | Получение гидроксида алюминия и растворение его в избытке щёлочи](https://i.ytimg.com/vi/_u6eAdWg96A/0.jpg)
Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Химические свойства амфотерных соединенийСкачать

АМФОТЕРНОСТЬ | Амфотерные оксиды и гидроксиды: свойства | Химические явления и реакции | ХимияСкачать

🧪 Амфотерные гидроксиды в ЕГЭ по химии | Все химические свойства для ЕГЭ 🔥Скачать

ОКСИДЫ ХИМИЯ — Что такое Оксиды? Химические свойства Оксидов | Реакция ОксидовСкачать

Амфотерные оксиды и их свойства.Скачать

Химические свойства амфотерных оксидов. Амфотерность.Скачать

8 класс. Составление уравнений химических реакций.Скачать

Амфотерные соединения. Классификация оксидов и гидроксидов.Скачать
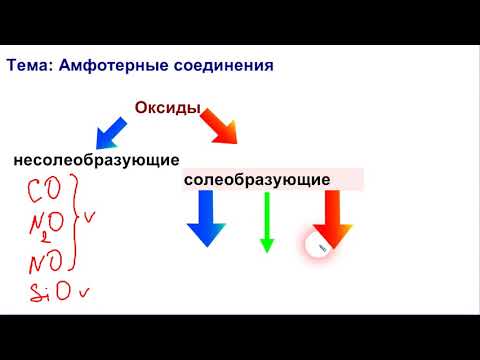
Амфотерность. Амфотерные оксиды и гидроксидыСкачать




