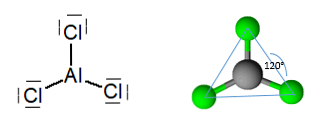AlCl3 — соль образованная слабым основанием и сильной кислотой, поэтому реакция гидролиза протекает по катиону.
- Первая стадия (ступень) гидролиза
- Вторая стадия (ступень) гидролиза
- Третья стадия (ступень) гидролиза
- Среда и pH раствора хлорида алюминия
- Хлорид алюминия (AlCl3) химическая структура, свойства, использование
- Химическая структура
- свойства
- физическое
- химическая
- приложений
- Риски: возможные последствия
- рекомендации
- Реакции ионного обмена
- Правила составления уравнений реакций ионного обмена
- 📽️ Видео
Видео:Химия | Молекулярные и ионные уравненияСкачать

Первая стадия (ступень) гидролиза
Молекулярное уравнение
AlCl3 + HOH ⇄ AlOHCl2 + HCl
Полное ионное уравнение
Al 3+ + 3Cl — + HOH ⇄ AlOH 2+ + 2Cl — + H + + Cl —
Сокращенное (краткое) ионное уравнение
Al 3+ + HOH ⇄ AlOH 2+ + H +
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Вторая стадия (ступень) гидролиза
Молекулярное уравнение
AlOHCl2 + HOH ⇄ Al(OH)2Cl + HCl
Полное ионное уравнение
AlOH 2+ + 2Cl — + HOH ⇄ Al(OH)2 + + Cl — + H + + Cl —
Сокращенное (краткое) ионное уравнение
AlOH 2+ + HOH ⇄ Al(OH)2 + + H +
Видео:Химия. Молекулярные и ионные уравненияСкачать

Третья стадия (ступень) гидролиза
Молекулярное уравнение
Al(OH)2Cl + HOH ⇄ Al(OH)3 + HCl
Полное ионное уравнение
Al(OH)2 + + Cl — + HOH ⇄ Al(OH)3 + H + + Cl —
Сокращенное (краткое) ионное уравнение
Al(OH)2 + + HOH ⇄ Al(OH)3 + H +
Видео:Ионные уравнения реакций. Как составлять полные и сокращенные уравненияСкачать

Среда и pH раствора хлорида алюминия
В результате гидролиза образовались ионы водорода (H + ), поэтому раствор имеет кислую среду (pH
Видео:Реакции ионного обмена. 9 класс.Скачать

Хлорид алюминия (AlCl3) химическая структура, свойства, использование
хлорид алюминия или трихлорид алюминия (AlCl3бинарная соль, образованная алюминием и хлором. Иногда это выглядит как желтый порошок, потому что он содержит примеси из-за присутствия хлорида железа (III).
Это получается путем объединения его элементов. Алюминий, который имеет три электрона на своем последнем энергетическом уровне (семейство IIIA), имеет тенденцию давать их из-за своего металлического характера. Хлор с семью электронами на последнем энергетическом уровне (семейство VIIA) стремится получить их для завершения своего октета.
Считается, что связь, образованная между алюминием и хлором в трихлориде алюминия, является ковалентной, хотя это соединение между металлом и неметаллом..
Существует два вида хлорида алюминия:
- Безводный хлорид алюминия. AlCl3.
- Гексагидрат хлорида алюминия. AlCl3. 6H2О. Это соединение может быть найдено в твердой или растворенной форме.
- 1 Химическая структура
- 2 свойства
- 2.1 Физический
- 2.2 Химический
- 3 использования
- 4 риска: возможные последствия
- 5 рекомендаций
- 6 Ссылки
Видео:Химия 8 класс — Ионная Связь // Химическая Связь // Подготовка к ЕГЭ по ХимииСкачать

Химическая структура
Безводный трихлорид алюминия, представляет собой молекулу с плоской тригональной геометрией, с углом 120 °, соответствующим атомной гибридизации sp 2 .
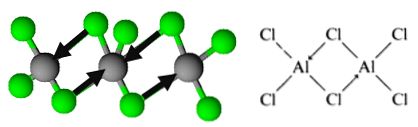
Тем не менее, молекула организована в виде димеры, в котором атом хлора жертвует пару электронов для образования связей. Они известны как скоординированные ковалентные связи.
Так определяется организация димеров трихлорида алюминия..
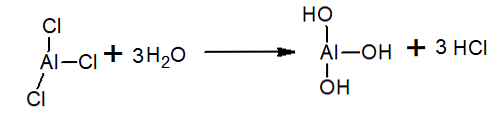
Эта организация позволяет соединению формировать сети димерных слоев. Когда вода наливается на твердый трихлорид алюминия, они не диссоциируют, как ожидается от ионных соединений, но подвергаются интенсивному гидролизу.
Напротив, в разбавленном водном растворе находятся координированные ионы [Al (H).2O)6] +3 и хлорид. Эти структуры очень похожи на диборан.
Таким образом, у вас есть формула Al2Cl6
Если измеряется разница в электроотрицательности атомов, составляющих связи в этом соединении, можно наблюдать следующее:
Для алюминия Al значение электроотрицательности составляет 1,61 ° C, а хлора — 3,16 ° C. Разница в электроотрицательности составляет 1,55 ° C..
Согласно правилам теории связи, чтобы соединение было ионным, оно должно иметь разность электроотрицательности атомов, составляющих связь, на величину, большую или равную 1,7 С..
В случае связи Al-Cl разница в электроотрицательности составляет 1,55 ° С, что дает треххлористому алюминию структуру ковалентной связи. Это небольшое значение можно отнести к координированным ковалентным связям, представленным молекулой.
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА и условия их протекания | Как составлять молекулярные и ионные уравненияСкачать

свойства
физическое
внешний вид: белое твердое вещество, иногда желтое из-за примесей, вызванных хлоридом железа
плотность: 2,48 г / мл
Молярная масса: 133,34 г / моль
сублимация: сублимируется при 178 ° C, поэтому температура его плавления и кипения очень низкая.
вождение: плохо проводит электричество.
растворимость: он не растворяется в воде, потому что это кислота Льюиса. Растворим в органических растворителях, таких как бензол, четыреххлористый углерод и хлороформ.
химическая
В воде трихлорид алюминия гидролизуется с образованием HCl, иона гидроксония и гидроксида алюминия:
Он используется в реакциях Фриделя-Крафтса в качестве катализатора (вещество, которое может быть извлечено в конце реакции, потому что оно только в нем, чтобы ускорить, замедлить или инициировать реакцию).
Это едкое вещество.
При разложении, когда он бурно реагирует с водой, образуется оксид алюминия и опасные газы, такие как хлористый водород.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

приложений
- антиперспирант.
- Катализатор ацилирования и алкилирования Фриделя-Крафтса.
Видео:Is AlCl3 Polar or Nonpolar? (Aluminum chloride)Скачать

Риски: возможные последствия
- Это едкое вещество, вызывает ожоги кожи и серьезные повреждения глаз.
- Бурно реагирует с водой.
- Это опасно для окружающей среды.
- Очень токсично для водных организмов.
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

рекомендации
Избегайте воздействия продукта без необходимых мер безопасности. Обязательно используйте, защитные очки, перчатки, соответствующую одежду, накрытую обувь.
В случае вдыхания. Вдыхание пыли может вызвать раздражение дыхательных путей из-за коррозионной природы вещества. Симптомы включают боль в горле, кашель и одышку. Симптомы отека легких могут быть поздними, а тяжелые — смертельными. Переместите жертву в воздушное место без загрязнений. при необходимости обеспечьте искусственное дыхание. Если у вас проблемы с дыханием, обеспечьте кислородом. Вызовите доктора.
В случае контакта с кожей. AlCl3 Это вызывает коррозию. Это может вызвать раздражение или ожоги с покраснением и болью. Вымойте сразу после контакта с большим количеством воды в течение не менее 20 минут. Не нейтрализуйте и не добавляйте вещества, кроме воды. Снять загрязненную одежду и выстирать ее перед повторным использованием. немедленно обратиться к врачу в случае травмы.
При попадании в глаза. AlCl3 Это вызывает коррозию. Это вызывает сильную боль, помутнение зрения и повреждение тканей. Немедленно промойте глаза водой в течение не менее 20 минут и держите веки открытыми, чтобы очистить весь глаз и ткани века. Промывание глаз в считанные секунды необходимо для достижения максимальной эффективности. Если у вас есть контактные линзы, снимите их через первые 5 минут, а затем продолжайте промывать глаза. Проконсультируйтесь с врачом. Это может привести к серьезному повреждению роговицы, конъюнктивы или других частей глаза..
В случае проглатывания. AlCl3 Это вызывает коррозию. Жжение может вызвать боль во рту и пищеводе и ожоги слизистых оболочек. Он может вызывать желудочно-кишечный дискомфорт при болях в животе, тошноте, рвоте и диарее. НЕ вызывать рвоту. Прополощите рот и дайте пить воду. Никогда не давайте ничего в устной форме человеку без сознания. Позвони доктору. Если рвота возникает спонтанно, положите пострадавшего на бок, чтобы снизить риск аспирации..
Люди с имеющимися кожными заболеваниями, проблемами со зрением или нарушениями дыхательной функции могут быть более подвержены воздействию вещества
Упаковка и хранение соединения AlCl3 должно быть сделано в проветриваемых, чистых и сухих местах.
Видео:ПОЛУЧЕНИЕ AlCl3 | ГИДРОКСИД АЛЮМИНИЯ И ЕГО РАСТВОРЕНИЕСкачать

Реакции ионного обмена
Реакции ионного обмена – это реакции между сложными веществами в растворах, в результате которых реагирующие вещества обмениваются своими составными частями. Так как в этих реакциях происходит обмен ионами – они называются ионными.
| Правило Бертолле: Реакции обмена в растворах электролитов протекают до конца (возможны) только тогда, когда в результате реакции образуется либо твердое малорастворимое вещество (осадок), либо газ, либо вода или любой другой слабый электролит. |
| Например, нитрат серебра взаимодействует с бромидом калия |
AgNО3 + КВr = АgВr↓ + КNО3
Видео:75. Ионные реакции в растворах электролитовСкачать

Правила составления уравнений реакций ионного обмена
1. Записываем молекулярное уравнение реакции, не забывая расставить коэффициенты:
3KOH +FeCl3 = Fe(OH)3 + 3KCl
2. С помощью таблицы растворимости определяем растворимость каждого вещества. Подчеркнем вещества, которые мы не будем представлять в виде ионов.
р р н р
3KOH + FeCl3 = Fe(OH)3 + 3KCl
3. Составляем полное ионное уравнение. Сильные электролиты записываем в виде ионов, а слабые электролиты, малорастворимые вещества и газообразные вещества записываем в виде молекул.
3K + + 3OH — + Fe 3+ + 3Cl — = Fe(OH)3 + 3K + + 3Cl —
4. Находим одинаковые ионы (они не приняли участия в реакции в левой и правой частях уравнения реакции) и сокращаем их слева и справа.
3K + + 3OH — + Fe 3+ + 3Cl — = Fe(OH)3 + 3K + + 3Cl —
5. Составляем итоговое сокращенное ионное уравнение (выписываем формулы ионов или веществ, которые приняли участие в реакции).
Fe 3+ + 3OH — = Fe(OH)3
На ионы мы не разбиваем:
- Оксиды; осадки; газы; воду; слабые электролиты (кислоты и основания)
- Анионы кислотных остатков кислых солей слабых кислот (НСО3 — , Н2РО4 — и т.п.) и катионы основных солей слабых оснований Al(OH) 2+
- Комплексные катионы и анионы: [Al(OH)4] —
| Например, взаимодействие сульфида цинка и серной кислоты |
Составляем уравнение реакции и проверяем растворимость всех веществ. Сульфид цинка нерастворим.
ZnS + H2SO4 = ZnSO4 + H2S
Реакция протекает до конца, т.к. выделяется газ сероводород, который является слабым электролитом. Полное ионно-молекулярное уравнение:
ZnS + 2H + + SO4 2 — = Zn 2+ + SO4 2 — + H2S
Сокращаем ионы, которые не изменились в процессе реакции – в данном случае это только сульфат-ионы, получаем сокращенное ионное уравнение:
ZnS + 2H + = Zn 2+ + H2S
| Например, взаимодействие гидрокарбоната натрия и гидроксида натрия |
Составляем уравнение реакции и проверяем растворимость всех веществ:
NaHCO3 + NaOH = Na2CO3 + H2O
Кислые анионы слабых кислот являются слабыми электролитами и на ионы не разбиваются:
Na + + НСО3 — + Na + + ОН — = 2Na + + CO3 2- + H2O
Сокращаем одинаковые ионы, получаем сокращенное ионное уравнение:
НСО3 — + ОН — = CO3 2- + H2O
| Например, взаимодействие тетрагидроксоалюмината натрия и соляной кислоты |
Составляем уравнение реакции и проверяем растворимость всех веществ:
Na[Al(OH)4] + 4HCl = NaCl + AlCl3 + H2O
Комплексные ионы являются слабыми электролитами и на ионы не разбиваются:
Na + + [Al(OH)4] — + 4H + + 4Cl — = Na + + Cl — + Al 3+ + 3Cl — + H2O
Сокращаем одинаковые ионы, получаем сокращенное ионное уравнение:
[Al(OH)4] — + 4H + = Al 3+ + 4H2O
📽️ Видео
Уравнения химический реакций на ОГЭ: как составлять без ошибок?Скачать

Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Как составлять ХИМИЧЕСКИЕ УРАВНЕНИЯ | 4 лайфхака - 95 ВСЕХ РЕАКЦИЙ в химии!Скачать

Решение цепочек превращений по химииСкачать

Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

Ионные уравнения | Химия 8 класс #42 | ИнфоурокСкачать

BaCl2+KBrO3=Ba(BrO3)2+KCl Ионное и молекулярное уравнения реакции, демонстрация.Скачать

Составление уравнений химических реакций. 1 часть. 8 класс.Скачать