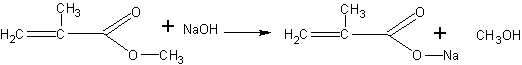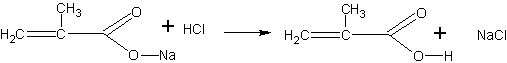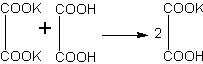Из класса непредельных одноосновных карбоновых кислот наибольший интерес для изучения представляют акриловая и олеиновая кислоты. Первая — как первый член гомологического ряда, производные которой имеют большое значение при получении синтетических материалов. Олеиновая кислота является представителем непредельных кислот, входящих в состав жиров.
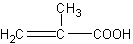
Вместо акриловой кислоты СН2=СН—СООН можно воспользоваться ее ближайшим и более доступным гомологом — метакриловой кислотой, эфиры которой применяются для получения широко известных полимерных продуктов (органического стекла).
Получение метакриловой кислоты (по В.В.Некрасову). Метакриловая кислота может быть получена гидролизом сложного эфира — метилметакрилата. Метилметакрилат для этого опыта может быть в свою очередь получен деполимеризацией полиметилметакрилата (органического стекла), как это описано на с. 68. Гидролиз проводится в присутствии щелочи. Метакриловая кислота при этом образует соль, из которой она может быть выделена действием более сильной кислоты:
Помещают в пробирку 2 мл метилового эфира метакриловой кислоты (метилметакрилата) и 4 мл концентрированного раствора едкого натра. Чтобы смесь получилась гомогенной, добавляют 1 мл этанола и встряхивают. Через 15—20 мин переливают жидкость в фарфоровую чашку и выпаривают досуха на слабом пламени. Остаток представляет собой натриевую соль метакриловой кислоты с возможной примесью щелочи. Дальнейшая задача сводится к выделению кислоты из соли. Для этого сухой остаток переносят в пробирку и, охлаждая ее водой, добавляют несколько миллилитров концентрированной соляной кислоты (до кислой реакции на индикатор). После отстаивания смеси метакриловая кислота собирается сверху в виде маслянистой жидкости с характерным запахом. Кислоту переносят при помощи пипетки в другую пробирку.
Свойства метакриловой кислоты. Метакриловая кислота, будучи соединением непредельным, реагирует с бромной водой, перманганатом калия и легко полимеризуется.
а) К небольшому количеству (нескольким каплям) метакриловой кислоты приливают бромную воду и смесь встряхивают. Бромная вода обесцвечивается вследствие присоединения брома по месту двойной связи. Учащиеся составляют уравнение реакции.
Подобным образом проводится опыт с водным раствором пер-манганата калия.
б) К небольшому количеству метакриловой кислоты добавляют несколько крупинок перекиси бензоила в качестве инициатора реакции и нагревают до начала кипения. Кислота быстро полимеризуется.
Непредельность олеиновой кислоты. Олеиновая кислота является единственным представителем класса непредельных кислот, входящих в состав жиров и изучаемых в школьном курсе химии. Непредельность ее может быть проиллюстрирована действием обычных реактивов на двойную связь: бромной воды и раствора перманганата калия.
К 5—8 мл олеиновой кислоты в пробирке или колбочке приливают равный объем бромной воды или раствора перманганата калия и встряхивают. Окраска брома и перманганата калия исчезает вследствие присоединения по месту двойной связи.
ЩАВЕЛЕВАЯ КИСЛОТА
Наибольшее значение в этом разделе имеют опыты, связанные со строением щавелевой кислоты и ее двухосновностью.
Получение щавелевой кислоты из муравьиной. Первым подтверждением структурной формулы щавелевой кислоты может служить получение ее солей из солей муравьиной кислоты.
Формиат натрия при нагревании выделяет водород; одновременно образуется оксалат натрия
Очевидно, что из молекулы соли при этом уходит единственный атом водорода. А так как радикалы неспособны к сколько-нибудь длительному существованию, то они рекомбинируются, образуя молекулы новой соли, которой отвечает кислота
В пробирке, закрытой пробкой с вертикальной трубкой, нагревают в пламени горелки сухой формиат натрия.
Соль плавится и затем (при сильном нагревании) разлагается. Устанавливают выделение водорода, собирая его в пробирку или поджигая через некоторое время у отводной трубки.
Разложение щавелевой кислоты при нагревании с серной кислотой. Если щавелевая кислота имеет формулу
то можно предположить, что при отнятии от нее элементов воды должны выделяться углекислый газ и оксид углерода (II). Этот факт послужил бы подтверждением структурной формулы кислоты.
Учащимся можно предложить самим придумать прибор, в котором следовало бы провести эту реакцию так, чтобы обнаружить оба образующихся газа.
Опыт может быть осуществлен, например, в приборе, изображенном на рис. 32.
В небольшую колбочку помещают 2—3 г щавелевой кислоты и двойной объем концентрированной серной кислоты. В пробирку с отводной трубкой наливают известковую воду. При нагревании смеси кислот на горелке известковая вода мутится. Когда можно будет предположить, что воздух вытеснен из прибора, поджигают у отводной трубки пробирки оксид углерода (II), который горит характерным синим пламенем.

Окисление щавелевой кислоты. Щавелевая кислота окисляется легче уксусной. Распадаясь на воду, углекислый газ и оксид углерода (II), она, очевидно, нуждается в незначительном количестве кислорода, чтобы дать конечные продукты окисления — углекислый газ и воду. Для простоты можно считать, что действие окислителя сводится к превращению угарного газа в углекислый.
В качестве окислителя может быть взят не раз применявшийся в подобных случаях перманганат калия с серной кислотой.
В небольшую колбочку с отводной трубкой наливают 5 мл концентрированного раствора щавелевой кислоты и равный объем разбавленной серной кислоты (1 : 5).
Из капельной воронки в колбу приливают постепенно 10 мл не слишком слабого раствора перманганата калия. При нагревании колбы фиолетовая окраска быстро исчезает и наблюдается энергичное выделение углекислого газа. Его пропускают в известковую или баритовую воду или же собирают в цилиндр и затем испытывают соответствующим способом. Уравнение реакции можно представить следующим образом:
Образование кислых и средних солей щавелевой кислоты. В молекуле щавелевой кислоты имеются две карбоксильные группы, следовательно, щавелевая кислота двухосновная.
Как кислота двухосновная, щавелевая кислота может давать соли кислые и средние. Это может быть показано на реакции нейтрализации.
Растворяют 12 г щавелевой кислоты примерно в 20 мл воды и делят раствор пополам. К одной части раствора приливают понемногу концентрированный раствор гидроксида калия. Наблюдают, что сначала образуется осадок, который при дальнейшем прибавлении щелочи растворяется. Очевидно, что сначала получается кислая соль (гидрооксалат калия), нерастворимая в воде. В дальнейшем, при добавлении щелочи, эта соль превратилась в среднюю, растворимую в воде:
Если теперь к раствору средней соли прилить вторую порцию щавелевой кислоты, то снова образуется обильный осадок гидрооксалата калия:
БЕНЗОЙНАЯ КИСЛОТА
Изучение бензойной кислоты на уроке не входит в программу по химии. Учителя иногда посвящают несколько минут ознакомлению с нею лишь для того, чтобы показать, как образуются кислоты в ароматическом ряду и что они собой представляют. Если ранее ставился опыт окисления бензальдегида в бензойную кислоту, здесь можно познакомить учащихся лишь с физическими свойствами ее.
Растворимость бензойной кислоты в воде. Встряхивая в пробирке очень небольшое количество кристаллов бензойной кислоты с водой, убеждаются, что заметного растворения не происходит. При нагревании пробирки происходит растворение кислоты, а при охлаждении она вновь кристаллизуется. Убеждаются, что водный раствор бензойной кислоты окрашивает лакмус в красный цвет.
Растворимость бензойной кислоты в щелочах. К небольшому количеству бензойной кислоты в пробирке прибавляют воду. Убедившись, что кислота не растворяется, добавляют по каплям крепкий раствор щелочи, пока кислота не растворится. После этого подкисляют раствор соляной кислотой. Выделяются мелкие кристаллы бензойной кислоты:
Возгонка бензойной кислоты. Собирают прибор из двух пробирок разной величины, как показано на рис. 33. В большую пробирку на дно насыпают бензойную кислоту, а маленькая пробирка наполнена холодной водой. При нагревании прибора на пламени горелки бензойная кислота возгоняется и осаждается в виде белых кристаллов на пробирке-холодильнике.
С помощью бензойной кислоты учащимися может быть осуществлена имитация «зимнего пейзажа».
На картоне (с отверстиями) или на листе пористой (фильтровальной) бумаги монтируют небольшой макет сада. Под картоном (бумагой) нагревают в фарфоровой или железной чашке бензойную кислоту, накрыв всю установку стеклянным колпаком. Возгоняющаяся кислота, проходя через отверстия в картоне или поры в бумаге, осаждается на «деревьях» в виде красивого инея. Следует остерегаться попадания паров бензойной кислоты в атмосферу.
Получение бензойной кислоты окислением бензальдегида. Бензальдегид легко окисляется в бензойную кислоту кислородом воздуха.
На стеклянную пластинку, часовое стекло или в фарфоровую чашку помещают несколько капель бензальдегида. Через несколько минут начинают появляться кристаллы. К концу урока весь альдегид превращается в кислоту.
Взяв для опыта несколько миллилитров альдегида, таким способом можно получить бензойную кислоту в количестве, необходимом для демонстрации опытов с ней.
Получение бензола из бензойной кислоты (см. опыт на с. 63).
Видео:Взаимодействие фенола с бромной водойСкачать

Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Видео:Опыты по химии. Отношение олеиновой кислоты к бромной водеСкачать  Химия, 11 класс, Новошинский. Профильный уровень.Решите, пожалуйста, эти две задачи. Очень срочно.. . Заранее спасибо. 1) При нагревании щавелевая кислота декарбоксилируется с образованием метановой кислоты и газа, вызывающего помутнение известковой воды. Определите массу осадка, образовавшегося при пропускании всего газа, выделившегося при разложении 27 г щавелевой кислоты, через избыток известковой воды. 2) Для взаимодействия с 7,3 г акриловой кислоты потребовалось 200 г бромной воды. Определите массовую долю брома в растворе. 1) НООС-СООН —t—>HCOOH + CO2 CO2 + Ca(OH)2 = CaCO3(осадок) + H2O n(HOOC-COOH) = m/M = 27/ 90 = 0.3 моль n(CO2) = 0.3 моль, n(CaCO3) = 0.3 моль, m(CaCO3) = M*n = 100*0.3 = 30г 2) СН2=СН-СООН + Br2 —-> CH2Br-CHBr-COOH n(CH2=CH-COOH) = m/M = 7.3/ 72 = 0.101 моль n(Br2) = 0.101 моль, m(Br2) = M*n = 160*0.101 = 16.16 г w(Br2) = 16.16*100/200 = 8.1% 🔍 ВидеоВзаимодействие ацетилена с бромной водойСкачать  Взаимодействие этилена с бромной водойСкачать  Плавиковая кислота. Химические и физические свойства.Скачать  олеиновая кислота + бромная водаСкачать  Льем воду в кислоту. Шок контент. Химия – ПростоСкачать  11.3. Карбоновые кислоты и их соли: Химические свойства. ЕГЭ по химииСкачать  Разбор ЕГКР по химии, вариант 1 | ЕГЭ-2024Скачать  Взаимодействие металлов с кислотами. 8 класс.Скачать  Окисление ВСЕХ органических веществ за 4 часа | Химия ЕГЭ 2023 | УмскулСкачать  8 класс. Массовая доля растворенного вещества. Решение задач.Скачать  Бромоводородная кислота.Скачать  Несколько опытов с МАЛОНОВОЙ КИСЛОТОЙСкачать  БРОМОВОДОРОДНАЯ КИСЛОТАСкачать  Повторяем темы 10 класса: кислородсодержащие соединения | ЕГЭ по химии 2022Скачать  16 Непредельные кислоты 17 Ароматические кислотыСкачать  Не повторять! ⚠️ Если серная кислота попадет на кожу #shortsСкачать  Акриловая кислотаСкачать  ЕГЭ 2022 / Задание 12Скачать  |