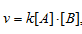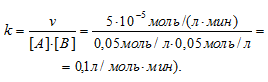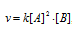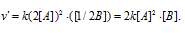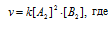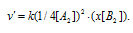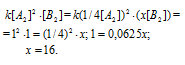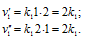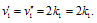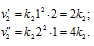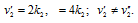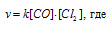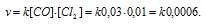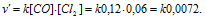- We are checking your browser. gomolog.ru
- Why do I have to complete a CAPTCHA?
- What can I do to prevent this in the future?
- Каковы особенности параллельных, последовательных и сопряженных реакций? Приведите примеры указанных реакций. Напишите кинетические уравнения для простых реакций: 1) А(ж) + 2В(ж) = 2С(ж)
- Описание и исходные данные задания, 50% решения + фотография:
- Расчеты константы и изменения скорости реакции
- 📸 Видео
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

We are checking your browser. gomolog.ru
Видео:Составляем кинетические уравненияСкачать

Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
Видео:Влияние концентрации на скорость химических реакций. 10 класс.Скачать

What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 700fafd588f09781 • Your IP : 87.119.247.227 • Performance & security by Cloudflare
Видео:Порядок реакцииСкачать

Каковы особенности параллельных, последовательных и сопряженных реакций? Приведите примеры указанных реакций. Напишите кинетические уравнения для простых реакций: 1) А(ж) + 2В(ж) = 2С(ж)






Чтобы получить решение , напишите мне в WhatsApp , оплатите, и я Вам вышлю файлы.
Кстати, если эта работа не по вашей теме или не по вашим данным , не расстраивайтесь, напишите мне в WhatsApp и закажите у меня новую работу , я смогу выполнить её в срок 1-3 дня!
Описание и исходные данные задания, 50% решения + фотография:
Каковы особенности параллельных, последовательных и сопряженных реакций? Приведите примеры указанных реакций. Напишите кинетические уравнения для простых реакций:
1) А(ж) + 2В(ж) = 2С(ж)
2) А(г) + 2В(ж) = 2С(г)
3) А(г) + 2В(г) = 2С(г)
4) А(ж) + 2В(т) = 2С(ж)
Решение:
Последовательными называются сложные реакции, протекающие таким образом, что вещества, образующиеся в результате одной стадии (т.е. продукты этой стадии), являются исходными веществами для другой стадии. Схематически последовательную реакцию можно изобразить следующим образом:
Число стадий и веществ, принимающих участие в каждой из стадий, может быть различным.
| Если вам нужно решить химию, тогда нажмите ➔ заказать химию. |
| Похожие готовые решения: |
- На основании экспериментальных данных, представленных в таблице, выведите кинетическое уравнение реакции А + 2В = 3С. Рассчитайте константу скорости реакции, определите её размерность.
- Какие процессы называются каталитическими? Дайте определения понятиям: катализатор, ингибитор, гомогенный и гетерогенный катализ. В какой реакции имеет место гомогенный катализ? 1) N2 + 3H2
- Почему равновесие называется динамическим? Приведите пояснение. В реакции 2NO(г) + O2(г) ↔ 2NO2(г) начальные концентрации NO и O2 равны соответственно 0,02 и 0,01 моль/л
- Перечислите признаки истинного химического равновесия. Как нужно изменить условия протекания реакции для повышения выхода NО2 в реакции N2O4 = 2NO2; ΔН0 = 23 кДж? Дайте обоснованный ответ.
Присылайте задания в любое время дня и ночи в ➔
Официальный сайт Брильёновой Натальи Валерьевны преподавателя кафедры информатики и электроники Екатеринбургского государственного института.
Все авторские права на размещённые материалы сохранены за правообладателями этих материалов. Любое коммерческое и/или иное использование кроме предварительного ознакомления материалов сайта natalibrilenova.ru запрещено. Публикация и распространение размещённых материалов не преследует за собой коммерческой и/или любой другой выгоды.
Сайт предназначен для облегчения образовательного путешествия студентам очникам и заочникам по вопросам обучения . Наталья Брильёнова не предлагает и не оказывает товары и услуги.
Видео:Решение задач на термохимические уравнения. 8 класс.Скачать

Расчеты константы и изменения скорости реакции
Задача 325.
Найти значение константы скорости реакции А + В ⇒ АВ, если при концентрациях веществ А и В, равных соответственно 0,05 и 0,01 моль/л, скорость реакции равна 5 . 10 -5 моль/(л. мин).
Решение:
Скорость химической реакции выражается уравнением:
Ответ: 0,1/моль . мин.
Задача 326.
Во сколько раз изменится скорость реакции 2А + В ⇒ А2В, если концентрацию вещества А увеличить в 2 раза, а концентрацию вещества В уменьшить в 2 раза?
Решение:
До изменения концентрации скорость реакции можно выразить уравнением:
Вследствие увеличения концентрации вещества А в 2 раза и уменьшения концентрации вещества В в 2 раза скорость реакции будет выражаться уравнением:
Сравнивая выражения для v и v’ , находим, что скорость реакции увеличилась в 2 раза.
Ответ: увеличилась в 2 раза.
Задача 327.
Во сколько раз следует увеличить концентрацию вещества В2 в системе
2А2(г) + В2(г) = 2А2В, чтобы при уменьшении концентрации вещества А в 4 раза скорость прямой реакции не изменилась?
Решение:
Концентрацию вещества А уменьшили в 4 раза. Изменение концентрации вещества В обозначим через x. Тогда до изменения концентрации вещества А скорость реакции можно выразить уравнением:
v- скорость реакции, k — константа скорости реакции, [A] и [B] – концентрации исходных веществ.
После изменения концентрации вещества А2 скорость реакции будет выражаться уравнением:
По условию задачи v = v’ или
Таким образом, следует увеличить в 16 раз концентрацию вещества В2 в системе 2А2(г) + В2(г) = 2А2В, чтобы при уменьшении концентрации вещества А2 в 4 раза скорость прямой реакции не изменилась.
Ответ: в 16 раз.
Задача 328.
В два сосуда одной и той же вместимости введены: в первый — 1 моль газа А и 2 моля газа В, во второй 2 моля газа А и 1 моль газа В. Температура в обоих сосудах одинакова. Будет ли различаться скорость реакции между газами А и В в этих сосудах, если скорость реакции выражается: а) уравнением 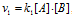
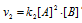
Решение:
а) Если скорость реакции выражается уравнением 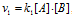
Таким образом,
б) Если скорость реакции выражается уравнением 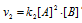
Таким образом,
Ответ: а) нет, б) да.
Задача 329.
Через некоторое время после начала реакции 3А+В ⇒ 2С+D концентрации веществ составляли: [А] = 0,03 моль/л; [В] =0,01 моль/л; [С] = 0,008 моль/л. Каковы исходные концентрации веществ А и В?
Решение:
Для нахождения концентраций веществ А и В учтём, что, согласно уравнению реакции, из 3 молей вещества А и 1 моля вещества В образуется 1 моль вещества С. Поскольку по условию задачи в каждом литре системы образовалось 0,008 молей вещества С, то при этом было израсходовано 0,012 моля вещества А (3/2 . 0,008 = 0.012) и 0,004 моля вещества В (1/2 . 0,008 = 0,004). Таким образом исходные концентрации веществ А и В будут равны:
[A]0 = 0,03 + 0,012 = 0,042 моль/л;
[B]0 = 0,01 + 0,004 = 0,014 моль/л.
Ответ: [A]0 = 0,042 моль/л; [B]0 = 0,014 моль/л.
Задача 330.
В системе СО + С12 = СОС12 концентрацию увеличили от 0,03 до 0,12 моль/л, а концентрацию хлора от 0,02 до 0,06 моль/л. Во сколько раз возросла скорость прямой реакции?
Решение:
До изменения концентрации скорость реакции можно выразить уравнением:
v- скорость реакции, k — константа скорости реакции, [СО] и [Cl2] – концентрации исходных веществ.
После увеличения концентрации реагирующих веществ скорость реакции равна:
Рассчитаем, во сколько раз возросла скорость реакции:
📸 Видео
Задачи на скорость реакции в зависимости от концентрации реагентовСкачать

Химическая кинетика. Скорость химической реакции | ХимияСкачать

Скорость химических реакций. 9 класс.Скачать

Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Химия | Тепловой эффект химической реакции (энтальпия)Скачать

ЛЕКЦИЯ №2 || Химическая кинетика || Скорость реакции, Закон действия масс, Порядок реакцииСкачать

Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Скорость реакции. Химия – ПростоСкачать

Скорость химической реакцииСкачать

Проклятая химическая реакция 😜 #shortsСкачать

Химическое равновесие. Константа равновесия. 10 класс.Скачать

Физическая химия #3. Первый, второй и третий порядки химической реакции. Времена полупревращенияСкачать

Влияние температуры на скорость химических реакций. 10 класс.Скачать

Скорость химической реакции. Практическая часть. 10 класс.Скачать

Экзо- и эндотермические реакции. Тепловой эффект химических реакций. 8 класс.Скачать