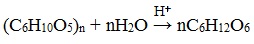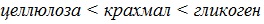Полисахариды – это природные высокомолекулярные углеводы, макромолекулы которых состоят из остатков моносахаридов.
Полисахариды – высокомолекулярные несахароподобные углеводы, содержащие от десяти до сотен тысяч остатков моносахаридов (обычно гексоз), связанных гликозидными связями.
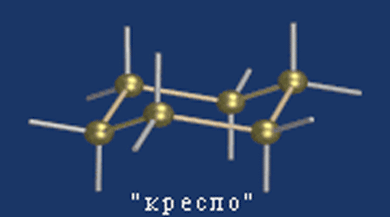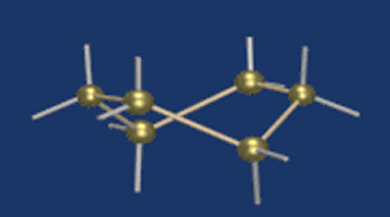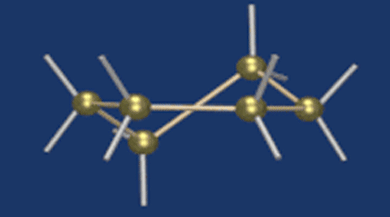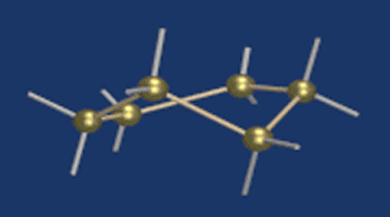
Основные представители — крахмал и целлюлоза — построены из остатков одного моносахарида — глюкозы. Крахмал и целлюлоза имеют одинаковую молекулярную формулу
но совершенно различные свойства. Это объясняется особенностями их пространственного строения.
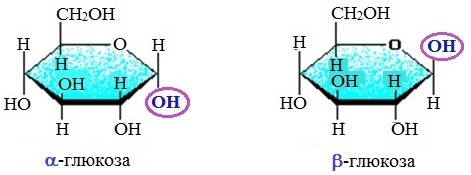
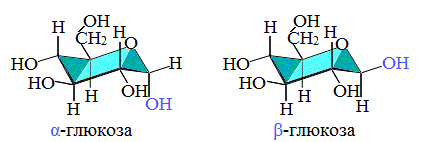
Крахмал состоит из остатков a-глюкозы, а целлюлоза – из b-глюкозы, которые являются пространственными изомерами и отличаются лишь положением одной гидроксильной группы (выделена цветом):
С учетом пространственного строения шестичленного цикла
формулы этих изомеров имеют вид:
К важнейшим полисахаридам относится также гликоген (С6Н10О5)n, образующийся в организмах человека и животных в результате биохимических превращений из растительных углеводов. Как и крахмал, гликоген состоит из остатков a-глюкозы и выполняет подобные функции (поэтому часто называется животным крахмалом).
Учебный фильм «Углеводы. Полисахариды»
- Биологическая роль полисахаридов
- Физические свойства
- Химические свойства полисахаридов
- Различия в строении и свойствах крахмала и целлюлозы
- Общее итоговое уравнение гидролиза полисахаридов?
- Уравнение гидролиза сахарозы сахаразой?
- Уравнение гидролиз сульфата меди?
- Напишите уравнения гидролиза в молекулярном и ионном виде всех ступеней гидролиза для раствора фосфата натрия?
- Уравнение гидролиза NH4NO2?
- Уравнение гидролиза AlCl3?
- Уравнение гидролиза NaCl?
- Чем отличаются реакции гидролиза от реакции гидратации?
- ZnSO4, NH4NO3, CH3COONa напишите краткое и полное ионно — молекулярное уравнение гидролиза, а так же молекулярное уравнение гидролиза?
- Уравнение гидролиза солей в молекулярной и ионной формах совместного гидролиза солей FeBr2 + NaCO3?
- Уравнения гидролиза глюкозы?
- § 15. Дисахариды и полисахариды
- 💥 Видео
Биологическая роль полисахаридов
Полисахариды необходимы для жизнедеятельности животных и растительных организмов. В живой природе они выполняют важные биологические функции:
- структурных компонентов клеток и тканей;
- энергетического резерва;
- защитных веществ.
Они являются одним из основных источников энергии, образующейся в результате обмена веществ организма. Принимают участие в иммунных процессах, обеспечивают сцепление клеток в тканях. Являются основной массой органического вещества в биосфере.
Структурные полисахариды придают клеточным стенкам прочность.
Водорастворимые полисахариды не дают клеткам высохнуть.
Резервные полисахариды по мере необходимости расщепляются на моносахариды и используются организмом.
Физические свойства
Полисахариды — аморфные вещества, не растворяются в спирте и неполярных растворителях, растворимость в воде варьируется. Некоторые растворяются в воде с образованием коллоидных растворов (амилоза, слизи, пектовые кислоты, арабин), могут образовывать гели (пектины, альгиновы кислоты, агар-агар) или вообще не растворяться в воде (клетчатка, хитин).
Химические свойства полисахаридов
Для полисахаридов наибольшее значение имеют реакции гидролиза и образование производных за счет реакций макромолекул по спиртовым ОН-группам.
Гидролиз полисахаридов
Гидролиз полисахаридов происходит в разбавленных растворах минеральных кислот (или под действием ферментов). При этом в макромолекулах разрываются связи, соединяющие моносахаридные звенья – гликозидные связи (аналогично гидролизу дисахаридов). Реакция гидролиза полисахаридов является обратной процессу их образования из моносахаридов.
Полный гидролиз полисахаридов приводит к образованию моносахаридов (целлюлоза, крахмал и гликоген гидролизуются до глюкозы):
При неполном гидролизе образуются олигосахариды (в том числе, дисахариды).
Способность полисахаридов к гидролизу увеличивается в ряду:
Гидролиз крахмала и целлюлозы до глюкозы («осахаривание») и ее брожение используются в производстве этанола, молочной, масляной и лимонной кислот, ацетона, бутанола.
Образование производных
Образование производных (главным образом, сложных и простых эфиров) полисахаридов происходит в результате реакций по спиртовым ОН-группам, содержащимся в каждом структурном звене (3 группы ОН на одно моносахаридное звено): [С6Н7О2(ОН)3]n.
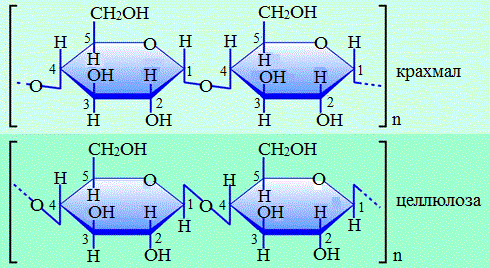
Различия в строении и свойствах крахмала и целлюлозы
1. Содержат остатки разных форм циклической глюкозы:
крахмал – остатки α–глюкозы;
целлюлоза – остатки β-глюкозы.
2. Содержат разное число структурных звеньев – остатков глюкозы:
крахмал – до нескольких тысяч (Мr – до 1 млн);
целлюлоза – до 40 тыс. (Мr – до 20 млн).
3. Между остатками глюкозы образуются различные связи:
в крахмале – α–1,4- и α–1,6-гликозидные связи;
в целлюлозе — β-1,4-гликозидные связи.
4. Макромолекулы имеют различную структуру:
крахмал – разветвленные и неразветвленные молекулы, компактно свернутые;
целлюлоза – только неразветвленные молекулы, имеют вид нитей, так как форма остатков β-глюкозы исключает спирализацию.
5. Характер межмолекулярных взаимодействий:
в крахмале макромолекулы имеют компактную форму, водородные связи между ними почти не образуются;
в целлюлозе между молекулами нитевидной формы образуются очень прочные водородные связи (в которых участвуют свободные гидроксильные группы), нити объединяться в пучки, пучки в волокна. Поэтому в воде, спирте, эфире целлюлоза не растворяется и не набухает, как крахмал.
6. Как пищевой продукт:
Крахмал – продукт питания, так как в организмах человека и животных есть ферменты, расщепляющие α–1,4- и α–1,6-гликозидные связи.
Целлюлоза не является продуктом питания человека и большинства животных, так как в их организмах нет ферментов, расщепляющих более прочные β-1,4-гликозидные связи.
Жвачные животные и кролики способны усваивать целлюлозу при посредстве содержащихся в их организме бактерий.
Видео:ГИДРОЛИЗ СОЛЕЙ | 9 класс | Кратко и понятноСкачать

Общее итоговое уравнение гидролиза полисахаридов?
Химия | 5 — 9 классы
Общее итоговое уравнение гидролиза полисахаридов.
(C6H10O5)n + nH2O = nC6H12O6.
Видео:Гидролиз солей. 9 класс.Скачать

Уравнение гидролиза сахарозы сахаразой?
Уравнение гидролиза сахарозы сахаразой.
Видео:Химия 10 класс (Урок№11 - Полисахариды. Крахмал. Целлюлоза.)Скачать

Уравнение гидролиз сульфата меди?
Уравнение гидролиз сульфата меди.
Видео:Ди- и полисахаридыСкачать

Напишите уравнения гидролиза в молекулярном и ионном виде всех ступеней гидролиза для раствора фосфата натрия?
Напишите уравнения гидролиза в молекулярном и ионном виде всех ступеней гидролиза для раствора фосфата натрия.
Видео:Гидролиз солей.ПримерыСкачать

Уравнение гидролиза NH4NO2?
Уравнение гидролиза NH4NO2.
Видео:Химия 9 класс (Урок№8 - Гидролиз солей.)Скачать

Уравнение гидролиза AlCl3?
Уравнение гидролиза AlCl3.
Видео:Гидролиз солей и среда водных растворов веществ, Задание 21 | ЕГЭ по химии 2024Скачать

Уравнение гидролиза NaCl?
Уравнение гидролиза NaCl?
Видео:Ступенчатый гидролиз солей по аниону. Решаем примеры.Скачать

Чем отличаются реакции гидролиза от реакции гидратации?
Чем отличаются реакции гидролиза от реакции гидратации?
И что между ними общего?
Видео:Химия 10 класс (Урок№10 - Углеводы. Глюкоза. Олигосахариды. Сахароза.)Скачать

ZnSO4, NH4NO3, CH3COONa напишите краткое и полное ионно — молекулярное уравнение гидролиза, а так же молекулярное уравнение гидролиза?
ZnSO4, NH4NO3, CH3COONa напишите краткое и полное ионно — молекулярное уравнение гидролиза, а так же молекулярное уравнение гидролиза.
Видео:52. Сахароза. Крахмал. Целлюлоза (часть 3)Скачать

Уравнение гидролиза солей в молекулярной и ионной формах совместного гидролиза солей FeBr2 + NaCO3?
Уравнение гидролиза солей в молекулярной и ионной формах совместного гидролиза солей FeBr2 + NaCO3.
Видео:Гидролиз солей. 1 часть. 11 класс.Скачать

Уравнения гидролиза глюкозы?
Уравнения гидролиза глюкозы.
На этой странице вы найдете ответ на вопрос Общее итоговое уравнение гидролиза полисахаридов?. Вопрос соответствует категории Химия и уровню подготовки учащихся 5 — 9 классов классов. Если ответ полностью не удовлетворяет критериям поиска, ниже можно ознакомиться с вариантами ответов других посетителей страницы или обсудить с ними интересующую тему. Здесь также можно воспользоваться «умным поиском», который покажет аналогичные вопросы в этой категории. Если ни один из предложенных ответов не подходит, попробуйте самостоятельно сформулировать вопрос иначе, нажав кнопку вверху страницы.
W(C) = 0, 9231 w(H) = 0, 0769 D / H₂ = 39 M(C) = 12 г / моль M(H) = 1 г / моль M(H₂) = 2 г / моль M(CₓHy) = M(H₂) * D xM(C) = M(CₓHy)w(C) = M(H₂)Dw(C) x = M(H₂)Dw(C) / M(C) аналогично y = M(H₂)Dw(H) / M(H) x = 2 * 39 * 0, 9231 / 12 = 6 y = 2 * 39 * 0..
Это электронная формула калия (K).
Соответствую перечню — ответ — а.
Ответ на фото. Будут вопросы — задавай.
Метан СН₄ и углекислый газ СО₂ — газообразные соединения углерода. Метан относится к классу органических веществ, а так же к классу летучих водородных соединений ; ауглекислый газ — неорганических, а так же к классу оксидов. Сходство : Химические с..
Видео:Химия | ГидролизСкачать

§ 15. Дисахариды и полисахариды
Наряду с моносахаридами в природе широко распространены и дисахариды. Это всем хорошо известная сахароза (тростниковый или свекловичный сахар), лактоза (молочный сахар), мальтоза (солодовый сахар).
Термин «дисахарид» красноречиво говорит о том, что в молекулах этих органических соединений между собой связаны два остатка моносахаридов, которые можно получить гидролизом (разложением водой) молекулы дисахарида.
| Дисахариды — это углеводы, которые гидролизуются с образованием двух молекул моносахаридов. |
При образовании молекулы дисахарида происходит отщепление одной молекулы воды:
поэтому молекулярная формула дисахаридов С12Н22О11.
Как вы уже знаете, образование наиболее известного дисахарида сахарозы происходит в клетках растений под действием ферментов. Однако химики научились осуществлять многие реакции, которые являются частью процессов, происходящих в живой природе. В 1953 г, французским химиком Р. Лемье впервые в лабораторных условиях был осуществлен синтез сахарозы, который современники назвали «покорением Эвереста органической химии».
В промышленности сахарозу получают из сока сахарного тростника (содержание 14—16%), сахарной свеклы (16—21%) и некоторых других растений, например канадского клена, земляной груши (рис. 70).
Рис. 70.
Растения-сахароносы:
1 — земляная груша (топинамбур); 2 — сахарный тростник; 3
канадский клен; 4 — сахарная свекла
Не только сладкоежки, но и любой из вас знает, что сахароза представляет собой кристаллическое хорошо растворимое в воде вещество и имеет сладкий вкус.
Тростниковый сахар был известен людям достаточно давно. Родиной сахарного тростника считается Индия. В соке этого растения содержится углевод сахароза, который мы привычно называем сахаром. Белые твердые куски, похожие на камни, использовали не только для придания сладкого вкуса пище, но и как лекарственное средство.
В XII в. сахарный тростник стали возделывать на Сицилии, а в XVI в. он был завезен на Кубу и другие острова Карибского моря.
«Главной сладостью» в европейских государствах с давних времен был мед и продукты на его основе. На первых порах сахар был заморской диковинкой и непозволительной роскошью. Потребность в новом продукте резко возросла, когда в европейских странах в моду вошли чай и кофе. Естественно стали предприниматься многочисленные попытки получения сахара из растений, произрастающих в более холодных климатических условиях Европы. Таким растением оказалась сахарная свекла.
Производство сахара из свеклы связано с именем А. Маргграфа, немецкого химика и металлурга. А. Маргграф был одним из первых исследователей, который применил в химических исследованиях микроскоп, с помощью которого и обнаружил в 1747 г. кристаллы сахара в свекольном соке.
Из молока млекопитающих еще в XVII в. был получен кристаллический молочный сахар (лактоза). Лактоза менее сладкий дисахарид, чем сахароза.
А теперь познакомимся с углеводами более сложного строения — полисахаридами. Термин «полисахариды» логично приводит нас к выводу о том, что в молекулах этих углеводов между собой связано множество остатков моносахаридов, в первую очередь глюкозы.
| Полисахариды — это углеводы, которые гидролизуются с образованием множества молекул моносахаридов. Их относят к биополимерам. |
Общая схема гидролиза полисахаридов упрощенно может быть представлена так:
Сравним строение и свойства двух важнейших представителей полисахаридов — крахмала и целлюлозы.
Структурным звеном полимерных цепей этих полисахаридов, формула которых (С6Н10О5)л, являются остатки глюкозы. Чтобы записать состав структурного звена (С6Н10О5), необходимо из формулы глюкозы отнять молекулу воды.
Крахмал и целлюлоза имеют растительное происхождение и образуются из молекул глюкозы в результате реакции поликонденсации.
Для полисахаридов уравнение реакции поликонденсации и обратного ей процесса гидролиза условно можно записать так:
Степень полимеризации макромолекул крахмала (число структурных звеньев в макромолекуле полимера, обозначаемое индексом n в формуле вещества) меньше, чем у целлюлозы.
Молекулы крахмала имеют как линейное, так и разветвленное строение, а целлюлозы — только линейное строение.
В отличие от целлюлозы, крахмал дает синее окрашивание при взаимодействии с иодом (рис. 71). Это качественная реакция на крахмал.
Рис. 71.
Качественная реакция на крахмал
Различны и функции этих полисахаридов в растительной клетке. Крахмал играет роль запасного питательного вещества, а целлюлоза — структурную, строительную. Из целлюлозы построены стенки растительных клеток.
Рис. 72.
Применение целлюлозы:
1 — вата, марля и бинты; 2 — пластмасса (целлулоид); 3 — фотопленка; 4 — искусственные волокна и ткани; 5 — клей; 6 — порох; 7 — эмали и лаки; 8 — бумага и изделия из нее
Различно также использование целлюлозы (рис. 72) и крахмала (рис. 73) в промышленности. Образующуюся в результате гидролиза крахмала глюкозу применяют для производства медицинского и пищевого этилового спирта, используемого для приготовления ликероводочных изделий и лекарств. Этиловый спирт, полученный из целлюлозы, называют техническим и используют, например, как растворитель при производстве лакокрасочных материалов или для получения синтетических каучуков.
Рис. 73.
Применение крахмала:
1 — получение патоки; 2 — подкрахмаливание белья; 3 — приготовление киселей; 4 — производство этанола; 5 — выпечка кондитерских изделий
Технический спирт не предназначен для питья, он опасен для здоровья. Для того чтобы любители спиртного поостереглись применять его вовнутрь, в такой спирт добавляют специальные предупреждающие цветом и запахом добавки. Такой «помеченный» спирт называют денатуратом. Ежегодно от отравления фальшивой водкой, изготовленной с использованием технического спирта, в стране гибнет 50 ООО человек.
💥 Видео
Гидролиз солей. Практическая часть. 10 класс.Скачать

Гидролиз органических и неорганических соединенийСкачать

ЕГЭ. Химия. Гидролиз.Скачать

Углеводы: моносахариды, дисахариды и полисахариды. Нахождение в природе, свойства и применение.Скачать

Решение задач на проценты способом пропорции. 6 класс.Скачать

Степень электролитической диссоциации. Сильные и слабые электролиты. 9 класс.Скачать

9 класс. Гидролиз солей. Цепочки уравнений.Скачать

Когда начинать готовиться к ЕГЭ?Скачать