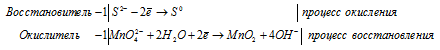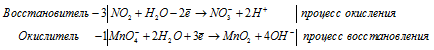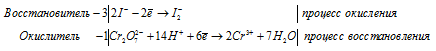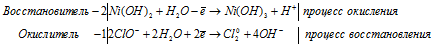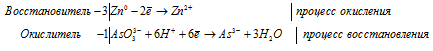Гидроксид хрома (III)
Гидроксид хрома (III) Cr(OH)3 – это твердое вещество серо-зеленого цвета.
Способы получения
1. Гидроксид хрома (III) можно получить действием раствора аммиака на соли хрома (III).
Например , хлорид хрома (III) реагирует с водным раствором аммиака с образованием гидроксида хрома (III) и хлорида аммония:
2. Пропусканием углекислого газа, сернистого газа или сероводорода через раствор гексагидроксохромата калия:
Чтобы понять, как протекает эта реакция, можно использовать несложный прием: мысленно разбить сложное вещество K3[Cr(OH)6] на составные части: KOH и Cr(OH)3. Далее мы определяем, как реагирует углекислый газ с каждым из этих веществ, и записываем продукты их взаимодействия. Т.к. Cr(OH)3 не реагирует с СО2, то мы записываем справа Cr(OH)3 без изменения. Гидроксид калия реагирует с избытком углекислого газа с образованием гидрокарбоната калия
3. Гидроксид хрома (III) можно получить действием недостатка щелочи на избыток соли хрома (III).
Например , хлорид хрома (III) реагирует с недостатком гидроксида калия с образованием гидроксида хрома (III) и хлорида калия:
4. Также гидроксид хрома (III) образуется при взаимодействии растворимых солей хрома (III) с растворимыми карбонатами, сульфитами и сульфидами . Сульфиды, карбонаты и сульфиты хрома (III) необратимо гидролизуются в водном растворе.
Например: бромид хрома (III) реагирует с карбонатом натрия. При этом выпадает осадок гидроксида хрома (III), выделяется углекислый газ и образуется бромид натрия:
Хлорид хрома (III) реагирует с сульфидом натрия с образованием гидроксида хрома (III), сероводорода и хлорида натрия:
Химические свойства
1. Гидроксид хрома (III) реагирует с растворимыми кислотами . При этом образуются средние соли.
Например , гидроксид хрома (III) взаимодействует с соляной кислотой с образованием нитрата хрома (III):
2. Гидроксид хрома (III) взаимодействует с кислотными оксидами сильных кислот .
Например , гидроксид хрома (III) взаимодействует с оксидом серы (VI) с образованием сульфата хрома (III):
3. Гидроксид хрома (III) взаимодействует с растворимыми основаниями (щелочами). При этом в растворе образуются комплексные соли . При этом гидроксид хрома (III) проявляет кислотные свойства.
Например , гидроксид хрома (III) взаимодействует с избытком гидроксидом натрия с образованием гексагидроксохромата:
4. Г идроксид хрома (III) разлагается при нагревании :
5. Под действием окислителей в щелочной среде переходит в хромат.
Например , при взаимодействии с бромом в щелочной среде гидроксид хрома (III) окисляется до хромата:
Видео:How to Balance Cr2O3 + Al = Cr + Al2O3 | Chromium (III) oxide + AluminiumСкачать

Опыт 37 — Опыт 45
Опыт 37
Совместный гидролиз сульфата хрома (III)
и карбоната натрия.
Результат:
1) Ионные уравнения реакций:
а) 2Cr 3+ + 3SO − 2 4+ 6Na + + 3CO 2− 3 = 2Cr +3 + 3CO 2− 3 + 6Na + + 3SO − 2 4
б) Cr2(CO3)3 + 3H2O = 2Cr(OH)3↓ + 3CO2↓
в) Cr2(SO4)3 + 3Na2CO3 + 3H2O = 2Cr(OH)3↓ + 3CO2↑ + 3Na2SO4.
Вывод:
Гидроксид хрома (III) проявляет свойства основания. Соли
хрома (III) сильно гидролизуются, вследствие чего невозмож-
но существование Cr2(CO3)3.
Для полного протекания гидролиза необходимо кипятить
раствор для удаления CO2.
Опыт 38
Перевод хроматов в дихроматы
и дихроматов в хроматы
Результат:
1) Ионные реакции проведенных реакций:
а) 2CrO − 2 4+ 2H + ⇔ Cr2O 2− 7 + H2O
Раствор переходит из темной окраски в более темную.
б) Cr2O 2− 7 + 2OH − ⇔ 2CrO − 2 4+ H + .
Раствор становится темным.
Опыт 39
Взаимодействие хромата калия с хлоридом бария
Результат:
1) Ионные уравнения реакции:
K2CrO4 + BaCl2= BaCrO4↓ + 2HCl.
В сокращенной форме:
CrO − 2 4+ Ba 2+ = BaCrO4↓
2) Образуется хромат бария, имеющий желтый цвет
Опыт 40
Окисление ионов Mn 2+ до ионов Mn 4 +
Результаты:
1) Ионные уравнения приведенных реакций:
Mn 2+ + 2OH − = Mn(OH)2↓
Образуется гидроксид марганца (II) имеющий розовую ок-
раску.
Mn(OH)2 + H2O = Mn(OH)4 + H2O
92
Гидроксид марганца (II) быстро темнеет, окисляясь даже
кислородом воздуха до гидроксида марганца (IV).
Опыт 41
Получение гидроксида железа (III)
и изучение его свойств
Результат:
1) Ионные уравнения проведенных реакций:
а) FeCl3 + 3NaOH = Fe(OH)3↓ + 3NaCl.
Образуется бурый осадок гидроксида железа (III).
б) 2Fe(OH)3 + 3H2SO4 = Fe2(SO4)3 + 6H2O
Происходит растворение гидроксида железа (III) в серной
кислоте с образованием желто-коричневого раствора.
Опыт 42
Получение гидроксида железа (III)
и изучение его свойств
Результат:
1) Уравнения проведенных реакций:
а) FeSO4 + 2NaOH = Fe(OH)2↓ + Na2SO4
бледно-зеленый
б) 4Fe(OH)2 + 2H2O + O2 = 4Fe(OH)3↓
красно-коричневый
в) Fe(OH)2 + 2HCl = FeCl2 + H2O
образуется бледно зеленый раствор.
93
Опыт 43
Качественные реакции на ионы Fe 3+ и Fe3+
Результат:
1) Уравнения проведенных реакций:
а) Fe 3+ + [Fe(CN)6] 4− = [Fe2(CN)6] −
синего цвета
б) Fe3+ + CNS− = Fe(CNS)3↓
темно-красный осадок
в) Fe2+ + [Fe(CN)6] 3 − = [Fe2(CN)6] − .
синего цвета
Опыт 44
Гидролиз солей железа (III)
Результат:
1) Ионное уравнение гидролиза солей на первой стадии.
а) Fe 3+ + CO 2− 3 = Fe2(CO3)3
б) Fe2(CO3)3 + 3H2O = 2Fe(OH)3↓ + 3CO2↑
Образуется осадок красно-коричневого цвета и выделяется
углекислый газ.
Опыт 45
Получение гидроксида никеля (II)
и изучение его свойств
Результат:
1) Уравнение реакции:
а) NiSO4 + 2NaOH = Ni(OH)2↓ + Na2SO4
Образуется осадок зеленого цвета.
94
2) Исследование характера гидроксида никеля.
а) Ni(OH)2 + 2HCl = NiCl2 + H2O
Происходит растворение гидроксида с образованием блед-
но-зеленого раствора.
б) Ni(OH)2 + NaOH ≠ — реакция не происходит.
задача №
к главе «ЛАБОРАТОРНЫЕ ОПЫТЫ».
Видео:How to find the Oxidation Number for Cr in Cr2O3 | Chromium (III) oxideСкачать

Составление уравнений в ионно-молекулярной форме
S 2 — + MnO4 2- + 2H2O = MnO2 + S 0 + 4OH —
После приведения членов обеих частей уравнения, получим:
Уравнение в ионно-молекулярной форме:
4K + + S 2- + MnO4 2- + 2H2O = S + MnO2 + 4K + + 4OH — .
После приведения членов обеих частей уравнения, получим:
Уравнение в ионно-молекулярной форме:
После приведения членов обеих частей уравнения, получим:
Для уравнивания добавим в уравнение 1 моль K2SO4, получим:
Уравнение в ионно-молекулярной форме:
После приведения членов обеих частей уравнения, получим:
Уравнение в ионно-молекулярной форме:
3Zn 0 + AsO3 3- + 6H + = 3Zn 2+ + As 3- + 3H2O.
После приведения членов обеих частей уравнения, получим:
🔥 Видео
How to Balance Cr + O2 = Cr2O3 (Chromium + Oxygen gas)Скачать

Cr2O7 2- + I2 = Cr3+ + IO3 - balance the chemical equation by half reaction method in an acidic mediСкачать

In the reaction`3Br_(2) + 6CO_(3)^(2-) + 3H_(2)O to 5Br^(-) + 2BrO_(3)^(-)+6HCO_(3)^(-)`Скачать

How to Write the Net Ionic Equation for HNO2 + Cr(OH)3 = Cr(NO2)3 + H2OСкачать

Cr(OH)_(3) + IO_(3) + OH^(-) = I^(-) + CrO_(4)^(2-) + H_(2)O | CLASS 12 | OXIDATION NUMBER AND B...Скачать

How to write the Equation for Cr(OH)3 + H2OСкачать

Balance the following by ion electron method (basic medium): `Cr(OH)_(3)+IO_(3)^( ?)rarrI^(?)+Cr...Скачать

The coefficients of I^(-), IO_(3)^(-) and H^(+) in the balanced redox reaction,I^(-) + IO_(3)^(-...Скачать

Cr2O7^2-+Fe^2++H^+=Cr^3++Fe^3++H2O balance the redox reaction in an acidic medium @mydocumentary838Скачать

Complete the following chemical equations : (i) `CH_(3)COOC_(2)H_(5)+NaOH rСкачать

Balance the following by ion electron method (basic medium): `Cr(OH)_(3)+IO_(3)^( ө)Скачать

How to Balance C3H8O + O2 = CO2 + H2OСкачать

Балансировка уравнения CrO3 = Cr2O3 + O2 (и тип реакции)Скачать

How to write the equation for FeCO3 + H2O | Iron (II) carbonate + WaterСкачать

How to find the Oxidation Number for I in HIO3 (Iodic acid)Скачать

Cr2O7-2+HNO2=Cr3++NO3- balance the chemical equation @mydocumentary838.Скачать
Redox Half Equation Example 2 (Cr2O7 2- to Cr3+)Скачать

Hybridization of `C_(2)` and `C_(3)` of `H_(3)C-CH=C=CH-CH_(3)` are:Скачать