Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Содержание
Видео:Получение алканов. Реакция Вюрца (механизм + сложные случаи). ЕГЭ по химии.Скачать  2 метил 2 хлорпропан уравнение вюрца
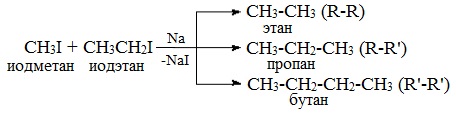
Легче реакция происходит с алкилиодидами и алкилбромидами, труднее – с алкилхлоридами. В результате образуется алкан с более сложной углеродной цепью. Реакцию обычно проводят в диэтиловом эфире. В процессе реакции Вюрца происходит удвоение углеводородного скелета молекулы и образуется насыщенный углеводород (алкан). Эта реакция находит ограниченное применение, поскольку таким путем можно получать только симметричные алканы. В основном с ее помощью получают предельные углеводороды с длинной углеродной цепью, особенно она полезна при получении индивидуальных углеводородов большой молекулярной массы (например, гептаконтана C70H142). Реакцию используют для получения углеводородов с четным числом С-атомов. Если ввести в реакцию два различных галогеналкана, то образуется смесь трех продуктов. Например, при взаимодействии метил- и этилиодидов с натрием наряду с пропаном образуется этан и бутан: Эта реакция была открыта французким химиком Ш. Вюрцем в 1855 г. при попытке получения этилнатрия из хлористого этила и металлического натрия. В 1864г. немецкий химик Р. Фиттиг предложил реакцию, подобную реакции Вюрца, для синтеза жирноароматических углеводородов (реакция Вюрца-Фиттига). Реакция Вюрца используется для первичных алкилгалогенидов. Для вторичных алкилгалогенидов не имеет практического значения, т.к выход целевого продукта составляет всего 10-15%. Реакцию Вюрца невозможно использовать для третичных алкилгалогенидов, т.к. вместо алкана с удвоенным числом атомов углерода образуется смесь алкана и алкена с исходным углеродным скелетом. Внутримолекулярная реакция ВюрцаРеакция Вюрца успешно применяется для внутримолекулярных конденсаций. Этим путем можно получать циклоалканы заданного строения. При взаимодействии 1,4-дибромбутана с металлическим натрием можно получить циклобутан: Из 1,3-дибромпропана под действием металлического цинка и йодида натрия, как активатора, может быть получен циклопропан: Видео:ЕГЭ Химия. Особенности реакции ВюрцаСкачать  Получение алканов, алкенов, алкинов. Крекинг 2-метилбутила. Реакция КольбеЗадание 7. 2. Какие соединения образуются при крекинге 2-метилбутила? 3. Назовите полученные соединения в следующих реакциях: 4. Закончите уравнения реакций 2-метилбутена-1 с бромной водой и бромоводородом:
1. Реакция Вюрцаа) Реакция Вюрца — химическая реакция, позволяющая получать простейшие органические соединения – предельные углеводороды. Данная реакция заключается в конденсации алкилгалогенидов под действием металлического Na, Li или реже K: В результате взаимодействия хлористого этила с 2-метил-2-хлорпропаном в присутствии металлического натрия образуется смесь глеводородов, состоящая из нормального бутана, 2,2-диметилбутана и 2,2,3,3-тетраметилбутана. а) Реакция Кольбе — электролиз растворов солей карбоновых кислот. На катоде идет процесс восстановления: 2Н2О + 2 На аноде идет процесс окисления: Таким образом при электролизе Кольбе у катода выделяется водород и образуется щелочной раствор, а у анода — углекислый газ и скапливается 2,2,3,3-тетраметилбутан. Данная реакция используется для получения насыщенных углеводородов в результате электролиза водных растворов натриевых или калиевых солей карбоновых кислот. 2. Крекинг 2-метилбутила.Установлено, что при пиролизе алканов происходит расщепление углерод-углеродных связей с образованием алкильных радикалов. Разрыв связей С-С происходит гомолитически с образованием свободных радикалов. Свободные радикалы 2-метилбутила очень активны за счет неспаренного электрона на внешней электронной оболочке, поэтому они могут вступать в реакцию димеризации (соединение одинаковых радикалов), образуя 3,6-диметилоктан. Схема димеризации 2-метилбутила: Может происходить и образование 2-метилбутана и 2-метилбутена-1. Это происходит тогда когда один из радикалов 2-метилбутила отщепляет атомарный водород Н. от другого и превращается в алкан (2-метилбутан). Другой же радикал, став двухвалентным, превращается в алкен (2-метилбутен-1) за счет образования пи-связи при спаривании двух электронов у соседних атомов углерода. Перенос атома (Н) от одного радикала к другому называентся диспропорционированием. Диспропорционирование, как правило, более медленный процесс, чем рекомбинация. Обе реакции экзотермичны и нередко идут одновременно. Схема реакции диспропорционирования 2-метилбутила: Радикал 2-метилбутил подвергается также ?-распаду с разрывом углерод-углеродной связи преимущественно у третичного атома углерода: Атом водорода, образующийся в результате процесса ?-распада 2-метилбутила, соединяется с другим радикалом 2-метилбутила, пополняя увеличение содержания в данной крекинговой смеси 2-метилбутана. Схема реакции 2-метилбутана и атомарного водорода: Таким образом, при пиролизе 2-метилбутила образуется сложная смесь алканов и алкенов, состоящая из 3,6-диметилоктана, 2-метилбутана, 2-метилбутена-1, пропилена и этилена. Схема крекинга 2-метилбутила: 3. Дегидратация гликолей (двухатомных спиртов, или алкандиолов):а) Внутримолекулярная дегидратация 2-метилбутандиола-1,41) Получение тетрагидрофуранов 1,4-Диолы и их производные превращаются в присутствии каталитических количеств минеральных кислот (серная кислота) в тетрагидрофуран и его гомологи. Так в присутствии серной кислоты при нагревании 2-метилбутандиол-1,4 превращается в 2-метилтетрагидрофуран: 2) Дегидратация гликолей (двухатомных спиртов, или алкандиолов) Дегидратация гликолей (двухатомных спиртов, или алкандиолов) протекает в присутствии серной кислоты и при нагревании с образованием диенов: б) Реакции отщепления галогенов в галогеналканах.При действии цинка на 1,1,2,2-тетрахлорпропан происходит отрыв всех 4-х атомов хлора с образованием пропина и выделением хлорида цинка: 4. Взаимодействие 2-метилбутена-1 с бромной водой и бромоводородом:а) Бромирование алкеновПрисоединение галогенов по двойной связи С=С происходит легко при обычных условиях (при комнатной температуре, без катализатора). Взаимодействие алкенов с бромной водой является качественной реакцией на обнаружение присутствия алкенов (бурая жидкость обесцвечивается). Так при прпускании б) Взаимодействие алкенов с галогеноводородамиЭлектрофильное присоединение галогенводородов к алкенам происходит по правилу Марковникова (присоединение электрофила происходит к наименее гидрогенизированному атому углерода. Электрофилом является протон Н+ в составе молекулы бромоводорода HBr. 📺 ВидеоВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и ПолучениеСкачать  Как решать ОРГАНИЧЕСКИЕ ЦЕПОЧКИ? Основные типы химических реакцийСкачать  ЭТО ПОМОЖЕТ разобраться в Органической Химии — Алкены, Урок ХимииСкачать  Реакция ВюрцаСкачать  Химия. Реакция Вюрца.Скачать  Химические свойства алканов. 1 часть. 10 класс.Скачать  Химические свойства алкановСкачать  Способы получения алканов / 10 класс. Углублённый уровеньСкачать  Всё о циклоалканах за 40 минут | Химия 10 класс | УмскулСкачать  Вся теория по алканам | Химия ЕГЭ для 10 класса | УмскулСкачать  Получение алканов. 10 класс.Скачать  Органическая химия с нуля | Химия ЕГЭ 2023 | УмскулСкачать  Все углеводороды за 6 часов | Химия ЕГЭ 2023 | УмскулСкачать  Окислительно-восстановительные реакции. 2 часть. 10 класс.Скачать  Химические свойства алканов | Химия ЕГЭ для 10 класса | УмскулСкачать  Химические свойства алкеновСкачать  ВСЯ ХИМИЯ за 10 класс в 1 уроке + таймкодыСкачать  Алканы. Решаем цепочки превращений.Скачать  |

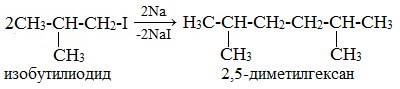
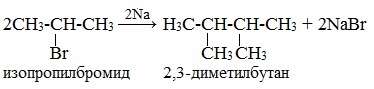
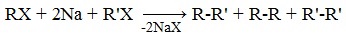
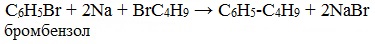
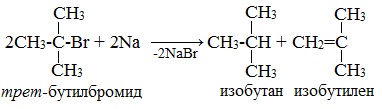
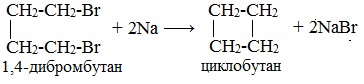
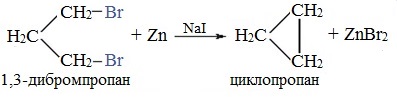





 ⇔ H2 + 2OH – . При этом у катода будет выделяться газообразный водород и щелочь — КОН.
⇔ H2 + 2OH – . При этом у катода будет выделяться газообразный водород и щелочь — КОН.







