ВВЕДЕНИЕ
Аналитическая химия — это наука, разрабатывающая теоретические основы,методы и средства химического анализа,определение химического состава исследуемого вещества и его строение.Химический анализ широко используется для контроля производства и качества продукции ряда отраслей народного хозяйства химической,нефтеперерабатывающей,пищевой,фармацевтической и др.Создание и совершенствование методов, средств и методик анализа – это основы аналитической химии.
Методы -это универсальные и теоретически обоснованные способы определения состава безотносительно к определенному компоненту и к анализируемому обьекту.
Средства – приборы, реактивы , стандартные образцы , программы для компьютеров и т.д.
Методика анализа – это подробное описание анализа данного обьекта с использованием выбранного метода.
В аналитической химии наряду с другими анализами можно выделить качественный и количественный анализы.
Качественный анализ решает вопрос о том, какие компоненты включает анализируемый обьект. Количественный анализ дает сведения о количественном содержании всех или отдельных компонентов.
Методы определения можно классифицировать по характеру измеряемого состава или по способу регистрации составляющего сигнала. Методы определения можно условно разделить : на химические, физические и биологические.
Химические методы базируются на химических ( в том числе электрохимических) реакциях. Физические методы основаны на физических явлениях и процессах, биологические – на явлении жизни. Основные требования к методам аналитической химии: правильность и хорошая воспроизводимость результатов, избирательность, экспрессность,простота анализа,возможность его автоматиз
Лабораторная работа № 1
СПОСОБЫ ПРОВЕДЕНИЯ АНАЛИТИЧЕСКИХ РЕАКЦИЙ В РАСТВОРЕ
Целью работы является знакомство с основными методами качественного анализа, овладение навыками проведения аналитических реакций.
Задание 1. Пробирочные реакции
Опыт 1. Реакция взаимодействия ионов меди с раствором аммиака.
Аммиак дает с ионом Сu 2+ зеленоватый осадок гидроксосульфата меди:
2СиS04 + 2NН4ОН (CuОН)2 + (NН4)2S04
В избытке аммиака осадок растворяется с образованием тетраамминокупро (II )сульфата, сообщающего раствору интенсивно синий цвет:
(Cu0Н)2S04 + (NН4)2S04 + 6NH4ОН 2[Cu(NH3)4]S04 + 8Н20
Выполнение реакции. К 2-3 каплям раствора соли CuS04 добавлять по каплям раствор аммиака до появления интенсивно синей окраски.
Опыт 2. Реакция взаимодействия ионов кальция с оксалатом аммония.
Оксалат аммония (NН4)2С2O4 осаждает из раствора солей Са 2+ белый мелкокристаллический оксалат кальция:
Са 2+ + С204 2- СаС204
Выполнение реакции. .К 1-2 каплям раствора соли кальция прибавить столько же оксалата аммония. Осадок растворим в минеральных кислотах, но не растворяется в уксусной. Нагревание способствует быстрому осаждению оксалата кальция.
Задание 2. Капельные реакции
Опыт 3. Реакция ионов алюминия с ализарином.
Выполнение реакции . На фильтровальную бумагу нанесите каплю раствора соли А1 3 и 1-2 минуты подержите над открытой склянкой с концентрированным аммиаком. Получившееся водянистое пятно гидроксида алюминия смочите каплей спиртового раствора ализарина и снова обработайте аммиаком. Красноватая окраска алюминиевого лака, т.е. ализарата алюминия А1(0Н)зС4Н5O2(0Н)2S03Na , становится более отчетливой после подсушивания
бумаги. Последнее необходимо также для удаления избытка аммиака, который сам дает с ализарином фиолетовое окрашивание.
Опыт 4. Реакция обнаружения ионов никеля.
. Ni 2+ — ионы в аммиачной среде образуют с диметилглиоксимом (реактив Чугаева) красный осадок внутрикомплексной соли диметилглиоксимата никеля:
Выполнение реакции. На фильтровальную бумагу поместить каплю раствора Nа2НР04 (подстилка), затем в центр пятна нанести каплю исследуемого раствора и опять каплю Nа2НР04. После этого по периферии обвести пятно раствором диметилглиоксима и выдержать над раствором аммиака. В присутствии ионов № 2+ образуется розовое кольцо.
Задание 3. Микрокристаллоскопические реакции
Опыт 5. Реакция обнаружения ионов кальция.
Выполнение реакции. К капле раствора соли кальция на предметном стекле прибавьте каплю 2н. Н2S04 и упарьте до появления каймы по краю капли. Рассмотрите игольчатые кристаллы гипса СаS04 *2Н20, собранные в пучки. Обнаруживаемый минимум — 0,04 мкг Ca.
Задание 4 .Реакции в «газовой камере».
Опыт 6.Реакция обнаружения ионов аммония.
Выполнение реакции.. Обнаружение ионов NH4 + проводят в газовой камере (чашка Петри) следующим образом: для проведения реакции берут чашку Петри. В нижнюю часть чашки Петри наносят 1-2 капли раствора соли аммония и 1-2 капли раствора NaОН. На верхнюю часть чашки Петри наносят каплю реактива Несслера или смоченную водой бумажку универсального индикатора. Накрывают нижнюю часть чашки Петри верхней частью. Через некоторое время на верхнем стекле с реактивом Несслера образуется осадок, а универсальный индикатор синеет вследствие образования гидроксильных ионов .
Лабораторная работа №2.
РЕАКЦИИ И АНАЛИЗ ПЕРВОЙ АНАЛИТИЧЕСКОЙ ГРУППЫ КАТИОНОВ
Целью работы является изучение реакций обнаружения и получение практических навыков выполнения аналитических реакций,характерных для катионов первой аналитической группы.
В первую аналитическую группу входят катионы Ag+, РЬ 2+ , Нg 2+ 2 , образующие с хлороводородной кислотой и её солями нерастворимые осадки хлоридов белого цвета АgС1, РЬСl2, Нg2Сl2 .
Общая характеристика катионов первой аналитической группы
Серебро (5S 4d 10 ) во всех соединениях имеет степень окисления +1 . Ион Ag является довольно сильным окислителем (Ag + /Ag 0 = +0.7986 В).
Галогениды серебра светочувствительны и. если осадок АgС1 долгое время стоит на свету, то он постепенно темнеет вследствие образования металлического серебра.
Свинец (6S 2 6р 2 ) может проявлять степени окисления +2 и -4. В ходе анализа приходится встречать только соединения свинца (II).
Ртуть (6S 2 5d 10 ) в первой аналитической группе имеет степени окисления +1, находится в виде двухвалентного иона. Этот ион имеет состав –Hg-Hg-, поэтому в формулах (Hg2(NO3)2:; Hg2Cl2 индексы при химических знаках на два сокращать нельзя. Ион ртути (I) в щелочной среде легко вступает в реакции диспропорционирования:
Hg2 2+ + 2e 2Hg 0
Hg2 2+ — 2e 2Hg 2+
При этом образуется ион двухвалентной ртути и металлическая ртуть. Тот факт, что ион ртути (I) является сильным окислителем, используется в анализе для его открытия в смеси катионов первой группы ( Hg2 2+ /Hg 0 =+ 0,86 В)
Едкие щёлочи с катионами первой группы образуют нерастворимые в воде гидроксиды AgОН, HgОН и Рb(ОН)2, из которых AgОН и HgОН очень неустойчивы и уже при своём образовании разлагаются на соответствующие труднорастворимые оксиды и Н2O, а гидроксид свинца, имеющий амфотерные свойства, при избытке щёлочи легко переходит в раствор с образованием соответствующего плюмбита:
1) AgNO 3+ NaОН AgОН + NaNO3
2АgOН Ag2O + Н20
2AgNO3 + 2NaOH Ag2OH + NaNO3+ Н20.
2) Hg2(NO3)2+2NaОН 2HgОH + 2NaNO3
2HgOH Hg2O +H2O
3) Pb(NO3)2+2NaOH 2NaNO3+Pb(OH)2
Соли серебра и сильных кислот имеют нейтральную реакцию — гидролизу не подвергаются.
Соли ртути (I) и свинца в результате гидролиза по катиону имеют кислую реакцию:
РЬ 2+ + Н2О ↔ PbOH + +H +
Особенно сильно подвергаются гидролизу соли ртути:
Серебро является (d-элементом и его ион легко вступает в комплексо образование с различными лигандами
В ходе анализа получают комплекс Аg+ с аммиаком — аммиакат серебра. Он получается при действии избытка раствора аммиака на нитрат, хлорид или оксид серебра. Например:
AgCl + 2NH4OH [Ag(NH 3)2]Cl+2H2O
Ag2O + 4NH4OH 2Ag(NH3)2(OH) + 3Н2O
Хлорид диамин серебра устойчив только в аммиачной среде и разлагается с выпадением белого осадка АgС1 при подкислении азотной кислотой:
[Ag(NH4)2] + Cl¯+ H + AgCl +2NH4
Эти реакции используют в анализе для отделения иона серебра из сложной смеси катионов и открытия его.
Хлорид диамин серебра при взаимодействии с КI даёт желтоватый «осадок, так как произведение растворимости его очень маленькая величина и в присутствии иона I аммиакатный комплекс разлагается по реакции
ПРAgI=10¯ 16 : [Ag(NH3)2Cl+KI AgI + KCl + 2NH3
Свинец является p-элементом и образует комплекс с гидроксид- ионом в сильнощелочной среде.
Ртуть (I) (d-элемент) образует комплекс с ионом иода и аммиаком При этом происходят реакции диспропорционирования — образуются комплексы ртути (II) и выпадает металлическая ртуть в виде чёрного осадка:
Нg2 2+ + 4I¯ [НgI4] 2¯ — + Нg 0
Нg2Сl2+2NH4ОН [Нg2NH2]Сl + 2Н2O+NH4Cl
[Нg2NH2]Cl [HgNH2]Cl + Hg
Все растворы катионов первой группы бесцветны.
Задание 1. Общие реакции на катионы I группы
Опыт 1. Пользуясь таблицей 2, проделать реакции с каждым катионом первой группы и реактивами Уравнения всех реакций записать в тетрадь, отмечая цвет раствора и осадка Для выполнения каждой реакции в пробирку брать 1-3 капли раствора соли данного катиона и столько же капель реактива. Если необходим избыток реактива, то его надо приливать вдвое больше.
| Табл.1 |
Соли серебра и ртути. сливать в отдельные сливные ёмкости
| Реактив | Условия проведения реакции | Катионы | ||
| Ag + | Pb 2+ | Hg2 | ||
| 1. HCl 2H-групповой реактив | — | AgCl белый творожистый | PbCl2 | Hg2Сl2 |
| 2.NH4OH | избыток | Ag(NH3)2+CI комплексная соль раствор | Pb(OH)2 белый | HgNHCl+Hg черный |
| 3. NaOH | недостаток | Ag2O бурый | Pb(O)2 белый | Hg2O черный |
| 4. NaOH | избыток | Ag2O | Na2Pb(OH)4 комплексная соль раствор | Hg2O черный |
| 5.K2СrО4 или . K2CrO7 | 2-3 капли | или Кирпичо- красный | PbCrO4 желтый осадок растворяется в горячей воде NaOH HNO3 | HgCrO4 красный осадок |
| 6. КI | 2-3 капли | AgI желтоватый растворяется в Na2S2O7 | PbI2 желтый растворяется в горячей воде CH3COOH | Hg2I2 зеленый |
| 7. Н2S04 2н | 2 капли | РЬS04 белый | Hg2SO4 белый |
К осадкам- хлоридов, полученным по пункту 1, добавить избыток раствора аммиака — пункт 2. Раствор аммиаката серебра [Ag(NH3)2 оставить для обнаружения иона серебра.
Только AgCl перейдёт в раствор по реакции
Задание 2. Реакции обнаружения катионов первой группы
Опыт 2. Обнаружение ионов
Полученный по табл. 2 (пункт 2) аммиакат серебра [Ag(NH3)2I разделить на две пробирки. В первую прибавлять по каплям 2н НNО4 до pH 2+ К полученному осадку прилить концентрированный раствор NaОН (6-8 капель, перемешивая наточкой) до растворения осадка:
РbСl2 + 4NaОН Na2[РЬ (ОН)4)] + 2NaС1
В полученном растворе можно открыть катион Рb 2+ : к раствору прибавить каплю К2Сr4O4 и добавлять по каплям HNO3 2н до pН 14 ):
Na2[Рb(ОН)4] + К2СrO4 + 4НNО3 РЬСrO4 + 2КNО3+2NaNО3+4Н20
[Рb(OH)4] 2- + CгO 2¯ 4 : + 4H + РЬСrO4 + 4Н2O
3.2 В пробирку с солью свинца прибавить 2 капли раствора KI при этом образуется жёлтый осадок РbI2 :
Рb(NO3)2 + 2КI =РbI2 +2КNO3
При нагревании осадки РbСl2, РbI2 растворяются, а при охлаждении растворов снова выпадают.
Опыт 4 . Обнаружение
Ион ртути обнаруживается путём прибавления раствора аммиака к солям ртути или к осадку Hg2Cl2 до pН >7. Выпадает чёрный осадок мелкодисперсной (металлической) ртути:
Hg(NO3)2 + 2NH4OH [HgNH2]NO3 + Hg + 3NH4NO3 + 2H2O
НgCl2 + 2NH4OH HgNH2Cl + Hg + NH4Cl + 2Н20
Контрольные вопросы :
Написать реакции действия избытка аммиака на катионы первой группы
1. При добавлении к осадку хлоридов первой группы раствора аммиака весь
осадок растворился. Какой ион был в осадке? Написать уравнение реакции.
2. При нагревании с водой осадок хлоридов первой группы весь растворился.
Какой ион присутствовал в растворе?
3. При добавлении избытка аммиака к раствору ионов первой труппы выпал белый осадок. Какой ион присутствует в растворе.’
ЛАБОРАТОРНАЯ РАБОТА № 3
РЕАКЦИИ И АНАЛИЗ ВТОРОЙ
АНАЛИТИЧЕСКОЙ ГРУППЫ КАТИОНОВ
Целью работы является изучение реакций обнаружения катионов второй аналитической группы . Получение практических навыков выполнения аналитических реакций.
Во вторую (сульфатную) группу входят катионы Ca 2+ , Sr 2+ , Ba 2+ . Групповым реагентом является 2н серная кислота. При этом образуются белые осадки СаSO4, SrSO4, BaSO4. Катионы образуют сульфаты различной растворимости. Произведения растворимости их следующие:
Наименее растворим сульфат бария, наиболее — сульфат кальция. В ходе анализа ион кальция осаждается серной кислотой не полностью и попадает в другие группы. Сульфаты не растворяются в кислотах. Трудно растворимы и карбонаты этих ионов. Произведения растворимости их такие: ПРсacоз=4,3*10 -9 ПРSrСO3 = 1,6* 10 -9 ПР BaCOз =8*10 -9 . Однако они растворимы даже в уксусной кислоте.
Видео:Качественные реакции на ион аммонияСкачать

Химия, Биология, подготовка к ГИА и ЕГЭ
Материал для задания 37 ЕГЭ (по-старому С2 ЕГЭ), для олимпиад, да и вообще для тех, кому нужны нормальные знания по химии
Автор статьи — Саид Лутфуллин
В статье приведены многие реакции, которые встречаются в ЕГЭ. Формулировки описания реакций тоже как в ЕГЭ, поэтому не удивляйтесь если встретите что-то вроде «…осадок растворяется в кислотах…», конечно же, он не растворяется, он реагирует с кислотой. Растворение – это немного другой процесс, но господа составители из ФИПИ со мной не согласны и упорно применяют в таких случаях именно этот термин.
Видео:ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

Уравнения качественных реакций неорганической химии.
(кликните на название категории, чтобы перейти в соответствующий раздел)
I. Элементы IA-группы (щелочные металлы)
– легкие металлы, настолько пластичные, что их можно разрезать ножом. Из-за чрезвычайной активности, на воздухе легко окисляются (некоторые со взрывом), поэтому их хранят в керосине, кроме лития. Литий хранить в керосине невозможно из-за физических свойств. Этот металл легче керосина, поэтому всплывает в нем. Литий хранят в вазелине или еще в чем-нибудь таком инертном и вязком.
Почти все соли щелочных металлов растворимы в воде.
Поэтому обнаружение их катионов выпадением осадка невозможно. Для определения катионов металлов используют метод пирохимического анализа.
Этот метод основан на способности ионов металлов, входящих в состав летучих солей, окрашивать пламя горелки в определенный цвет.
1) Li +
Окрашивает пламя горелки в карминово-красный цвет
Помимо этого, литий – один единственный щелочной металл, катион которого можно обнаружить с помощью осадка. Катион лития с фосфат-ионом дает белый осадок:
Сокращенное ионное уравнение:
3Li + + PO4 3- → Li3PO4↓
2) Na +
Окрашивает пламя горелки в желтый цвет.
3) K +
Окрашивает пламя горелки в фиолетовый цвет.
4) Rb +
Окрашивает пламя горелки в розово-фиолетовый цвет.
5) Cs +
Окрашивает пламя горелки в голубовато-фиолетовый цвет.
II. Щелочноземельные металлы (подгруппа кальция)
– металлы серого цвета. Твердые, ножом не режутся. На воздухе ведут себя спокойно: покрываются оксидной пленкой.
Определить катионы щелочноземельных металлов можно как с помощью выпадения осадка, так и с помощью пирохимического метода:
1. Ca 2+
Образует белый осадок с карбонат-ионом : CaCl 2 + K 2 CO 3 → CaCO 3 ↓ + 2 KCl
Сокращенное ионное уравнение: Ca 2+ + CO 3 2- → CaCO 3 ↓
Образуется карбонат кальция – мел. Так же карбонат кальция – составная часть накипи. Иногда можно встретить формулировку: «…белый осадок, растворимый в кислотах с выделением газа (без цвета, вкуса, запаха)…». Имеется в виду реакция карбонатов с кислотами:
Катион кальция окрашивает пламя горелки в оранжево-красный цвет .
2. Sr 2+
Образует белый нерастворимый в кислотах осадок с сульфат-ионом : SrCl 2 + K 2 SO 4 → SrSO 4 ↓ + 2 KCl
Сокращенное ионное уравнение: Sr 2+ + SO 4 2- → SrSO 4 ↓
Окрашивает пламя горелки в темно-красный цвет .
3. Ba 2+
Образует белый нерастворимый в кислотах осадок с сульфат-ионом : BaCl 2 + K 2 SO 4 → BaSO 4 ↓ + 2 KCl
Сокращенное ионное уравнение: Ba 2+ + SO 4 2- → BaSO 4 ↓
Катионы бария окрашивают пламя горелки в зеленый цвет
4. Mg 2+
Определяется, как и кальций, карбонат-ионами .
Карбонат магния – белый осадок: Mg ( NO 3 ) 2 + K 2 CO 3 → MgCO 3 ↓ + 2 KNO 3
Сокращенное ионное уравнение: Mg 2+ + CO 3 2- → MgCO 3 ↓
III. Be 0 (Be 2+ ), Zn 0 (Zn 2+ ), Al 0 (Al 3+ )
эти три металла объединяют амфотерные свойства. Поэтому если в задании встречается следующая формулировка: «…металл, растворимый в раствор е щелочи…», «…металл, который растворяется и в щелочах, и кислотах…» или «…металл, растворяющийся в щелочи с выделением горючего газа, легче воздуха…» , то имеют в виду один из этих трех металлов.
Ионы этих металлов в растворах тоже определяют добавлением щелочи.
Выпадает белый студенистый осадок (гидроксид металла), который в избытке щелочи растворяется (гидроксиды алюминия, цинка и бериллия реагируют со щелочами, образуя растворимые гидроксоалюминаты, гидроксоцинкаты и гидроксобериллаты соответственно):
BeCl 2 + 2 KOH → Be ( OH ) 2 ↓ + 2 KCl
(образование осадка) сокращенное ионное уравнение:
Be 2+ + 2 OH — → Be ( OH ) 2 ↓ Be ( OH ) 2 + 2 KOH → K 2 [ Be ( OH ) 4 ] (растворение осадка)
ZnCl 2 + 2 KOH → Zn ( OH ) 2 ↓ + 2 KCl (образование осадка)
сокращенное ионное уравнение: Zn 2+ + 2 OH — → Zn ( OH ) 2 ↓
Zn ( OH ) 2 + 2 KOH → K 2 [ Zn ( OH ) 4 ] (растворение осадка)
AlCl 3 + 3 KOH → Al ( OH ) 3 ↓ + 3 KOH (образование осадка)
сокращенное ионное уравнение:
Al 3+ + 3 OH — → Al ( OH ) 3 ↓
Al ( OH ) 3 + KOH → K [ Al ( OH ) 4 ] (растворение осадка)
Оксиды этих металлов, как и гидроксиды, растворяются в кислотах и щелочах, рассмотрим на примере оксида алюминия:
У гидроксида цинка есть характерная особенность: он растворяется в NH 3 (водн.)
Ион Zn 2+ с S 2+ образует белый осадок . Который растворяется в кислотах с выделением газа с запахом тухлых яиц – сероводорода (про него подробнее ниже, в разделе сера):
ZnSO 4 + K 2 S → ZnS ↓ + K 2 SO 4 (образование осадка)
Сокращенное ионное уравнение:
ZnS + H 2 SO 4 → ZnSO 4 + H 2 S ↑ (растворение осадка с выделением сероводорода)
Медь – пластичный розовато-красный металл.
Хороший проводник электрического тока.
Не вытесняет из кислот водород.
Реагирует только с кислотами-окислителями (азотной и концентрированной серной):
Оксид меди – CuO – черный – основный.
Растворяется в кислотах, окрашивая раствор в голубой цвет: CuO + 2HCl → CuCl 2 + H 2 O
Cu 2+
Летучие соли меди окрашивают пламя горелки в зеленый цвет. Соединения меди имеют голубоватую окраску , это можно использовать как диагностический признак.
В растворе ионы меди можно обнаружить добавлением щелочи выпадает растворимый в кислотах, голубой осадок, который используется в нескольких качественных реакциях органической химии.
Сокращенное ионное уравнение:
Осадок Cu ( OH ) 2 растворяется в избытке NH 3 (водн.) образуя интенсивно синий раствор:
Если нагреть осадок Cu ( OH ) 2 , то он почернеет. Потому что гидроксид меди( II ) – нерастворимое основание и разлагается:
Голубой – это фирменный цвет соединений меди, и если в задании ЕГЭ написано про этот цвет, то 90% вероятности, что говорят про соединение меди.
Серебро – мягкий благородный металл. Цвет серебристый.
Оксид серебра Ag 2 O- черный – основный.
Ag +
Катион серебра с хлорид-ионом дает белый творожистый осадок : AgNO 3 + KCl → AgCl ↓ + KNO 3
сокращенное ионное уравнение: Ag + + Cl — → AgCl ↓
Осадок хлорида серебра (и остальные галогениды) , как и гидроксида меди, растворяется в NH 3 * H 2 O
Еще одна особенность серебра, которая позволяет определить его ионы в растворе, – это его гидроксид, который нестабилен и быстро разлагается в водном растворе.
При добавлении к раствору соли серебра щелочи , выпадает черный осадок оксида серебра :
AgNO 3 + KOH → KNO 3 + AgOH
можно (и грамотнее) записать сразу:
То есть при добавлении к соли серебра щелочи выпадает черный осадок . Осадок оксида серебра , как и галогениды этого металла, растворяются в NH 3 (водн.) :
[ Ag ( NH 3 ) 2 ] OH – гидроксид диамминсеребра( I ) известен как раствор Толленса.
Он используется в качественной реакции на альдегиды (реакция серебряного зеркала).
Оксид серебра как основный гидроксид растворяется в кислотах (само собой, в тех, с которыми серебро может образовать растворимую соль):
Железо – серебристо-белый пластичный металл.
Обладает магнитными свойствами.
Вытесняет из растворов кислот водород (кроме азотной). Обратите внимание, что при взаимодействии с кислотами-неокислителями, и слабыми окислителями железо приобретает степень окисления +2, а при взаимодействии с сильными окислителями оно приобретет степень окисления +3:
2 Fe + 3 Cl 2 ( t )→ 2 FeCl 3
Катион Fe 3+
При добавлении к раствору, содержащему ионы трехвалентного железа , выпадает бурый осадок гидроксида железа ( III ):
Сокращенное ионное уравнение:
Оксид и гидроксид железа( III ) – амфотерные соединения, поэтому они растворяются в щелочах и кислотах:
Катион Fe 2+ с гидроксид ионом тоже образует осадок, только зеленоватого цвета .
Сокращенное ионное уравнение: Fe 2+ + 2 OH — → Fe ( OH ) 2 ↓
Оксид и гидроксид железа( II ) – основные.
В щелочах не растворяются. Осадок со временем буреет (меняет степень окисления с 2+ на +3):
На ионы железы есть еще две похожие канонические качественные реакции. Образуется одно и то же вещество: берлинская лазурь, или турнбулева синь.
Раньше считали, что это два разных вещества, в книжках писали: «не путайте», а потом оказалось, что это не так.
Ион Fe 2+ определяется добавлением красной кровяной соли (гексацианоферрат (III) калия):
4Fe 2+ + 3 [Fe III (CN) 6 ] 3− → Fe III 4 [Fe II (CN) 6 ] 3 ↓
Ион Fe 3+ определяется добавлением желтой кровяной соли (гексацианоферрат (II) калия):
4Fe 3+ + 3 [Fe II (CN) 6 ] 4− → Fe III 4 [Fe II (CN) 6 ] 3 ↓
Не очень активный, так как покрывается оксидной пленкой.
Название элемента переводится с греческого «цвет», потому что соединения хрома, как правило, окрашены. Простое вещество хром ведет себя как типичный металл, со щелочами не реагирует.
Реагирует с кислотами. Кислоты-неокислители ( в том числе разбавленная серная кислота) и вообще слабые окислители переводят хром в степень окисления +2:
Cr + S (t)→ CrS C окислителями приобретает степень окисления +3:
В общем тут все как у железа. Правило простое и вполне логичное.
С азотной и концентрированной серной кислотой не реагирует, так как пассивируется.
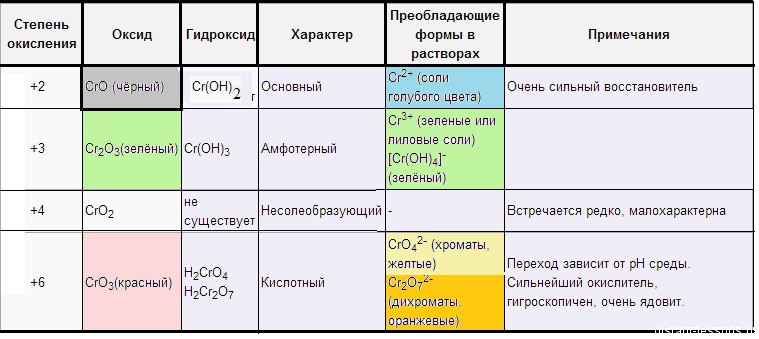
Проявляет несколько устойчивых степеней окисления.
Степень окисления +2
В этих соединениях хром проявляет сильные восстановительные свойства.
Оксид хрома ( II ) – CrO (основный) – черный.
Растворы солей Cr 2+ голубые . Если обработать черный оксид хрома( II ) соляной кислотой, образуется голубой раствор :
Если к раствору соли двухвалентного хрома добавить щелочь выпадет желтый осадок гидроксида хрома( II ), (осадок на воздухе зеленеет, об этом чуть позже):
Сокращенное ионное уравнение:
Гидроксид хрома( II ) основный,
поэтому он не растворяется в щелочах, зато прекрасно растворяется в кислотах, образуя все тот же синий раствор:
Степень окисления +3.
Оксид хрома( III ) – Cr 2 O 3 (амфотерный) – зеленый .
Как амфотерный оксид Cr 2 O 3 растворяется в кислотах и щелочах:
Соли трехвалентного хрома могут быть разного цвета (от фиолетового до темно-зеленого). Поэтому визуально опознать соль трехвалентного хрома со 100% уверенностью нельзя. Наличие катионов Cr 3+ в растворе определяется добавлением щелочи .
Cr 3+ с гидроксид-ионами образует зеленый осадок гидроксида хрома( III ) :
Сокращенное ионное уравнение:
Cr 3+ + 3 OH — → Cr ( OH ) 3 ↓
Выпавший осадок – гидроксид хрома( III ) амфотерный, поэтому растворяется в кислотах и щелочах, с образованием зеленых солей – гидроксохроматов :
Если оставить на некоторое время на воздухе желтый осадок гидроксида хрома( II ) , то он позеленеет . Cr +2 окисляется до Cr +3 ,
образуется зеленый гидроксид хрома( III ) :
Если подействовать на соединение хрома (+3) сильным окислителем, то произойдет смена окраски. Она станет желтой. Хром окислится до +6
Степень окисления +6.
В этих соединениях хром проявляет сильные окислительные свойства.
Оксид хрома( VI ) – CrO 3 (кислотный) – красный .
Окисляет многие органические соединения. Этот процесс описывают как «растворение [оксида хрома VI ] в спиртах (альдегидах, эфирах)»
Оксид кислотный, поэтому в кислотах не растворяется, растворяется в щелочах, с образованием хроматов:
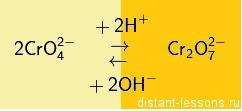
Хроматы – это соли хромовой кислоты ( H 2 CrO 4 ). Они желтого цвета. Кроме хромовой (хром +6) образует дихромовую кислоту ( H 2 Cr 2 O 7 ), ее соли – бихроматы (дихроматы) оранжевые .
Хроматы и бихроматы переходят друг в друга при изменении кислотности среды (с щелочной на кислую и наоборот):
То есть в кислой среде более устойчивы бихроматы, в щелочной хроматы.
Хроматы и бихроматы так же являются сильнейшими окислителями.
При добавлении к раствору хромата катионов бария выпадает желтый осадок хромата бария BaCrO 4 :
Сокращенное ионное уравнение: Ва 2+ + СrO 4 2- → BaCr O 4 ↓
Полученный хромат бария растворяется в сильных неорганических кислотах. Потому что, как уже говорилось ранее, в кислой среде хроматы не устойчивы и переходят в бихроматы:
2 BaCrO 4 + 2 H + → 2 Ba 2+ + Cr 2 O 7 2- + H 2 O
Компактная таблица цветов соединения хрома, приведена у нас в статье “Хром”:
Как и хром малоактивен за счет пассивации.
Реагируя с кислотами (даже с кислотами-окислителями), окисляется до +2:
Mn + HCl → MnCl2 + H2↑
Mn + 2H2SO4(конц.) → MnSO4 + SO2↑ + 2H2O
В более агрессивных средах с кислотами-окислителями процесс окисления идет глубже: до +4 и +7.
Кислородом окисляется до +4 (там конечно есть другие варианты с другими температурами, но мы их рассматривать не будем):
Галогены (кроме фтора) до +2:
Mn + Cl2 (t)→ MnCl2
Проявляет различные степени окисления.
Степень окисления 2+.
Степень окисления 2+. Оксид марганца( II ) – MnO (основный) зеленого цвета .
На воздухе очень быстро окисляется до темно-бурого MnO 2 :
Соли, содержащие катион Mn 2+ как правило имеют бледный светло-розовый цвет .
Катион Mn 2+ обнаруживают гидроксид-ионами, с которыми он образует розовато-белый осадок гидроксида марганца( II ), который окисляется на воздухе и буреет (превращается в бурый оксид марганца( II )):
MnCl 2 + 2 KOH → Mn ( OH ) 2 ↓ + 2 KCl
Сокращенное ионное уравнение:
Mn 2+ + 2 OH — → Mn ( OH ) 2 ↓
Степень окисления 4+. Оксид марганца( IV ) – MnO 2 (амфотерный) т емно-бурый – одно из самых устойчивых и встречаемых соединений марганца.
Mn +4 O 2 + 4 HCl → Mn +2 Cl 2 + Cl 2 ↑ + 2 H 2 O
Степень окисления +6. Оксид марганца( VII ) – Mn 2 O 7 (кислотный) зелено-бурая жидкость.
Очень не стабильное и агрессивное вещество, может спонтанно взорваться. Сильный окислитель.
Оксиду марганца( VII ) соответствует марганцевая кислота HMnO 4 .
Она существует только в водном растворе, который как и растворы ее солей (перманганатов) имеет фиолетово-малиновую окраску .
Перманганаты так же являются сильными окислителями.
В ЕГЭ часто встречаются реакции окисления органических веществ перманганатом калия – это классика:
Приведенное выше уравнение – это качественная реакция на кратные связи – обесцвечивание раствора перманганата и выпадение темно-бурого осадка.
Это весьма необычное вещество. Может быть, трудно представить, но среди всех простых веществ есть только два, которые при нормальных условиях находятся в жидком агрегатном состоянии. Это бром и ртуть.
В нормальных условиях ртуть – серебристо-белая жидкость, с высокой плотностью, поэтому она тонет в воде.
Сама по себе металлическая ртуть вреда не представляет, а вот ее пары и соединения (в особенности органические) чрезвычайно ядовиты.
Качественная реакция на Hg 2+ : при добавлении к раствору соли ртути( II ) щелочи выпадает оранжевый осадок ОКСИДА ртути , гидроксид не образуется, его не существует:
NH 4 + – ион аммония
Если добавить к раствору аммония (иногда нужно нагреть) щелочь образуется нестабильный гидроксид аммония, который разлагается. В ыделяется аммиак – газ с реким запахом (запах нашатырного спирта) :
Можно записать сразу: NH 4 NO 3 + KOH → NH 3 ↑ + H 2 O + KNO 3
Сокращенное ионное уравнение: NH 4 + + NO 3 — → NH 3 ↑ + H 2 O
Выделившийся газ (аммиак) может быть поглощен растворами кислот, с образованием солей аммония: NH 3 + HCl → NH 4 Cl
H +
– частица, в которую превращается атом водорода, отдав электрон.
Получается протон, понятное дело, такая частица в воде не существует.
Частица эта прикреплена по донорно-акцепторному механизму к атому кислорода в молекуле воды, получается ион гидроксония: H 3 O + .
О чем свидетельствует наличие в растворе такого иона?
Конечно же о том, что среда раствора кислая.
А для определения кислотности используют индикаторы.
Рассмотрим несколько индикаторов: лакмус фиолетовый , метиловый оранжевый , фенолфталеин .
Лучше учить названия индикаторов именно так, ведь в таких названиях заключена информации о цвете индикатора в нейтральной среде:
метиловый оранжевый – оранжевый,
| Индикатор | Цвет в кислой среде pH | Цвет в нейтральной среде pH = 7 Цвет в щелочной среде pH > 7 | |
| Лакмус фиолетовый | Красный | Фиолетовый | Синий |
| Метиловый оранжевый | Красный | Оранжевый | Желтый |
| Фенолфталеин | Нет (бесцветный) | Нет (бесцветный) | Малиновый |
Существует несколько мнемонических правил для запоминания цветов индикаторов:
Фенолфталеиновый в щелочах малиновый, но несмотря на это в кислотах он без цвета.
В кислотах лакмус красный – цвет такой прекрасный, а в щелочах он синий как январский иней, а в нейтральной среде фиолетовый, как нигде. (Этот стишок сочинили когда-то мы с товарищем. Хоть он не совсем складный и мы так и не можем объяснить, с чего бы это иней, который обычно белый, в январе вдруг станет синим, стишок как-то по-особенному запал в мою память, всегда им пользуюсь)
Кислота – начинается на букву К, как и слово «кислый» — помогает вспомнить цвет лакмуса и метилоранжа в кислотах.
– элементы VIIA -группы( F , Cl , Br , I ), типичные неметаллы.
Пойдем по порядку:
Фтор – F 2 – желтый газ с легким зеленым отливом. Самый электроотрицательный неметалл, поэтому с кислородом образует не оксид фтора, а фторид кислорода: OF 2 степень окисления кислорода в нем равна +2. Чрезвычайно активное вещество, реагирует со всем, с чем не лень. И большинство реакций протекает бурно, взрывообразно.
Фторид-ионы ( F — ) в растворе определяются добавлением катионов кальция ( Ca 2+ ), наблюдается выпадение белого осадка :
2 KF + CaCl 2 → 2 KCl + CaF 2 ↓
Сокращенное ионное уравнение: Ca 2+ + 2 F — → CaF 2 ↓
- Хлор – Cl 2 – зеленый газ, с характерным резким запахом, сильный яд, тяжелее воздуха (при химической атаке стелется по земле):
Хлорид-ионы ( Cl — ) в растворе определяются добавлением катионов серебра ( Ag + ), наблюдается выпадение белого творожистого осадка (об этой реакции говорилось ранее в разделе серебро):
KCl + AgNO 3 → AgCl ↓ + KNO 3
Сокращенное ионное уравнение: Ag + + Cl — → AgCl ↓
- Бром – Br 2 – красно-бурая летучая жидкость, имеющая очень резкий неприятный запах.
Бромд-ионы ( Br — ) в растворе определяются добавлением катионов серебра ( Ag + ), наблюдается выпадение слегка желтоватого осадка :
KBr + AgNO 3 → AgBr ↓ + KNO 3
Сокращенное ионное уравнение: Ag + + Br — → AgBr ↓
- Иод – I 2 – летучие черно-серые с фиолетовым отливом кристаллы. Пары фиолетовые, имеют характерный запах.
Иодид-ионы ( I — ) в растворе определяются добавлением катионов серебра ( Ag + ), наблюдается выпадение желтоватого осадка (цвет интенсивнее, чем у бромида серебра) :
Сокращенное ионное уравнение: Ag + + I — → AgI ↓
Осадки-галогениды не растворяются в разбавленных кислотах.
Простое вещество сера – хрупкие желтые кристаллы.
Сера может проявлять различные степени окисления:
Степень окисления -2:
в сульфИД-ионе ( S 2- ) и гидросульфИД-ионе ( HS — ).
СульфИДы (и гидросульфИДы) – это соли сероводородной кислоты, которая является слабым электролитом. Поэтому сильные кислоты вытесняют ее из растворов солей. Выделяется H 2 S – сероводород, газ с неприятным запахом тухлых яиц :
K 2 S + 2HCl → 2KCl + H 2 S↑
Сокращенное ионное уравнение: 2 H + + S 2- → H 2 S ↑
Выделившийся газ ( H 2 S ) на воздухе сгорает синим пламенем (не в смысле, что выделился и сразу сгорел, а если начать сжигать):
Так же сероводород ( H 2 S ) может быть поглощен растворами щелочей: H 2 S + 2 NaOH →
Сероводород является хорошим восстановителем, так как сера в нем в низшей степени окисления.
Еще одна особенность ионов S
2- позволяет легко определить их в растворе. Ионы S 2- образуют осадки со многими тяжелыми металлами:
- Классическая реакция с ионами Pb2+ . Образуется черный осадок сульфида серы :
- С ионами Cu 2+ , Fe 2+ , Ni 2+ , Cu 2+ , Pb 2+ , Hg 2+ , Ag + и ионами многих других металлов тоже образуются осадки черного цвета .
- С ионом Zn 2+ образуется белый осадок (один из немногих нечерных нерастворимых сульфидов):
Так как сера в сульфид-ионе в низшей степени окисления, она может окислиться. При действии сильных окислителей на сульфиды они окисляются до сульфатов (как правило). Классическая ЕГЭ-шная реакция, цитата из С2: «…черный осадок побелел после обработки его пероксидом водорода… ». Речь идет о
черном осадке сульфида свинца ( PbS ). Пероксид водорода H 2 O 2 (сильный окислитель) превращает черный сульфид свинца в белый (тоже нерастворимый) сульфат свинца ( PbSO 4 ):
Степень окисления + 4:
встречается в оксиде серы ( IV ) (сернистом газе – SO 2 ), в соответствующей этому оксиду кислоте – сернистой ( H 2 SO 3 , существующей только в растворе) и в солях сернистой кислоты – сульфИТах и гидросульфИТах.
Сернистый газ ( SO 2 ) – бесцветный газ с резким запахом (по легендам – запахом ада). Его можно почувствовать чиркнув спичку. Образуется при сжигании серы, сероводородов, сульфидов, серосодержащих органических веществ. Классическое школьное уточнение: « обесцвечивает раствор фуксина и фиолетовые чернила », при этом совсем не обязательно знать, что такое фуксин, и какие реакции протекают. Просто хорошо бы запомнить эту формулировку.
Так как является кислотным оксидом, реагирует с растворами щелочей. (формулировка из задания ЕГЭ: «…выделившийся газ с резким запахом был поглощен раствором щелочи…» ). Образуются соли сернистой кислоты – сульфиты:
СульфИТ-ионы и гидросульфИТ-ионы в растворе можно обнаружить добавлением сильной кислоты. При этом из раствора сульфита (гидросульфита) вытесняется сернистая кислота: H 2 SO 3 , которая не стабильная, поэтому быстро разлагается на воду и соответствующий оксид ( SO 2 ). То есть, если совсем коротко: при действии на сульфиты и гидросульфиты кислот выделяется SO 2 – газ с резким запахом (обесцвечивающий раствор фуксина и фиолетовые чернила):
Можно (и грамотнее) записать сразу:
Степень окисления +6
встречается в серном ангидриде (оксиде серы( VI ) – SO 3 ), в соответствующей ему серной кислоте ( H 2 SO 4 ) и в ее солях, сульфАТах.
Серный ангидрид ( SO 3 ) и серная кислота( H 2 SO 4 ) содержат серу в высшей степени окисления, поэтому являются сильными окислителями.
Сульфаты в растворе определяются добавлением катионов бария ( Ba 2+ ). Сульфат-ион с катионом бария образует белый осадок ( нерастворимый в кислотах ):
Сокращенное ионное уравнение: Ва 2+ + S O 4 2- → BaS O 4 ↓
CO 3 2-
– карбонат-ион и HCO 3 — – гидрокарбонат-ион
являются анионом слабой, нестабильной, существующей только в растворе, угольной кислоты. Поэтому она легко вытесняется сильными кислотами из растворов солей (карбонатов и гидрокарбонатов).
Вытесняется и тут же распадается на воду и углекислый газ.
При действии кислот на карбонаты выделяется бесцветный газ без вкуса и запаха :
Можно (и грамотнее) записать сразу: K 2 CO 3 + 2 HCl → 2 KCl + CO 2 ↑ + H 2 O
Эта качественная реакция вам хорошо известна, вы наверняка проводили ее у себя дома. Добавим уксус к соде, и как раз будет выделяться газ, в чем можно убедиться если поднести спичку, она погаснет, так как CO 2 не поддерживает горения:
Выделившийся углекислый газ может быть поглощен раствором щелочи:
В связи со способностью поглощаться щелочами для описания углекислого газа часто встречается следующая формулировка: «… газ, при пропускании его через известковую воду, вызвал ее помутнение… ». Известковая вода – это профильтрованный раствор гидроксида кальция (гидроксид кальция полностью не растворяется в воде, образуется взвесь, и чтобы получить прозрачный раствор – его фильтруют, для очищения от не растворившихся частиц гидроксида кальция). При взаимодействии гидроксида кальция с углекислым газом образуется нерастворимый карбонат кальция, который и обеспечивает мутность:
PO 4 3-
– анион ортофосфорной кислоты (H 3 PO 4 ). В растворе его можно определить добавлением катионов серебра , при этом выпадает интенсивно-желтый осадок :
Сокращенное ионное уравнение: 3 Ag + + PO 4 3- → Ag 3 PO 4 ↓
SiO 3 2-
– анион кремниевой кислоты ( H 2 SiO 3 ) , которая являясь слабым электролитом, вытесняется из растворов ее солей. Кроме того, кремниевая кислота малорастврима в воде, поэтому в момент вытеснения ее из раствора соли, появляется гелеобразный осадок – это и будет H 2 SiO 3 :
Кремниевая кислота настолько слабая, что вытесняется даже угольной:
– оксид азота ( VI ).
Ядовитый газ с неприятным запахом бурого цвета.
В ЕГЭ его обычно именно так и обзывают – бурый газ .
Химически очень активное вещество:
- при взаимодействии не очень активных металлов с HNO 3 концентрированной;
- при разложении нитратов этих металлов.
В реакции с водой диспропорционируется, образуя азотную и азотистую кислоты:
Похожая реакция диспропорционирования происходит при растворении NO 2 в щелочах (образуются не кислоты, а соли этих кислот, нитраты и нитриты соответственно):
В присутствии избытка кислорода реакция идет без образования азотистой кислоты (диспропорционирования не происходит):
OH —
Наличие в растворе ионов OH — указывает на щелочную реакцию среды ( pH >7).
Определить pH можно с помощью индикаторов.
Окраски индикаторов в разных средах указаны в пункте про ион H + . Щелочную среду имеют не только щелочи, но и растворы аммиака и аминов, растворы солей, образованных сильными основаниями и слабыми кислотами.
Если нужно определить щелочь, то к раствору надо добавить соль металла, образующего слабое основание. Щелочь с такой солью даст осадок гидроксида металла:
CuCl 2 + 2NaOH → Cu(OH) 2 ↓ + 2NaCl
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Техника выполнения аналитических реакций
Лабораторная работа № 1. Техника выполнения аналитических реакций.
1. Реакции окрашивания пламени.
Летучие соединения металлов при внесении их в неокрашенную часть пламени горелки или спиртовки окрашивают пламя в различные цвета, характерные для этих металлов. Реакции окрашивания пламени хорошо удаются только с летучими солями (хлоридами, нитратами, карбонатами).
Для проведения реакции ушко платиновой или нихромовой проволочки, впаянной в стеклянную трубочку, предварительно тщательно очищают. Для этого проволочку опускают в раствор концентрированной соляной кислоты, а затем вносят в пламя грелки. Эту операцию повторяют до тех пор, пока пламя горелки не перестанет окрашиваться. Затем раскаленной проволокой касаются порошка исследуемой соли (иногда кристаллическую соль заменяют раствором соли). Проволоку с прилипшими к ней кристалликами соли вносят в пламя спиртовки.
Опыт 1. Обнаружение солей различных металлов.
Проведите реакцию окрашивания пламени с солями:
а) натрия: стр. 131 [1], стр. 66 [2], стр. 348 [3][1];
б) бария: стр. 194 [1], стр. 128 [2], стр. 369 [3];
в) стронция: стр. 196 [1], стр. 128 [2], стр. 367 [3];
г) меди(II): стр. 412 [1], стр. 405 [3].
2. Реакции в «газовой камере».
Применение «газовых камер» удобно в случаях, когда в результате аналитической реакции образуется газообразное вещество. Простейшие газовые камеры можно сделать из двух чашек Петри (а), двух часовых стекол (б), часового стекла и воронки (в), закрытой кусочком ваты, а также из двух предметных стекол и маленького кусочка стеклянной палочки (г):
На внутреннюю поверхность воронки, часового или предметного стекла, чашки Петри большего размера помещают влажную pH-индикаторную бумажку (лакмусовая, фенолфталеиновая, универсального индикатора). На нижнее часовое или предметное стекло, чашку Петри меньшего размера помещают каплю исследуемого раствора и каплю раствора реагента. Накрывают воронкой (часовым или предметным стеклом, чашкой Петри большего размера) с индикаторной бумагой, которая через некоторое время изменяет свой цвет.
Для ускорения выделения газообразного аммиака газовую камеру слегка можно нагреть (40 0C) на водяной бане.
Опыт 2. Обнаружение иона аммония со щелочами в газовой камере: стр. 131 [1], стр. 67 [2], стр. 351 [3].
3. Микрокристаллоскопические реакции.
Микрокристаллоскопические реакции основаны на реакциях образования малорастворимых соединений, имеющих характерную форму, цвет и светопреломляющую способность. Для этого на чистое предметное стекло наносят капиллярной пипеткой 1-2 капли исследуемого раствора и добавляют 1-2 каплю раствора реагента. В ряде случаев раствор реагента помещают рядом с каплей анализируемого раствора и осторожно соединяют с ним стеклянной палочкой, не перемешивая. Затем стекло помещается на предметный столик микроскопа (увеличение в 70-120 раз) и рассматривают осадок, образовавшийся в месте соприкосновения капель. Если для исследования берутся очень разбавленные растворы, их концентрируют, осторожно упаривая над пламенем спиртовки или поместив предметное стекло на край теплой асбестовой сетки.
Опыт 3. Микрокристаллоскопическая реакция обнаружение ионов кальция по реакции образования кристаллов гипса CaSO4·2H2O: стр. 197 [1], стр. 129 [2], стр. 362 [3].
Опыт 4. Микрокристаллоскопическая реакция обнаружение ионов цинка по реакции образования кристаллов тетрароданомеркурата(II) цинка Zn[Hg(SCN)4]: стр. 341 [1],
стр. 173 [2], стр. 374 [3].
Опыт 5. Микрокристаллоскопическая реакция обнаружение ионов магния по реакции образования кристаллов фосфата магния-аммония MgNH4PO4: стр. 139 [1], стр. 200 [2],
стр. 384 [3].
4. Капельные реакции.
Капельные реакции проводят на фарфоровой пластинке с углублением, на часовом или предметном стекле, положив его на белую бумагу, или на фильтровальной бумаге. При этом на пластину или бумагу наносят 1-2 капли исследуемого раствора и 1-2 капли раствора реагента, дающего характерное окрашивание или образование кристаллов. Жидкость, нанесенная на бумагу, быстро распределяется по капиллярам, а окрашенное соединение адсорбируется на небольшой площади в середине пятна, что повышает чувствительность реакции. Наносить капли на пластику или на бумагу можно капиллярной пипеткой или стеклянной палочкой с заостренным концом.
Опыт 6. Обнаружение иона никеля(II) с диметилглиоксимом (реактивом Чугаева): стр. 349 [1], стр. 229 [2], стр. 416 [3].
Опыт 7. Обнаружение иона аммония реактивом Несслера: стр. 132[1], стр. 67[2], стр. 352[3].
Опыт 8. Обнаружение иона алюминия с ализарином: стр. 319 [1], стр. 168 [2],стр. 376 [3].
5. Метод растирания порошков.
В данном методе исследуемой твердое вещество помещают в фарфоровую ступку и растирают с примерно равным количеством твердого реагента. В результате реакции обычно образуется окрашенное соединение, по окраске которого и судят о наличии определяемого иона.
Опыт 9. Обнаружение иона кобальта(II): стр. 9 [2].
Опыт 10. Обнаружение ацетат-иона: стр. 9 [2].
1. . Курс качественного химического полумикроанализа. – М.: Химия, 1973.
2. , , . Аналитическая химия. – М.: Просвещение, 1979.
3. . Аналитическая химия. Аналитика. Ч. 1. Общие теоретические вопросы. Качественный анализ. – М.: Высш. шк., 2005.
[1] В данных источниках литературы, список которых приведен в конце методички, на указанных страницах можно найти подробное описание рассматриваемой качественной химической реакции.
🎬 Видео
Качественные реакции на анионы. 9 класс.Скачать
25. Схема реакции и химическое уравнениеСкачать

Все реакции разложения в неорганике | Химия ЕГЭ 2022 | УмскулСкачать

Качественные реакции на катионы. 9 класс.Скачать

Качественные реакции на ОГЭ по химии | УмскулСкачать

Экзо- и эндотермические реакции. Тепловой эффект химических реакций. 8 класс.Скачать

Все качественные реакции в органике | Химия ЕГЭ 2022 | УмскулСкачать

Объемные отношения газов при химических реакциях. 8 класс.Скачать

Химия | Тепловой эффект химической реакции (энтальпия)Скачать

Самые сложные реакции ионного обмена в ЕГЭ | Химия ЕГЭ 2022 | УмскулСкачать

Все качественные реакции органических соединений за 45 минут | Химия 10 класс | УмскулСкачать

Как составлять окислительно-восстановительные реакции? | ЕГЭ ХИМИЯ 2022 | СОТКАСкачать

Качественные реакции в органической химииСкачать

Качественные реакции на органические соединенияСкачать
Опыты по химии. Окраска пламени солями щелочных и щелочноземельных металловСкачать

Расчеты по уравнениям химических реакций. 1 часть. 8 класс.Скачать

Задачи на ВЫХОД ПРОДУКТА химической реакции | Расчет выхода продукта от теоретически возможногоСкачать