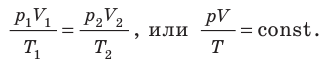Уравнение состояния идеальногогаза устанавливает зависимость между основными термодинамическими параметрами (давление р, температура Т, удельный объем 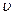
Идеальным газомназывается газ, в котором отсутствуют силы межмолекулярного взаимодействия, а объем молекул пренебрежимо мал. Важно, что при малом давлении (близком к атмосферному давлению) реальные газы с небольшой погрешностью можно считать идеальными газами.
Уравнение состояния идеального газа в 1834 г. установил французский физик Клапейрон.
Для 1 кг вещества уравнение Клапейрона имеет вид:
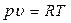
где R – удельная газовая постоянная, 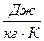
Удельная газовая постоянная R зависит от природы вещества и для разных газов она различна.
Для массы вещества М уравнение Клапейрона имеет вид:
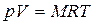
где V – объем вещества, м 3 , V = 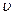
M – масса вещества, кг.
В 1874 г. русский ученный Менделеев применил уравнение Клапейрона к 1 киломолю вещества и получил универсальное уравнение состояния идеального газа, которое называется уравнением Менделеева-Клапейрона:
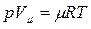
где 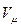
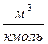
μR – универсальная газовая постоянная, 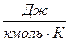
Универсальная газовая постоянная μR (в некоторых учебниках она обозначается Rμ) не зависит от природы вещества и для всех газов одинакова:
μR = 8314 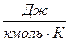
Существует однозначная взаимосвязь между универсальной газовой постоянной μR и удельной газовой постоянной вещества R, 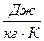
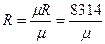
где 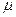
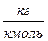
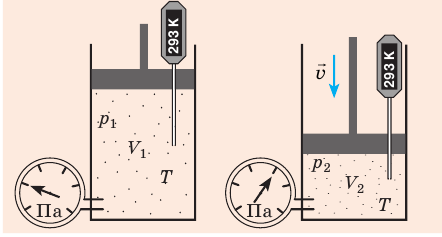
В технике широко применяется приведение газа или пара к определенным условиям. Для получения этих соотношений используем уравнение Клапейрона в виде
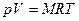
Разделим переменные и постоянные величины:
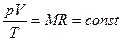
Следовательно, для любых состояний газа (при М=const) будет выполняться равенство соотношений:
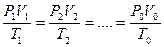
Пример. Определить во сколько раз измениться объем газа при нагреве от 20°C до 900°C, если давление и масса газа останутся неизменными.
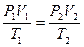
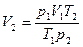
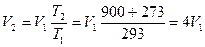
Ответ: объем газа при нагреве от 20°C до 900°C увеличится в 4 раза.
- Уравнение состояния идеального газа — основные понятия, формулы и определение с примерами
- Уравнение состояния идеального газа
- Уравнение Клапейрона
- Изопроцессы
- Какой процесс называют изотермическим. Закон Бойля — Мариотта
- Какой процесс называют изобарным. Закон Гей-Люссака
- Закон Гей-Люссака
- Изохорный процесс. Закон Шарля
- Закон Шарля
- Пример №1
- Пример №2
- Основы теплотехники
- Основные законы теплотехники
- Идеальные и реальные газы
- Газовые законы термодинамики
- Закон Бойля — Мариотта
- Закон Гей-Люссака
- Закон Шарля
- Закон Авогадро
- Закон Дальтона
- Уравнение состояния газа
- Уравнение Менделеева — Клайперона
- 💡 Видео
Видео:Урок 156. Уравнение состояния идеального газа. Квазистатические процессыСкачать

Уравнение состояния идеального газа — основные понятия, формулы и определение с примерами
Содержание:
Уравнение состояния идеального газа:
Уравнения Клапейрона и Менделеева — клапейрона; законы Шарля, Гей-Люссака, Бойля — Мариотта, Авогадро, Дальтона, — пожалуй, такого количества «именных» законов нет ни в одном разделе физики. за каждым из них — кропотливая работа в лабораториях, тщательные измерения, длительные аналитические размышления и точные расчеты. нам намного проще. Мы уже знаем основные положения теории, и «открыть» все вышеупомянутые законы нам не составит труда.
Видео:Физика 10 класс (Урок№20 - Уравнение состояния идеального газа. Газовые законы.)Скачать

Уравнение состояния идеального газа
Давление газа полностью определяется его температурой и концентрацией молекул: p=nkT. Запишем данное уравнение в виде: pV = NkT. Если состав и масса газа известны, число молекул газа можно найти из соотношения
Произведение числа Авогадро 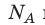
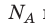
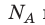
Обратите внимание! Состояние данного газа некоторой массы однозначно определяется двумя его макроскопическими параметрами; третий параметр можно найти из уравнения Менделеева — Клапейрона.
Уравнение Клапейрона
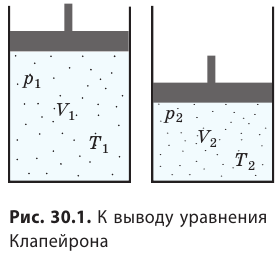
С помощью уравнения Менделеева — Клапейрона можно установить связь между макроскопическими параметрами газа при его переходе из одного состояния в другое. Пусть газ, имеющий массу m и молярную массу М, переходит из состояния (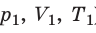
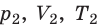
Для каждого состояния запишем уравнение Менделеева — Клапейрона: 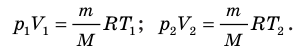
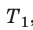
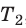
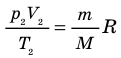
Для данного газа некоторой массы отношение произведения давления на объем к температуре газа является неизменным.
Изопроцессы
Процесс, при котором один из макроскопических параметров данного газа некоторой массы остается неизменным, называют изопроцессом. Поскольку состояние газа характеризуется тремя макроскопическими параметрами, возможных изопроцессов тоже три: происходящий при неизменной температуре; происходящий при неизменном давлении; происходящий при неизменном объеме. Рассмотрим их.
Какой процесс называют изотермическим. Закон Бойля — Мариотта
Пузырек воздуха, поднимаясь со дна глубокого водоема, может увеличиться в объеме в несколько раз, при этом давление внутри пузырька падает, поскольку вследствие дополнительного гидростатического давления воды (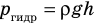
Рис. 30.2. Изотермическое сжатие газа. Если медленно опускать поршень, температура газа под поршнем будет оставаться неизменной и равной температуре окружающей среды. Давление газа при этом будет увеличиваться
Изотермический процесс — процесс изменения состояния данного газа некоторой массы, протекающий при неизменной температуре.
Пусть некий газ переходит из состояния (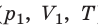
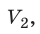
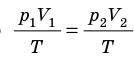
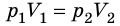
Закон Бойля — Мариотта:
Для данного газа некоторой массы произведение давления газа на его объем остается постоянным, если температура газа не изменяется:
Графики изотермических процессов называют изотермами. Как следует из закона Бойля — Мариотта, при неизменной температуре давление газа данной массы обратно пропорционально его объему: 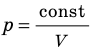
Какой процесс называют изобарным. Закон Гей-Люссака
Изобарный процесс — процесс изменения состояния данного газа некоторой массы, протекающий при неизменном давлении.
Пусть некий газ переходит из состояния (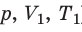
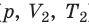
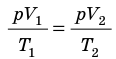
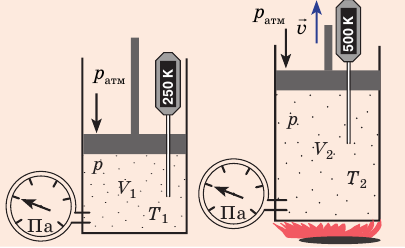
Рис. 30.4. Изобарное расширение газа. Если газ находится под тяжелым поршнем массой M и площадью S, который может перемещаться практически без трения, то при увеличении температуры объем газа будет увеличиваться, а давление газа будет оставаться неизменным и равным p
Закон Гей-Люссака
Для данного газа некоторой массы отношение объема газа к температуре остается постоянным, если давление газа не изменяется:
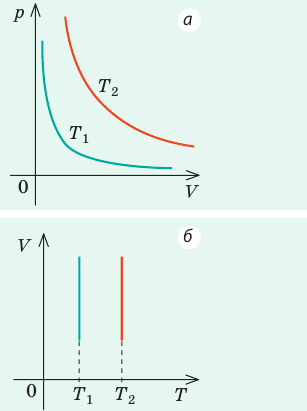
Графики изобарных процессов называют изобарами. Как следует из закона Гей-Люссака, при неизменном давлении объем газа данной массы прямо пропорционален его температуре: V = const⋅T. График данной зависимости — прямая, проходящая через начало координат (рис. 30.5, а). По графику видно, что с приближением к абсолютному нулю объем идеального газа должен уменьшиться до нуля. Понятно, что это невозможно, поскольку реальные газы при низких температурах превращаются в жидкости. В координатах p, V и p, T изобары перпендикулярны оси давления (рис. 30.5, б, в).
Изохорный процесс. Закон Шарля
Если газовый баллон сильно нагреется на солнце, давление в нем повысится настолько, что баллон может взорваться. В данном случае имеем дело с изохорным нагреванием.
Изохорный процесс — процесс изменения состояния данного газа некоторой массы, протекающий при неизменном объеме.
Пусть некий газ переходит из состояния (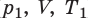
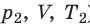
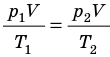
Рис. 30.6. Изохорное нагревание газа. Если газ находится в цилиндре под закрепленным поршнем, то с увеличением температуры давление газа тоже будет увеличиваться. Опыт показывает, что в любой момент времени отношение давления газа к его температуре неизменно:
Закон Шарля
Для данного газа некоторой массы отношение давления газа к его температуре остается постоянным, если объем газа не изменяется:
Графики изохорных процессов называют изохорами. Из закона Шарля следует, что при неизменном объеме давление газа данной массы прямо пропорционально его температуре: p T = ⋅ const . График этой зависимости — прямая, проходящая через начало координат (рис. 30.7, а). В координатах p, V и V, T изохоры перпендикулярны оси объема (рис. 30.7, б, в).
Пример №1
В вертикальной цилиндрической емкости под легкоподвижным поршнем находится 2 моль гелия и 1 моль молекулярного водорода. Температуру смеси увеличили в 2 раза, и весь водород распался на атомы. Во сколько раз увеличился объем смеси газов?
Анализ физической проблемы. Смесь газов находится под легкоподвижным поршнем, поэтому давление смеси не изменяется: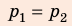
Решение:
Воспользуемся уравнением состояния идеального газа: pV = νRT. Запишем это уравнение для состояний смеси газов до и после распада: 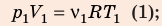
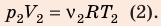
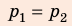
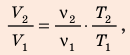
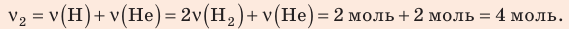
Ответ: примерно в 2,7 раза.
Пример №2
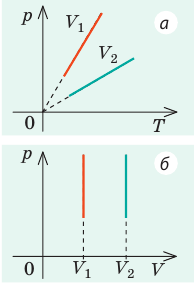
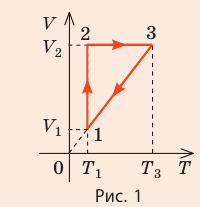
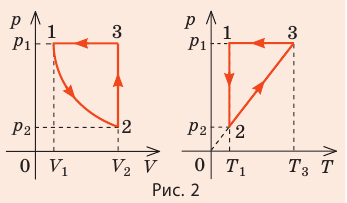
На рис. 1 представлен график изменения состояния идеального газа неизменной массы в координатах V, T. Представьте график данного процесса в координатах p, V и p, T.
Решение:
1. Выясним, какой изопроцесс соответствует каждому участку графика (рис. 1).
Зная законы, которым подчиняются эти изопроцессы, определим, как изменяются макроскопические параметры газа. Участок 1–2: изотермическое расширение; T = const, V ↑, следовательно, по закону Бойля — Мариотта p ↓. Участок 2–3: изохорное нагревание; V = const, T ↑, следовательно, по закону Шарля p ↑ . Участок 3–1: изобарное охлаждение; p = const , T ↓, следовательно, по закону Гей-Люссака V ↓ .
2. Учитывая, что точки 1 и 2 лежат на одной изотерме, точки 1 и 3 — на одной изобаре, а точки 2 и 3 на одной изохоре, и используя результаты анализа, построим график процесса в координатах p, V и p, T (рис. 2)
- Из соотношения p=nkT можно получить ряд важных законов, большинство из которых установлены экспериментально.
- Уравнение состояния идеального газа (уравнение Менделеева — Клапейрона):
— универсальная газовая постоянная.
- Уравнение Клапейрона:
- Законы, которым подчиняются изопроцессы, то есть процессы, при которых один из макроскопических параметров данного газа некоторой массы остается неизменным:
| Рекомендую подробно изучить предметы: |
|
| Ещё лекции с примерами решения и объяснением: |
- Температура в физике
- Парообразование и конденсация
- Тепловое равновесие в физике
- Изопроцессы в физике
- Абсолютно упругие и неупругие столкновения тел
- Механизмы, работающие на основе правила моментов
- Идеальный газ в физике
- Уравнение МКТ идеального газа
При копировании любых материалов с сайта evkova.org обязательна активная ссылка на сайт www.evkova.org
Сайт создан коллективом преподавателей на некоммерческой основе для дополнительного образования молодежи
Сайт пишется, поддерживается и управляется коллективом преподавателей
Telegram и логотип telegram являются товарными знаками корпорации Telegram FZ-LLC.
Cайт носит информационный характер и ни при каких условиях не является публичной офертой, которая определяется положениями статьи 437 Гражданского кодекса РФ. Анна Евкова не оказывает никаких услуг.
Видео:Уравнение состояния идеального газа. 10 класс.Скачать

Основы теплотехники
Видео:идеальный газ УРАВНЕНИЕ СОСТОЯНИЯ ИДЕАЛЬНОГО ГАЗАСкачать

Основные законы теплотехники
Идеальные и реальные газы
Превращение теплоты в механическую работу в тепловых установках происходит при участии рабочего тела, которым обычно является газ или пар. Газы, которые существуют в природе, называют реальными . Молекулы этих газов имеют конечный объем, между ними существуют силы притяжения, существенно влияющие на их энергетические параметры.

Для простоты изучения свойств газообразного рабочего тела введено понятие идеального газа – воображаемого газа, в котором молекулы рассматриваются, как материальные точки, обладающие некоторой массой, но силы взаимодействия между этими точками при анализе состояния рабочего тела и происходящих в нем процессов не учитываются.
При больших объемах и малых давлениях, когда расстояние между молекулами во много раз больше собственных размеров молекул, а также при высоких температурах, когда интенсивность хаотического движения молекул велика, и поэтому они слабо взаимодействуют между собой, складываются условия, при которых реальный газ можно с некоторым приближением считать идеальным.
Это позволяет вести расчеты для реальных газов по уравнениям и зависимостям, выведенным для идеальных газов, что упрощает сами расчеты и понимание сущности процессов, происходящих в газах. В связи с этим изучение термодинамических свойств идеальных газов имеет не только теоретическое, но и большое практическое значение.
Видео:Урок 145. Идеальный газ. Основное ур-ние МКТ ид. газа - 1Скачать

Газовые законы термодинамики
Основными законами для идеальных газов, применяемыми в термодинамике, являются закон Бойля — Мариотта, закон Гей-Люссака, закон Шарля и закон Авогадро. Эти законы устанавливают зависимости между основными параметрами газов – давлением, объемом, температурой и молекулярной массой.
Впоследствии газовые законы, описывающие процессы в термодинамических системах с одним неизменным и двумя переменными параметрами газа, были объединены учеными Клайпероном и Менделеевым в уравнениях, описывающей процессы системы при всех переменных параметрах рабочего тела.
Закон Бойля — Мариотта
Закон Бойля — Мариотта утверждает, что произведение абсолютного давления газа на его удельный объем в изотермическом процессе (при постоянной температуре) есть величина постоянная:
Чтобы понять смысловую суть этого закона следует представить термодинамическую систему, состоящую из цилиндра с подвижным поршнем, заполненного в надпоршневом пространстве газом (рис. 1) . Система термоизолирована — тепло к ней не подводится и не отводится.

Очень медленное перемещение поршня в этом случае необходимо для того, чтобы не вызывать изменение температуры газа в процессе сжатия или расширения.
Закон справедлив для термодинамических систем с идеальным рабочим телом, в которых неизменным параметром является температура, а переменными — давление и объем. Подобные процессы (протекающие при постоянной температуре) называют изотермическими — абсолютная температура рабочего тела в системе постоянна.
Это не означает, что исключен подвод (или отвод) тепла к термодинамической системе в целом, однако тепловая энергия в этом случае не должна оказывать влияние на температуру газа (рабочего тела), а использоваться, например, для выполнения работы путем преобразования в другой вид энергии. Процессы, при которых полностью исключается подвод и отвод тепла к термодинамической системе носят название адиабатных процессов .
Закон Бойля — Мариотта — один из основных газовых законов, открытый в 1662 году английским ученым Робертом Бойлем. В 1676 году, независимо от выводов Р. Бойля, закон был вторично описан французским физиком Эдмом Мариоттом, поэтому носит двойное название по фамилиям авторов.
Закономерность, установленная Р. Бойлем и Э. Мариоттом, справедлива для идеальных газов, но может быть с высокой степенью точности применима и для разреженных газов. Для сжатых газов применение закона Бойля — Мариотта приводит к большим погрешностям.
Следует отметить, что применение закона Бойля — Мариотта, связывающего начальные и конечные величины давления и объёма газа друг с другом, не ограничивается изотермическими процессами. Он с достаточной степенью точности справедлив и в тех случаях, когда в ходе термодинамического процесса температура изменяется, но начальная и конечная температура газа в результате процесса оказываются равными.
Закон Гей-Люссака
Закон Гей-Люссака гласит, что при постоянном давлении (изобарный процесс) удельный объем газообразного вещества (объем постоянной массы газа) изменяется прямо пропорционально изменению абсолютных температур:
Для простоты рассмотрим, опять же, термодинамическую систему, состоящую из цилиндра с абсолютно подвижным (трение между стенками цилиндра и поршнем отсутствует) и невесомым поршнем. Над поршнем в цилиндре поместим газ.
Очевидно, что при нагреве газа поршень переместится в сторону увеличения объема газа. При этом изменение объема газа будет прямо пропорционально изменению его абсолютной температуры, поскольку мы исключили изменение давления за счет отсутствия сил трения и тяжести, действующих на поршень.
Закон носит имя одного из своих первооткрывателей — французского физика и химика Жозефа Луи Гей-Люссака, описавшего его в 1802 году. В разных источниках (особенно, зарубежных) этот закон нередко упоминается под названием закон Шарля, по имени француза Жака Шарля, который описал его в неопубликованной работе, датируемой 1787 годом.
Авторство приписывают, также, таким видным ученым конца XVII — начала XVIII века, как английский физик Джон Дальтон и французский ученый Гийом Амонтон.
В русскоязычных учебниках этот закон обычно называют по имени Гей-Люссака, который первым продемонстрировал его применимость ко всем газам, а также к парам летучих жидкостей при температуре выше точки кипения.
Закономерность, описанная Ж. Л. Гей-Люссаком, справедлива в системах с одним неизменным параметром — давлением, и переменными параметрами — температура — удельный объем. Такие термодинамические процессы (протекающие при постоянном давлении) называют изобарными (иногда — изобарическими) .
Закон Шарля
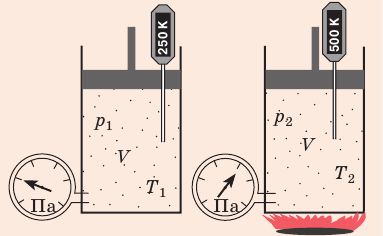
Закон Шарля, который иногда называют вторым законом Гей-Люссака, заключается в том, что при неизменном удельном объеме абсолютные давления газа изменяются прямо пропорционально изменению абсолютных температур:
Смысловое содержание закона Шарля проще понять, представив герметичный абсолютно жесткий сосуд, заполненный газом. Тогда при нагреве газа его давление будет увеличиваться прямо пропорционально увеличению абсолютной температуры, т. е. при увеличении абсолютной температуры в три раза, давление газа тоже возрастет в три раза и т. п.
Экспериментальным путем зависимость давления газа от температуры при постоянном объёме установлена в 1787 году Жаком Шарлем, который исследовал термодинамические процессы имеющие место в идеальных газах.
Труды Шарля опубликованы не были, но его идеи были подхвачены видными физиками — Гей-Люссаком, Гильомом Амонтоном и другими, поэтому вопросы авторства некоторых основных законов термодинамики являются предметом спора между специалистами до сих пор.
Закономерность, открытая и описанная Ж. Шарлем, справедлива в системах с неизменным параметром — удельным объемом, и переменными параметрами — температура — давление. Такие термодинамические процессы (протекающие при постоянном объеме) называют изохорными (иногда — изохорическими) .
Закон Авогадро
Закон Авогадро утверждает, что все газы при одинаковом давлении и температуре содержат в равных объемах одинаковое число молекул. Из этого закона следует, что массы двух равных объемов различных газов с молекулярными массами μ1 и μ2 равны соответственно:
где: m1 и m2 – соответственно масса одной молекулы рассматриваемых газов; N – число молекул во взятом объеме.
Массы молекул пропорциональны молекулярным массам:
где z – коэффициент пропорциональности.
Тогда можно записать:
откуда получим пропорциональную зависимость:
Поскольку мы взяли равные объемы газов, то, разделив числитель и знаменатель левой части уравнения на объем, получим:
где: ρ1 и ρ2 – плотность рассматриваемых газов.
Так как удельный объем v является величиной, обратной плотности, т. е. v = 1/ρ , то можно записать полученную зависимость в следующем виде:
т. е. произведение удельного объема на молекулярную массу постоянно для любого газа при одинаковых условиях (давлении и температуре) .
Закон Авогадро можно сформулировать и так: объем киломоля различных газов при аналогичных физических условиях одинаков.
Этот закон был описан в 1811 году итальянским физиком Амедео Авогадро.
Закон Дальтона
Рабочее тело, используемое в термодинамических установках, обычно представляет собой смесь нескольких газов. Например, в двигателях внутреннего сгорания в состав продуктов сгорания, являющихся рабочим телом, входят водород, кислород, азот, окись углерода, углекислый газ, водяные пары воды и некоторые другие газообразные вещества.
В 1801 году английский физик Джон Дальтон установил закон, согласно которому давление, оказываемое смесью равно сумме парциальных давлений отдельных газов, входящих в состав смеси.
Парциальным давлением называют давление компонента смеси, которое он создавал бы, находясь один в занимаемой смесью объеме при температуре смеси.
Это утверждение легко доказать основываясь на выводах из закона Бойля — Маритта, рассматривая парциальные компоненты газовой по отдельности и в смеси.
Закон Дальтона применим для идеальных газов, и может быть использован для реальных газов, имеющих близкие к идеальным физические свойства и параметры.
Уравнение состояния газа
Газовые законы, описанные в начале статьи, справедливы для систем, в которых хотя бы один параметр рабочего тела в процессе остается неизменным. Такие процессы, в зависимости от того, какой из параметр постоянен, называют изотермическими, изобарными или изохорными.
На практике обычно приходится наблюдать термодинамические процессы, во время которых изменяются все основные параметры рабочего тела — политропные процессы .
Для описания политропных процессов учеными Клайпероном и Менделеевым были предложены уравнения состояния газа, полученные, на основе анализа рассмотренных ранее газовых законов Бойля-Мариотта, Гей-Люссака, Шарля и Авогадро.
Предположим, что 1 кг газа переходит из состояния, характеризующегося параметрами p1 , v1 , T1 в другое состояние – с параметрами p2 , v2 , T2 . Допустим, что этот переход происходит сначала при постоянной температуре Т1 до промежуточного удельного объема v’ , а затем при постоянном давлении р2 до конечного удельного объема v2 .
Тогда по закону Бойля — Мариотта имеем:
Следующая часть процесса протекает при постоянном давлении, начинается параметрами газа p2 , v’ , T1 и заканчивается параметрами газа v2 , T2 и p2 (последний параметр остался неизменным после первого перехода) . Тогда, в соответствии с законом Гей-Люссака, можно получить выражение при p = const:
Приравняв найденное выражение для v’ в первой и второй частях (переходах) процесса, получим:
Преобразовав это равенство, имеем:
На основании полученного в результате уравнения, можно сделать вывод, что отношение произведения абсолютного давления газа на его удельный объем к абсолютной температуре есть величина постоянная. Для 1 кг газа эту величину называют удельной газовой постоянной и обозначают R :
pv/T = R или pv = RT .
Полученное уравнение называют уравнением состояния идеального газа или уравнением Клайперона.
Впервые это уравнение предложил французский физик и инженер Бенуа Поль Эмиль Клайперон, который долгое время жил и работал в России. Исследуя известный термодинамический цикл Карно, Клайперон в 1834 году вывел уравнение состояния идеального газа, которое носит его имя.
Так как R – величина постоянная для каждого газа, можно определить любой основной параметр газа, если известны два других его параметра.
Удельные газовые постоянные для большинства известных газов приведены в соответствующих справочных таблицах. Так, например, удельная газовая постоянная кислорода равна 259,8 Дж/(кг×К), углекислого газа — 188,9 Дж/(кг×К) и т. п.
Уравнение Менделеева — Клайперона
Если обе части уравнения состояния идеального газа (уравнения Клайперона) умножить на массу газа М , получим следующее выражение:
или, учитывая, что произведение массы на удельный объем это полный объем газа: Mv = V , получим:
Заменив в полученном уравнении объем газа его молекулярным объемом Vμ , а массу газа – молекулярной массой μ , получим уравнение состояния для 1 киломоля газа:
Уравнение состояния идеального газа в таком виде предложил в 1874 году Д. И. Менделеев, и, поскольку оно является частным случаем уравнения Клайперона, то носит название уравнения Менделеева — Клайперона для идеального газа (иногда его называют уравнением Клайперона — Менделеева) .
Из уравнения Менделеева — Клайперона можно определить универсальную газовую постоянную:
При нормальных физических условиях величина универсальной газовой постоянной равна
Используя универсальную газовую постоянную, легко определить величину удельной газовой постоянной для любого газа по формуле:
Скачать теоретические вопросы к экзаменационным билетам
по учебной дисциплине «Основы гидравлики и теплотехники»
(в формате Word, размер файла 68 кБ)
Скачать рабочую программу
по учебной дисциплине «Основы гидравлики и теплотехники» (в формате Word):
Скачать календарно-тематический план
по учебной дисциплине «Основы гидравлики и теплотехники» (в формате Word):
💡 Видео
Физика. МКТ: Уравнение Менделеева-Клапейрона для идеального газа. Центр онлайн-обучения «Фоксфорд»Скачать

Уравнение состояния идеального газа. Газовые законыСкачать

Уравнение состояния идеального газа | Физика 10 класс #33 | ИнфоурокСкачать

МКТ идеального газа. Уравнения состояния идеального газа | Физика, онлайн-форумСкачать

Универсальная молярная газовая постоянная. Уравнение Менделеева - Клапейрона 10 классСкачать

Уравнение состояния идеального газаСкачать

Уравнение состояния газаСкачать

10 класс урок №39 Уравнение состояния идеального газаСкачать

Урок 157. Изопроцессы и их графики. Частные газовые законыСкачать

Уравнение состояния идеального газаСкачать

Газовые законыСкачать

Идеальный газ. Основное уравнение молекулярно-кинетической теории газов. 10 класс.Скачать

Уравнение состояния идеального газа. Практическая часть. 10 класс.Скачать

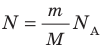
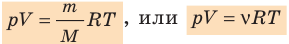
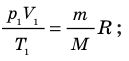
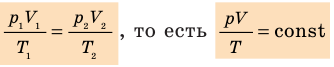
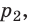
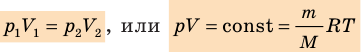

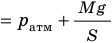
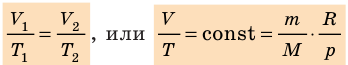
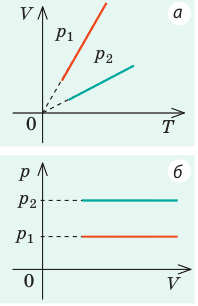

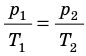
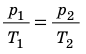
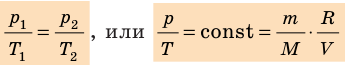

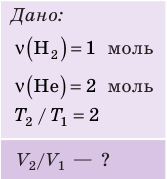
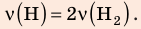

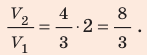
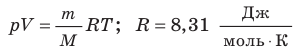 — универсальная газовая постоянная.
— универсальная газовая постоянная.